中国仓鼠自发性2型糖尿病基础代谢特征及相关基因的表达差异
2019-09-03王璐张锐虎王晨阳余婧婧宋国华王春芳陈朝阳
王璐,张锐虎,王晨阳,余婧婧,宋国华,王春芳,陈朝阳*
(1. 山西医科大学实验动物中心,太原 030000; 2. 山西省实验动物与人类疾病动物模型重点实验室,太原 030000)
中国仓鼠最早由Meier和Yerganign报道该群体近亲繁殖可自发产生糖尿病[1]。山医群体近交系中国仓鼠通过选择性繁殖培育,发现其空腹血糖(FBG)中轻度升高,且存在胰岛素抵抗(IR)现象,符合糖尿病的发病特征[2]。2型糖尿病(T2DM)的发病基础主要涉及IR和胰岛素分泌缺乏,由IR引起的糖代谢紊乱会造成脂代谢异常,形成糖脂代谢恶性循环,损伤胰腺组织,影响胰岛素分泌[3-4]。IR与脂肪分泌的细胞因子,如瘦素、脂联素等有密切的联系[5]。过氧化物酶体增殖体激活受体(PPARs)是脂肪细胞因子主要的调控子,其中PPARs主要参与脂肪组织中脂质摄取和脂肪形成相关基因的转录激活,Pparg基因突变可引发IR[6]。IR表现为外周组织(尤其是骨骼肌、脂肪组织)对葡萄糖摄取减少及肝葡萄糖输出作用减弱,使T2DM患者维持高血糖状态[5]。跨膜糖蛋白家族(GLUTs)参与细胞内葡萄糖的摄取与输出,其中葡萄糖转运蛋白4(GLUT4)与胰岛素敏感性关联较大,是胰岛素介导信号传导中的关键蛋白[7]。
本研究通过测定山医群体近交系中国仓鼠FBG、餐后血糖(PBG)、胰岛素含量、糖脂代谢、昼夜运动及新陈代谢情况,检测糖尿病相关基因Glut4和Pparg在骨骼肌、肝中的mRNA及蛋白表达情况,探究山医群体近交系中国仓鼠的基本代谢特征,为该品系动物T2DM分子发病机制的研究提供一定的基础,有助于进一步全面了解其发病特征。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级山医群体近交系中国仓鼠,10~12月龄,雌雄各半,由山西医科大学实验动物中心提供【SCXK(晋)2015-0001】,饲养于屏障环境(SYXK【晋】2015-0001),自由摄食饮水,饲料符合国家标准(GB14924.6-2001)《实验动物地鼠配合饲料》的要求。实验操作严格遵守山西医科大学实验动物管理委员会规程(IACUC2018-016)。
1.1.2 试剂与仪器
血液生化指标试剂盒(美国Sysmex公司);鼠ELISA试剂盒(美国Millipore公司);糖化血红蛋白(HbAlc)试剂盒(中国南京建成公司); ACCU-CHEK活力血糖仪(德国Roche Diagnostics GmbH公司);全自动生化仪(日本Hitachi公司)。
1.2 实验方法
1.2.1 模型建立
从3月龄开始,每月一次测定FBG和PBG。根据FBG和PBG的均值与95%频数分布值,将FBG ≤ 4.5 mmol/L且PBG < 6.0 mmol/L的鼠作为对照组,FBG ≥ 6.0 mmol/L且PBG > 7.0 mmol/L的鼠作为糖尿病组。每组12只,雌雄各半。
1.2.2 体重测定
从1月龄开始,每月称量一次体重并记录。在第3,6,9,12月龄测量体长(鼻尖到肛门的长度),计算体重指数(BMI)=体重(g)/体长平方(cm2)。体重和血糖值稳定后,选择12月龄中国仓鼠进行代谢指标检测。
1.2.3 口服葡萄糖耐量试验(OGTT)
动物禁食12 h,以10 g/kg体重的葡萄糖灌胃,测定灌胃开始后0、30、60和120 min时的血糖值。同时,在灌胃后0、15、30和60 min时,眼眶静脉丛取血(200 μL),4℃恒温离心(2500 r/min,20 min)取上清,测定胰岛素含量。根据梯形积分法计算曲线下面积(AUC)[8]。
1.2.4 生化指标及胰岛素含量的测定
动物禁食12 h,眼眶静脉丛取血,4℃恒温离心(2500 r/min,20 min)取上清,测定生化指标和血清胰岛素(FINS)含量,计算HOMA-IR=(FBG × FINS)/ 22.5[9]。
1.2.5 HbA1c含量的测定
动物禁食12 h,眼眶静脉丛取血(100 μL),置于含EDTA的抗凝管中,测定血液HbAlc百分比含量。
1.2.6 体成分监测
动物以50 mg/kg体重腹腔注射戊巴比妥钠(美国Sigma公司)麻醉,以趴卧姿势于InAlyzer双能X射线动物体成分检测仪(韩国Medikors公司)内,进行体成分分析,包括体重,脂肪、肌肉和骨矿物质含量,骨密度值及脂肪占组织百分比。
1.2.7 运动监测
动物放入高通量行为分析笼(荷兰Noldus公司),1只/笼,设置相关测量参数,对中国仓鼠运动路程和运动速度进行24 h(12 h/12 h昼夜交替)测量。
1.2.8 新陈代谢监测
动物放入开路热量测定代谢笼(美国Columbus Instruments公司),1只/笼,设置相关测量参数,对中国仓鼠呼吸交换率、能量消耗,摄食量及饮水量等进行24 h(12 h/12 h昼夜交替)测量。
1.2.9 基因mRNA检测
使用Trizol(Takara公司,日本)法提取中国仓鼠骨骼肌和肝的总RNA,以其为模板,通过PrimeScriptTMRT Master Mix(Perfect Real-Time)试剂盒(Takara公司,日本)反转录合成 cDNA。使用SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒(Takara公司,日本),在StepOnePlus实时荧光定量PCR仪(Applied Biosystems,美国)上进行PCR扩增。引物根据GenBank中国仓鼠β-Actin、Glut4和Pparg序列,用Primer Premier 5设计,由TAKARA大连宝生物公司合成,具体引物序列见表1。
实时荧光定量PCR反应条件(两步法):95°C预变性30 s,1个循环;95°C 5 s,60°C 30 s,40个循环。

表1 引物序列及相应的碱基数大小Table 1 Primer sequences with corresponding base numbers
1.2.10 蛋白含量测定
使用博士德生物蛋白提取试剂盒提取中国仓鼠骨骼肌和肝组织中的总蛋白,BCA 法测定蛋白浓度。样品上样量为50 μg,10% SDS-PAGE 凝胶电泳分离,转至NC膜,5%脱脂奶粉室温封闭1 h,一抗β-actin(1∶1000,Bioworld)、GLUT4(1∶1000,Boster)和PPARG(1∶1000,ABclonal)4℃过夜,洗膜,二抗(anti-mouse IgG,1∶4000,Bostser)室温孵育1 h,洗膜,使用ECL发光液,化学发光成像系统仪(G:Box Chemi XX9,英国)显影,分析蛋白条带。
1.3 统计学分析
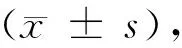
2 结果
2.1 体重及BMI变化
中国仓鼠体重随饲养时间的延长而逐渐增加(图1A),1~2月龄期间,雄性体重增长速度大于雌性。同月龄相比,对照组与糖尿病组的体重变化在相同性别间无显著差异(图1A)。BMI值比较发现,雄性BMI值高于雌性,9月龄时,雄性糖尿病组BMI值显著低于对照组,而雌性糖尿病组与对照组间无显著差异(图1B)。12月龄时,同性别相比,糖尿病组BMI值显著低于对照组(图1B)。
2.2 中国仓鼠糖尿病鼠的代谢特征
中国仓鼠糖尿病血液相关代谢指标如表2所示,与对照组相比,糖尿病组FBG、PBG、TG、胰岛素和HOMA-IR值明显升高,血清TC含量有一定程度的增加,但无统计学差异。HbA1c作为高血糖的标记物,糖尿病组中的含量约为对照组的1.3倍。这些结果表明糖尿病仓鼠存在IR和一定的代谢异常。
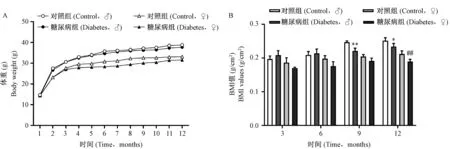
注:与对照组雄性相比,*P< 0.05,**P< 0.01。与对照组雌性相比,##P< 0.01。图1 中国仓鼠对照组与糖尿病组体重和BMI值变化Note. Compared with the male hamsters in control group,*P< 0.05,**P< 0.01. Compared with the female hamsters in control group, ##P< 0.01.Figure 1 Changes in body weight and BMI of the Chinese hamsters in control and diabetes groups

组别Groups空腹血糖(mmol/L)FBG餐后血糖(mmol/L)PBG总胆固醇(mmol/L)TC甘油三酯(mmol/L)TG糖化血红蛋白(%)HbA1c胰岛素(μU/mL)Insulin胰岛素抵抗指数HOMA-IR对照组Control 3.96 ± 0.165.81 ± 0.424.29 ± 0.541.84 ± 0.656.57 ± 1.1236.25 ± 8.276.31 ± 1.29糖尿病组Diabetes 6.90 ± 0.37***7.85 ± 0.63**4.58 ± 0.552.66 ± 0.62***9.16 ± 1.46***52.15 ± 13.05*14.78 ± 3.51***
注:与对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the control group,*P< 0.05,**P< 0.01,***P< 0.001.
2.3 OGTT实验和胰岛素含量
中国仓鼠OGTT实验结果如图2A所示,灌服葡萄糖30 min,糖尿病鼠的血糖值与对照组相比大幅升高(图2A),30 min后对照组的血糖值逐渐下降并在120 min时接近正常水平,而糖尿病组在120 min时仍维持在较高水平,最终使糖尿病组AUC增加了40%(图2B),说明糖尿病鼠葡萄糖代谢已受损。
OGTT过程中血清胰岛素变化趋势如图2C所示,在0~15 min,对照组和糖尿病组血清胰岛素水平均逐渐升高,30 min时,对照组胰岛素含量开始下降而糖尿病组仍在升高,最终使糖尿病组AUC明显增加(图2D),表明糖尿病仓鼠对葡萄糖刺激的胰岛素分泌系统存在一定的缺陷。
2.4 体成分含量
中国仓鼠体成分结果如表3所示,与对照组相比,糖尿病组脂肪含量及脂肪/组织百分比显著降低,脂肪/组织百分比约下降37%,相反,肌肉含量百分比明显高于对照组,说明该模型为非肥胖型糖尿病动物模型。此外,骨矿物质含量、骨面积和骨体积,糖尿病组略高于对照组,但无统计学差异。
2.5 运动及呼吸代谢分析
中国仓鼠昼夜运动变化如表4所示,同组昼夜间活动量差异显著,且夜晚运动路程长。与对照组相比,糖尿病组白天活动量明显增加(P< 0.05),夜晚活动量略有减少,但未达到统计学差异。饮水量,对照组夜晚明显多于白天(P< 0.001),糖尿病组夜晚比白天多,但无统计学差异。同组间摄食量夜晚明显多于白天,且与对照组相比,糖尿病组白天摄食量显著增加,约为对照组的3.5倍。糖尿病组RER值夜晚明显低于对照组(P< 0.05)。热量消耗,同组间白天比夜晚少,与对照组相比,糖尿病组夜晚热量消耗明显增加。

注:与对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。图2 中国仓鼠对照组和糖尿病组OGTT实验及胰岛素含量结果Note. Compared with the control group,*P< 0.05,**P< 0.01,***P< 0.001.Figure 2 Oral glucose tolerance test (OGTT) and insulin secretion of the Chinese hamsters in control and diabetes groups
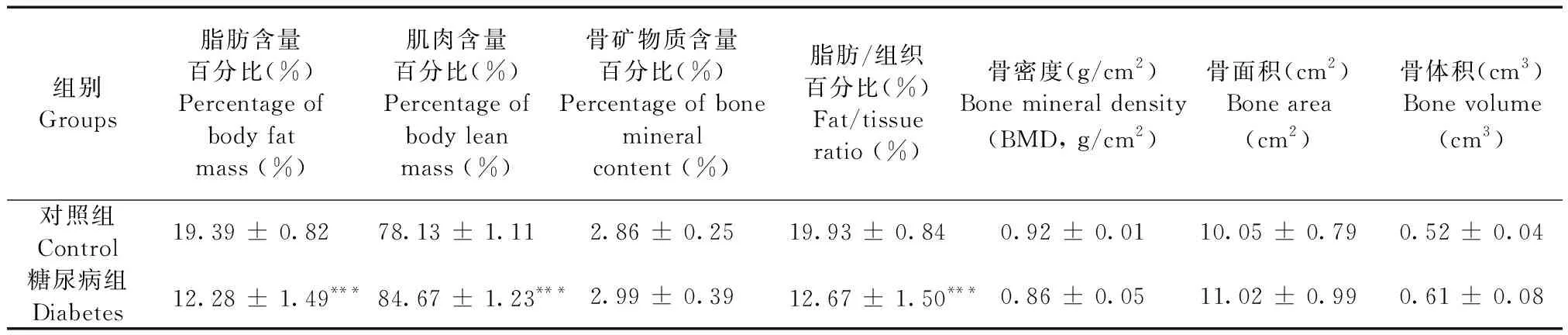
组别Groups脂肪含量百分比(%)Percentage of body fat mass (%)肌肉含量百分比(%)Percentage of body leanmass (%)骨矿物质含量百分比(%)Percentage of bone mineral content (%)脂肪/组织百分比(%)Fat/tissue ratio (%)骨密度(g/cm2)Bone mineral density (BMD, g/cm2)骨面积(cm2)Bone area(cm2)骨体积(cm3)Bone volume (cm3)对照组Control19.39 ± 0.8278.13 ± 1.112.86 ± 0.2519.93 ± 0.840.92 ± 0.0110.05 ± 0.790.52 ± 0.04糖尿病组Diabetes12.28 ± 1.49***84.67 ± 1.23***2.99 ± 0.3912.67 ± 1.50***0.86 ± 0.0511.02 ± 0.990.61 ± 0.08
注:与对照组相比,***P< 0.001。
Note. Compared with the control group,***P< 0.001.
2.6 候选基因的表达
中国仓鼠糖尿病组GLUT4在不同组织中的表达不同,骨骼肌中GLUT4在mRNA和蛋白表达水平明显降低(图3A);肝中,GLUT4在mRNA水平表达增加,而在蛋白水平有下降的趋势,但无统计学意义(P=0.053,图3B)。此外,与对照组相比,糖尿病组PPARG在骨骼肌mRNA和蛋白水平(图3C),以及肝蛋白水平(图3D)的表达均明显增加。
3 讨论
T2DM是一种复杂的代谢性疾病,常伴随着糖脂代谢、呼吸代谢及身体组分等一系列异常变化。近交系中国仓鼠具有自发性糖尿病倾向,FBG和PBG呈中轻度增高,糖耐量曲线下面积增大,糖耐量受损。糖耐量受损被认为是人类T2DM发生的先兆[10],机体由葡萄糖耐受不良发展为糖尿病的过程,与胰岛素分泌不足或胰岛素对葡萄糖的敏感性有关[11]。糖尿病仓鼠血清胰岛素含量和HOMA-IR值增大,存在胰岛素抵抗,在糖耐量过程中胰岛素分泌异常,葡萄糖摄入30 min后血清胰岛素含量仍在增加,而对照组胰岛素含量已经开始下降。这些结果表明糖尿病鼠产生胰岛素抵抗可能是由胰岛素敏感性下降引起,体内持续的高血糖状态导致胰岛B细胞过度刺激,最终影响机体糖代谢。
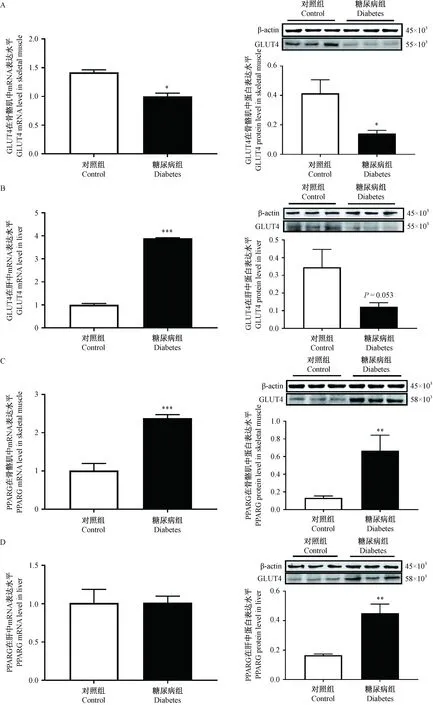
注:与对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。图3 中国仓鼠对照组和糖尿病组中GLUT4和PPARG在骨骼肌和肝中的表达Note. Compared with the control group,*P< 0.05,**P< 0.01,***P< 0.001.Figure 3 Expression of GLUT4 and PPARG in the skeletal muscle and liver tissues of Chinese hamsters in control and diabetes groups

组别Groups运动路程(m)Distance (m)运动速度(cm/s)Velocity (cm/s)摄食量(g/天)Food intake(g/day)饮水量(mL/天)Water intake(mL/day)呼吸交换率(RER)Respiratory exchange rate (RER)热量消耗(kcal/min)Heat consumption (kcal/min)对照组Control白天Day286.67 ± 55.831.06 ± 0.210.525 ± 0.2860.157 ± 0.0890.987 ± 0.0540.035 ± 0.002夜晚Night524.12 ± 44.81***1.36 ± 0.0932.911 ± 0.736*1.726 ± 0.109***1.025 ± 0.0740.048 ± 0.003**糖尿病组Diabetes白天Day 361.07 ± 30.73*1.07 ± 0.0961.963 ± 0.160**0.167 ± 0.1170.942 ± 0.0610.049 ± 0.002**夜晚Night466.34 ± 45.83#1.32 ± 0.194.187 ± 0.468#2.624 ± 0.4360.929 ± 0.098a0.057 ± 0.003a
注:与对照组白天相比,*P< 0.05,**P< 0.01,***P< 0.001。与模型组白天相比,#P< 0.01。与对照组夜晚相比,aP< 0.05。
Note. Compared with the control group during the day,*P< 0.05,**P< 0.01,***P< 0.001. Compared with the diabetic group during the day,#P< 0.01. Compared with the control group during the night,aP< 0.05.
体重和能量代谢的生理调节是小型哺乳动物应对环境变化的主要策略,对增强适应能力,提高生存机会具有重要意义[12-13]。中国仓鼠体重随饲养时间的延长而逐渐增加,12月龄时,同性别间糖尿病组与对照组的体重无显著差异,BMI值降低,体脂率下降,说明中国仓鼠属于非肥胖型糖尿病动物模型。现有的糖尿病动物模型中,GK大鼠[14]为非肥胖型,而NSY小鼠[15]、TH小鼠[16]及长爪沙鼠[17]均存在一定程度的肥胖,暗示不同动物在应对环境变化时,体重调节策略和脂质代谢机制存在一定的差异。动物机体自身具备各自的脂代谢系统,血浆中的脂类含量是临床了解患者脂类代谢是否正常的重要指标[18]。中国仓鼠糖尿病组空腹血清TG和TC含量增加,脂质代谢发生异常。Roden等[19]报道,健康个体静脉注射甘油三酯乳剂可降低肌肉糖原合成和葡萄糖摄取速率。因此,严重高甘油三酯血症可能先于高血糖的发生,从而促进中国仓鼠自发性糖尿病的发生。
机体常用的供能方式为糖代谢供能和脂肪氧化供能,RER值可以间接反应机体的供能物质,RER值越接近1,主要通过利用碳水化合物供能,越接近0.7,以脂肪氧化供能为主[20]。对照组中国仓鼠夜晚RER>1,摄食量、饮水量、运动量和热量消耗明显高于白天,可能夜晚进食阶段机体利用碳水化合物合成脂肪或夜晚剧烈运动消耗能量。糖尿病组昼夜RER值降低,且夜晚RER值显著低于对照组,表明动物部分供能方式由碳水化合物供能转向脂肪氧化供能,结果可能会造成机体脂质过氧化物的增加。卢镜宇等[21]研究发现,高脂饮食诱发T2DM大鼠可致RER降低,偏向于依靠脂肪氧化提供能量,与本研究结果一致。
啮齿动物有昼伏夜出的生物规律,本研究发现,中国仓鼠昼夜间活动量差异显著,且夜晚运动路程长。与对照组相比,糖尿病组白天活动量明显增加,夜晚活动量略有减少,说明仓鼠的高血糖状态会对生物的活动规律产生一定的影响。此外,糖尿病组摄食量增加,热量消耗增大,但体脂率较低。Shi等[22]研究发现,黑线仓鼠在低温环境脂肪含量下降,但摄食量增加,说明动物能量摄取并不总是与肥胖的发展呈正相关。可能是糖尿病动物试图通过增加运动和热量消耗来平衡过多的能量摄入和过高的血糖对机体带来的不利影响,具体机制有待进一步研究。
为进一步探索中国地鼠T2DM表型的分子代谢特征,我们测定了肝和骨骼肌中PPARG和GLUT4的mRNA和蛋白表达情况。PPARG是脂肪细胞分化、脂质和碳水化合物代谢的关键调控因子,可增加靶组织对胰岛素的敏感性[23]。糖尿病鼠中,PPARG在肝和骨骼肌中的表达显著增加。Anandharajan等[24]研究发现,PPARG可增强胰岛素的敏感性,促进GLUT4的表达,增强对葡萄糖的摄取。糖尿病鼠中,GLUT4 在骨骼肌中表达显著降低,但在肝中蛋白表达无明显差异。正常条件下,GLUT4储存于细胞内的特化小泡中[25]。当餐后血糖升高时,胰岛素信号转导激活,GLUT4转移至质膜,完成葡萄糖转运,降低血糖浓度[11, 25]。这些结果表明机体为适应高血糖、胰岛素抵抗等环境,不同组织中存在自我调控,骨骼肌中可能由于GLUT4的表达降低导致机体产生胰岛素抵抗,肝中高水平的PPARG有助于提高胰岛素的敏感性,适度减缓胰岛素抵抗。
综上所述,山医群体近交系中国仓鼠FBG、PBG中轻度增高,糖脂代谢异常,存在胰岛素抵抗,体脂率降低,属于非肥胖型自发性糖尿病模型。其糖代谢异常及胰岛素抵抗的产生可能与骨骼肌GLUT4表达降低有关,而肝中PPARG表达的增加,可以适度缓解机体的胰岛素抵抗,有助于维持正常生活,但具体的作用机制仍需进一步探索。
