人源蛋白酶体底物降解动力学的高分辨三维冷冻电子成像
2019-09-03刘鸣华
刘鸣华
国家纳米科学中心,北京 100190
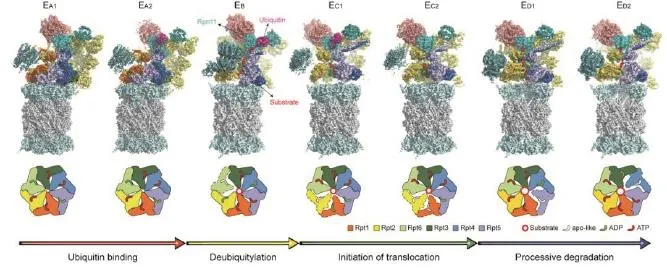
利用冷冻电镜解析的七个底物结合的人源26S蛋白酶体精细原子结构,揭示了从泛素识别、去泛素化反应、转运启动和持续降解的核心功能动态过程。
泛素-蛋白酶体体系(Ubiquitin-Proteasome System,简称UPS)是细胞内最重要的蛋白质降解通路,对维持生物体内蛋白质的浓度平衡,以及对调控蛋白、错误折叠或受到损伤的蛋白的快速降解起着至关重要的作用,参与了细胞周期、基因表达调控等多种细胞进程,由UPS失常引发的蛋白质新陈代谢异常与众多人类重大疾病直接相关1-5。人源蛋白酶体全酶包含至少33种不同的亚基,总分子量约为2.5 MDa。尽管很多工作揭示了蛋白酶体的基本架构和运动行为6-8,但蛋白酶体与底物之间的相互作用从未得到直接的观测,因此蛋白酶体如何作用于底物的复杂动力学过程仍然是理解蛋白酶体生化功能的核心问题。
近日,北京大学物理学院人工微结构和介观物理国家重点实验室、前沿交叉学院定量生物学中心毛有东课题组通过冷冻电子显微镜技术,解析了人源蛋白酶体26S在降解底物过程中的七种化学反应中间态构象的高分辨(2.8-3.6 Å) (1 Å =0.1 nm)精细原子结构。该课题组利用ATPγS降低AAA-ATPase酶水解活性的特点,在底物降解的中间过程,通过将ATP快速置换成ATPγS,捕捉到蛋白酶体在底物降解过程的反应中间态。同时,他们将机器学习的方法应用到了冷冻电镜图像聚类中,并针对蛋白酶体的动力学特征,整合了多种算法,设计了一套有效的多构象分类流程。通过这两套技术方案的整合,课题组成功解析了人源蛋白酶体在降解底物过程中的蛋白酶体-底物复合体的七种天然中间态构象,在全原子水平展示了蛋白酶体从泛素结合到去泛素化,再到底物转运的动态过程。
该研究工作近期在Nature上以长文形式在线发表9。该工作系统呈现了在原子水平蛋白酶体如何与被降解蛋白底物分子相互作用的动态过程,首次实现了对AAA-ATPase六聚马达分子内ATP水解全周步进循环的完整过程的三维原子水平观测,发现三种不同的ATP水解协同反应模式,并解释了AAA-ATPase将ATP水解化学能转化为机械能实现蛋白底物去折叠的基本物理化学过程,对于理解生物体内蛋白质降解动力学过程和一系列负责物质输运的ATPase分子马达的一般工作原理具有重要的价值。
