均匀设计法优化人参单芽诱导生根培养基
2019-09-02陈双越包悦琳金东淳
陈双越, 包悦琳, 陈 鸽, 李 昂, 金东淳
(延边大学农学院,吉林 延吉 1330021)
人参具有重要的医疗保健价值和巨大的经济效益,自古以来就被人们视为珍品[1-3]。但是人参的生长周期长、繁殖系数少、常异花授粉等生物学特性严重制约着品种选育进程,同时也是基础性研究远远落后于其它植物的主要原因[4]。利用组织培养方法,建立高效、稳定的人参再生植株体系是克服这些不利因素,加快新品种选育进程,提高基础研究水平的有效途径[5-7]。然而,人参的常规组织培养同样存在难度大、发根难、再生植株频率低等诸多问题[8-9]。鉴于人参繁殖及育种的难题,国内外研究人员试图通过生物技术及转基因技术摆脱人参生产及育种上的困境[10]。如通过建立人参的组织快速培养体系,大量繁殖人参苗来缓解生产上的需求,或在组培体系基础上利用转基因技术对现有的品种进行改良,亦或通过调控光、温、生长调节剂等来促使试管苗开花结实来缩短其育种周期等[11-14]。虽然已有很多关于人参组织培养方面的报道,但尚未见有稳定的体系在育种及生产上应用,因此有必要建立一套有效的人参组培体系,以期为人参育种的后续研究奠定理论基础[15-18]。
长期以来,国内外针对建立完整的人参组织培养体系做了大量研究[19]。虽然已经有一些关于人参组培体系建立的报告,其中提到的各种激素浓度为人参组培的进一步研究提供了参考[20-22]。但目前发现的报告中,大多是采用单因素研究方法,这种方法有可能会漏掉一些较优的组合。而使用均匀设计恰好能规避这个弊端,既能够保证试验的均匀性和准确性,又能大大减少试验次数,且目前尚未有采用均匀设计优化人参组织培养中各激素配比的相关报道[23]。
本试验以MS为基本培养基,大田生长的人参叶片为试材,采用均匀设计方法设计不同氮浓度、不同种类的激素组合,探讨并筛选了人参叶片愈伤组织诱导的最佳培养基,以期建立高效、稳定的人参再生植株体系,为后续育种试验奠定理论基础。
1 材料与方法
1.1 材料
采集试验田的人参叶片,将采集的人参叶片放在水流中清洗,以除去表面污垢。再将人参叶片放入灭菌后的烧杯中,在无菌条件下用75%乙醇浸泡30 s,将其取出用无菌水冲洗2次,每次5 min。然后将叶片浸入0.1%升汞溶液中,浸泡6 min,并不断晃动烧杯,之后用无菌水洗涤3次,每次5 min,最后用无菌水浸泡以备用。
1.2 方法
1.2.1 人参叶片愈伤组织的诱导
在无菌条件下将备好的人参叶片用刀切成小块,用镊子将愈伤组织接种在2,4-D 2 mg/L+KT 1 mg/L+NAA 0.66 mg/L+1%琼脂,pH值为5.8的MS培养基中,并设置培养温度为25 ℃。
1.2.2 人参不定芽的诱导
将带有愈伤组织的人参叶片接种在IBA 3 mg/L+6-BA 3 mg/L+NAA 3 mg/L+1%琼脂,pH值为5.8的MS培养基中,然后置于光照时长为16 h/d,温度为25 ℃的培养室中培养。
1.2.3 诱导生根
将带有不定芽的愈伤组织切成单芽并以MS为基本培养基,附加琼脂8 g/L,pH值为5.8。将NO3-、NH4+与NAA、KT、IBA、6-BA、IAA、GA36种生长调节剂,参照均匀设计U15(158),设计8个因素,每种因素为15水平(表1),每处理10瓶,每瓶1枚外植体。30 d后统计人参单芽生根数,生根后的根粗、根长、茎粗、茎长。通过分析得到最佳激素组合后,在添加有最佳激素组合的培养基中接种人参带有愈伤组织的单芽进行验证。
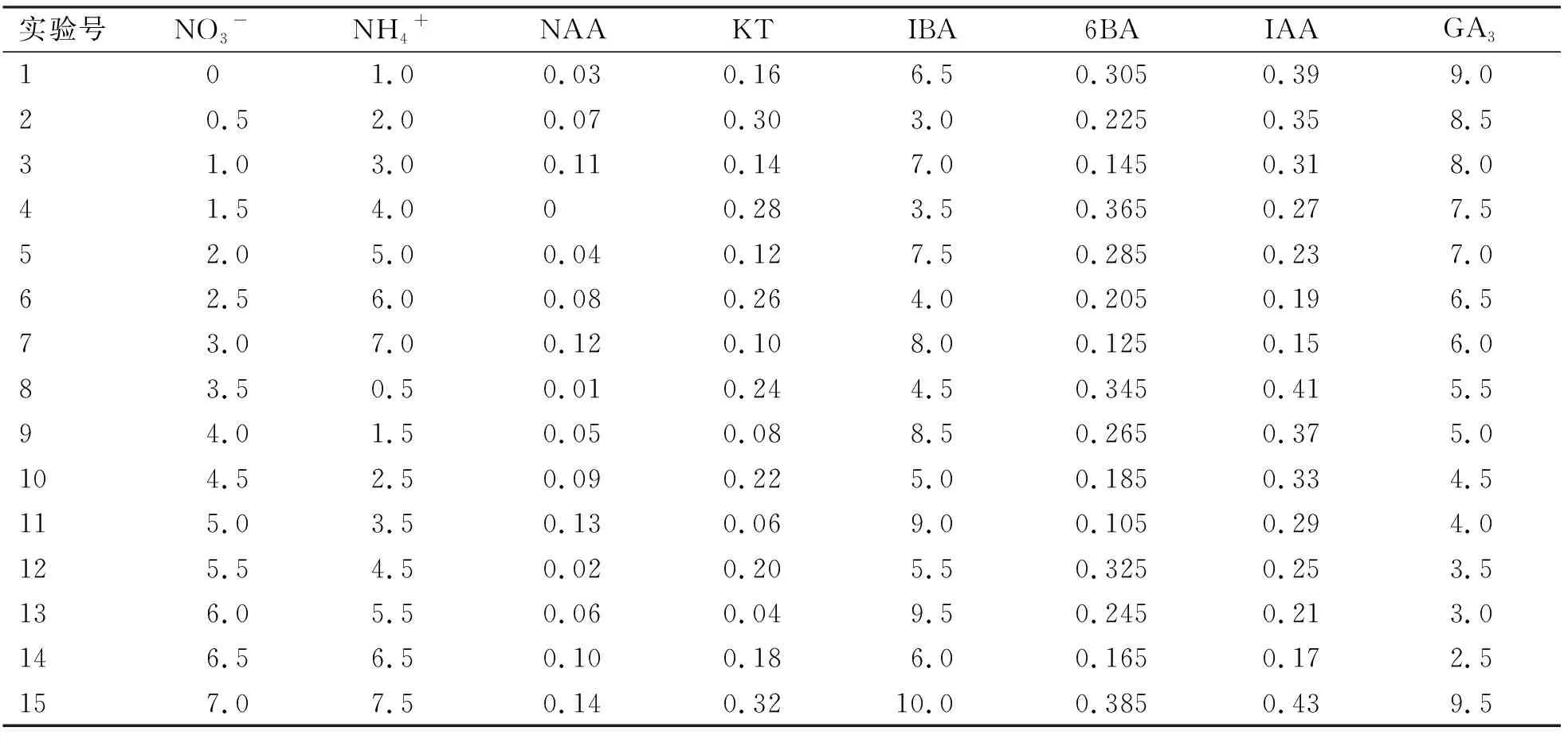
表1 人参单芽U15(158)试验设计
1.2.4 移栽
打开已经生根的试管瓶进行炼苗,炼苗的必备条件是温度25 ℃,5 000~10 000 lx的光照强度,时间为4~6 d。当有小的菌落刚刚出现在培养基的表面时,及时地将试管苗从试管瓶中移出。
2 结果与分析
2.1 不同处理对单芽生根率的影响
接种后,每7 d观察1次单芽生根情况,28 d时统计单芽生根的诱导情况。通过观察培养14 d后开始有根出现。28 d后统计各处理单芽生根率(图1)。由表2可知,7号处理的单芽生根率最高,为90%,其次为11号50%,5号40%,3号、6号、8号、9号都为30%,10号、12号、14号都为20%,4号、13号都为10%,而1号、2号、15号处理的单芽没有生根。
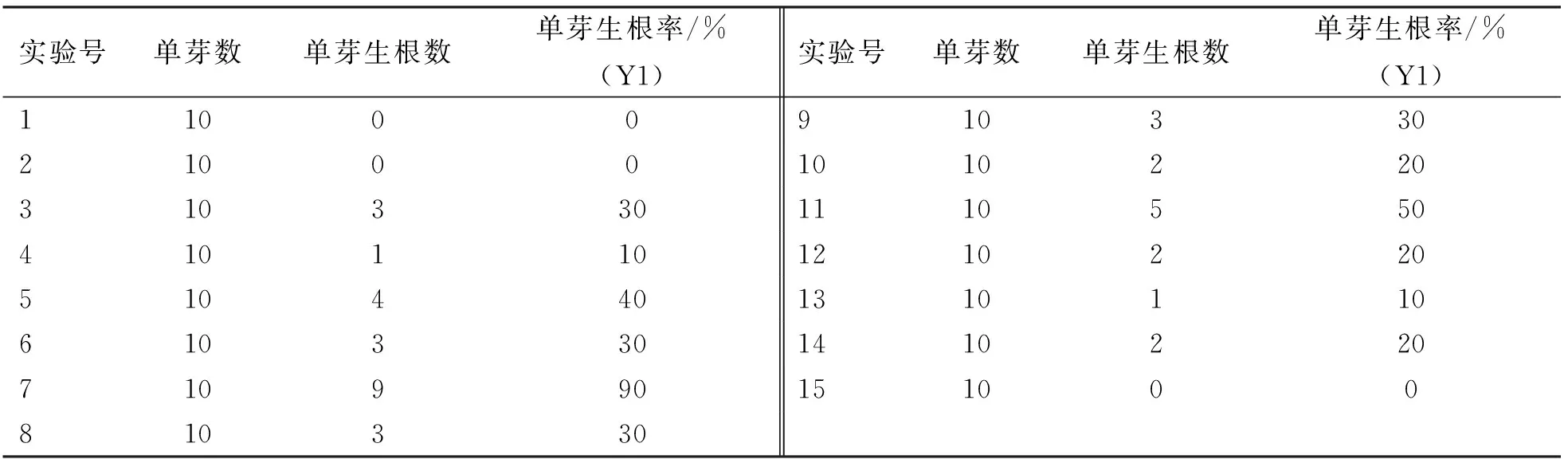
表2 单芽生根率
2.2 不同处理对单芽地上部的影响
28 d后统计各处理单芽地上部情况(表3)。由表3可知,8号处理茎粗增长值最大,为0.04 cm,其次为3号、5号6号、7号、12号,都为0.03 cm,1号、10号、15号都为0.02 cm,2号、4号、9号、11号、13号、14号都为0.01 cm。7号处理茎长增长值最大,为0.17 cm,其次为8号0.13 cm,3号、6号、12号都为0.11 cm,4号、11号都为0.06 cm,13号0.05 cm,1号0.04 cm,15号0.03 cm,5号、10号、14号都为0.02 cm,2号、9号都为0.01 cm。
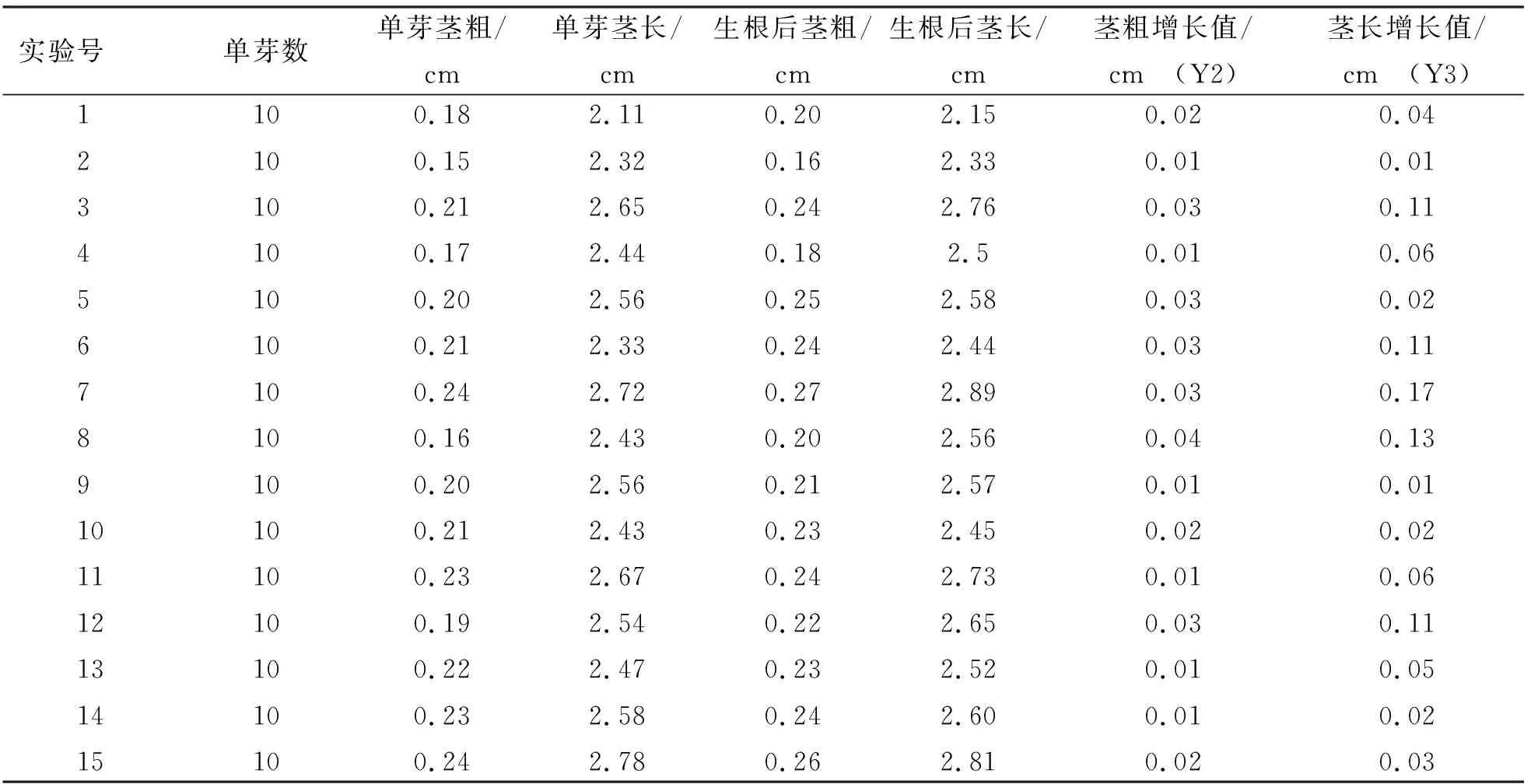
表3 单芽地上部试验结果
2.3 不同处理对单芽地下部的影响
28 d后统计各处理单芽地下部情况(表4)。
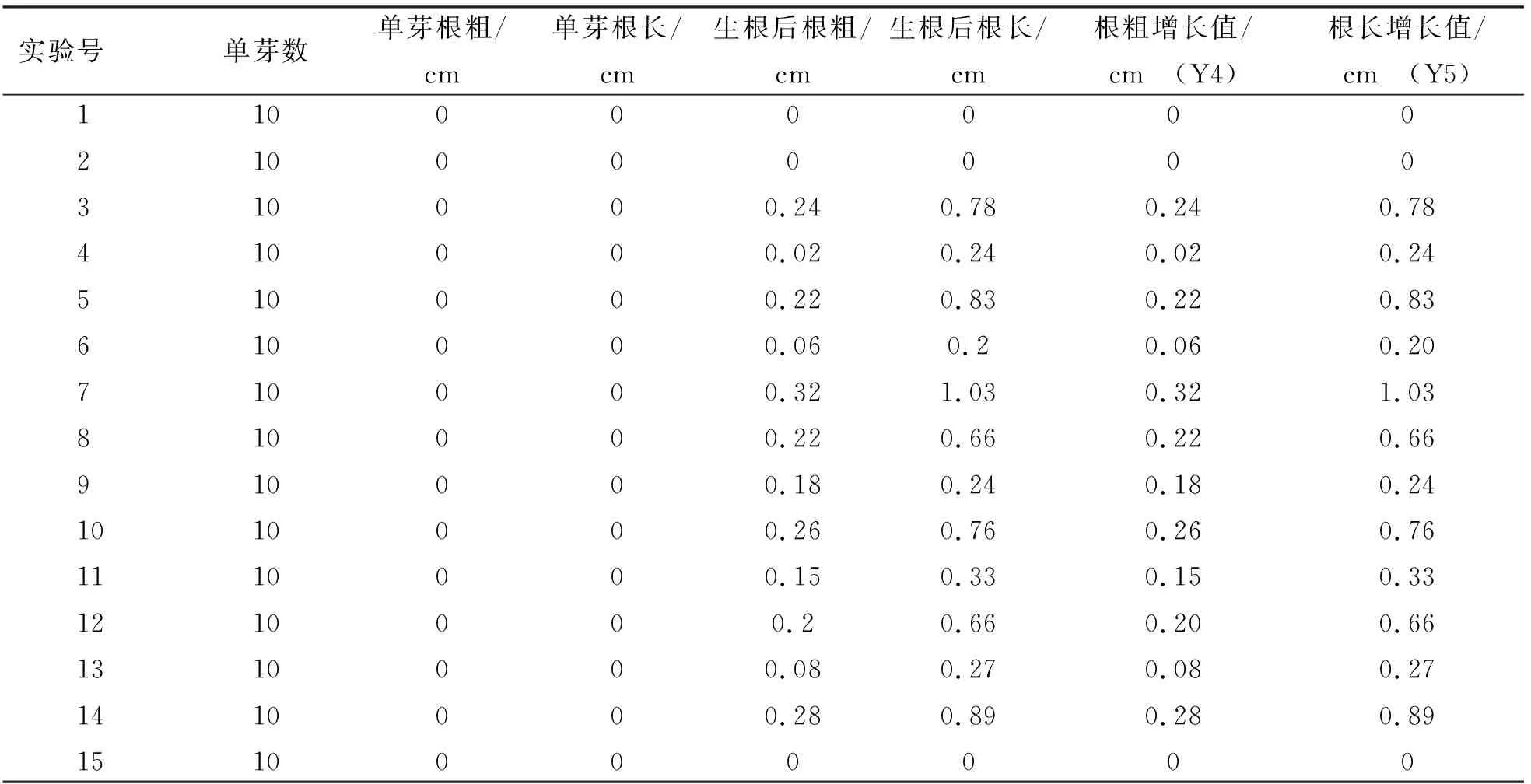
表4 单芽地下部试验结果
由表4可知,7号处理根粗增长值最大,为0.32 cm,其次为14号0.28 cm,10号0.26 cm,3号0.24 cm,5号、8号都为0.22 cm,12号0.20 cm,9号0.18 cm,11号0.15 cm,13号0.08 cm,6号0.06 cm,4号0.02 cm,1号、2号、15号都为0。7号处理根长增长值最大为1.03 cm,其次为14号0.89 cm,5号0.83 cm,3号0.78 cm,10号0.76 cm,8号、12号都为0.66 cm,11号0.33 cm,13号0.27 cm,4号、9号都为0.24 cm,6号0.20 cm,1号、2号、15号都为0。
2.4 偏最小二乘回归建模分析结果
使用DPS中的偏最小二乘回归分析程序对试验数据进行分析,参考PRESS统计量以及误差统计量的下降趋势,选择5个潜变量个数,建立二次多项式回归模型,得到各因子与5个指标间的主效应标准回归系数。其中,NH4+(X2),NAA(X3),IBA(X5),6BA(X6)和GA3(X8)对单芽生根率(Y1),生根后茎粗的增长值(Y2),生根后茎长的增长值(Y3),生根后根粗增长值(Y4)和生根后根长增长值(Y5)的影响为正效应,NO3-(X1),KT(X4)及IAA(X5)对单芽生根率(Y1),生根后茎粗的增长值(Y2),生根后茎长的增长值(Y3),生根后根粗增长值(Y4)和生根后根长增长值(Y5)的影响为负效应。
由表5可知,提取不同潜变量个数增加时,标准化后的数据模型误差平方和及PRESS统计量呈下降趋势,且潜变量个数为5时,Y1、Y2、Y3、Y4、Y5的误差平方和分别为0.048 7,0.047 6,0.046 7,0.048 0,0.047 0,小于0.05,表明分析具有显著性,相应的决定系数分别为0.928 5,0.831 4,0.858 9,0.894 9,0.880 7,说明潜变量对因变量的解释能力很强,回归模型的拟合效果较好(决定系数R2接近1,说明潜变量对因变量的解释能力越强,回归模型拟合效果越好)。
在DPS软件中设定需要的优化条件为Y1、Y2、Y3、Y4、Y5取最大值,对以上5个模型进行优化,得到各因素的最优值:当X1(NO3-)为3 mg/L,X2(NH4+)为7 mg/L,X3(NAA)为0.1 mg/L,X4(KT)为0.1 mg/L,X5(IBA)为8 mg/L,X6(6-BA)为0.125 mg/L,X7(IAA)为0.15 mg/L,X8(GA3)为6 mg/L时,有最优目标函数值,其中,Y1=96%,Y2=0.13 cm,Y3=0.07 cm,Y4=0.32 cm,Y5=1.02 cm。

表5 数据标准化后的模型误差平方和及决定系数
2.5 验证试验结果
在添加最佳激素组合的培养基中接种人参单芽,30 d后生根诱导率达95%,生根后茎粗的增长值为0.09 cm,生根后茎长的增长值为0.07 cm,生根后根粗增长值为0.32 cm,生根后根长增长值为1.03 cm。,与模型预测值十分接近,表明由模型预测出的最佳激素组合符合实际操作中人参根诱导的要求,结果比较满意。
3 讨论与结论
均匀设计是方开泰等为了解决多因素、多水平高科技难题而提出的一种试验设计。基于试验点在整个试验范围内是均匀散布的,从均匀性角度出发,大大减少了试验次数,并且分析准确性好;能从全面试验点中挑选出部分代表性的试验点,这些试验点在试验范围内充分均衡分散,但仍能反映体系的主要特征。它与其它试验设计法的最大不同之处就在于能从尽可能少的试验次数中揭示出因素对指标的影响大小和规律,能够以最少的次数,从多个因素中找出影响试验结果的各因素的主次和最优结果,并且可以进行优化拟合设计[23]。而本研究是通过均匀设计法优化了人参单芽诱导生根的培养基。
由于人参的生长周期长、繁殖系数少、常异花授粉等生物学特性严重制约品种选育进程。因而虽然栽培人参的系统选育工作己经开展了几十年,育种工作者也积极进行了新品种的选育工作,但育成品种却很少,而组织培养作为一种快速创造新种质的方法,能在较短时间内对品质优良的单株进行扩增,因此利用组织培养方法是克服这些不利因素,加快人参新品种选育进程,提高基础研究水平的有效途径。然而,至今为止,人参组织培养仍然存在难度大、发根难、再生植株频率低等诸多问题。
本研究通过均匀设计筛选出了诱导人参根的最佳培养基为NO3-3 mg/L+NH4+7 mg/L+NAA 0.1 mg/L+KT 0.1 mg/L+IBA 8mg/L+6-BA 0.125 mg/L+IAA 0.15 mg/L+GA36 mg/L+8%琼脂+3%蔗糖,其根的诱导率达95%。本实验室在前期研究中已筛选出诱导人参愈伤组织的最佳培养基为MS+2,4-D 2 mg/L+KT 1 mg/L+NAA 0.66 mg/L+1%琼脂,诱导率为93%和诱导人参不定芽的最佳培养基为MS+IBA 3 mg/L+6-BA 3 mg/L+NAA 3 mg/L+1%琼脂,诱导率为86%。因此,本实验室已基本建立了较完整的人参组培体系,对加快人参新品种选育进程,提高人参基础研究水平等诸方面具有重要意义。
