大豆多肽营养干预对预防和治疗尾吊模拟失重大鼠肌肉萎缩的作用
2019-08-28赵博雅刘新旗应知伟韩炳星张义智
赵博雅,赵 芬,*,刘新旗,*,张 健,应知伟,韩炳星,曹 元,张义智
(1.北京工商大学食品学院,北京食品营养与人类健康高精尖创新中心, 北京市食品添加剂工程技术研究中心,北京 100048; 2.中国航天员科研训练中心,北京 100193; 3.中国农业大学,北京 100193;4.金诃藏药(山东)健康产业有限公司,山东济南 250102)
废用性肌肉萎缩是骨骼肌长期不受负荷引起形态、结构、功能发生改变的一种机体变化,可由禁食[1]、卧床[2]、肢体制动[3]、失神经[4]、失重[4]等原因导致,同时也是心血管病[2]、糖尿病[5]等多种疾病的常见并发症。根据2016全球疾病负担报告所述,肌肉相关疾病是影响健康寿命损失年(YLD)的重要因素之一,近十年全球患肌肉相关疾病的人数比九十年代翻了一倍,且年龄标准化率增加60.7%[6]。这一疾病不仅影响患者生活质量,严重时可带来生命危险,也为国家财政带来沉重负担。因此寻找合适有效的治疗肌肉萎缩的方法或进行早期预防,对临床医学、运动医学和航天医学等领域[7]具有重要的科学意义及社会意义。
废用性肌肉萎缩主要表现为肌肉质量和强度的降低、肌纤维变细或消失[8]。大量研究表明,肌肉质量的多少是由蛋白质合成与蛋白质分解动态平衡决定的[9-10]。当分解速率超过合成速率、蛋白质净生成量减少时,发生肌肉萎缩。蛋白质代谢信号通路的核心物质是Akt(蛋白激酶B,PKB)[11]。控制蛋白质合成的重要途径是由IGF-1介导的IGF-1/PI3K/Akt/mTOR,可激活下游信号4EBP1和S6K1转导,调节蛋白质的翻译作用[12-13],促进蛋白质合成[14]。控制蛋白质分解的两条重要途径有泛素蛋白酶体途径和自噬溶酶体途径,其中肌肉萎缩相关基因和萎缩基因均由Akt的下游FoxO3控制[15-16]。当它具有活性时,可从细胞质自由进入核中,与MAFbx/Atrogin-1和MuRF1基因的多个启动子相互作用[17],增加这两种泛素连接酶E3的表达,促进由二者催化的泛素蛋白酶体途径的进行[18],或通过影响溶酶体自噬途径[19],加速蛋白质分解。此外,肌肉萎缩的发生也会伴随氧化应激的出现。此时,机体内抗氧化物酶如SOD、GSH-Px浓度降低,ROS大量增多至超过机体处理能力,直接或间接导致蛋白质损伤,使细胞、组织或器官受损[20]。
目前,除运动及功能训练外,治疗肌肉萎缩的方法主要有药物干预和营养干预。药物包括激素类(如生长激素[21]、胰岛素样生长因子[22])、中药类(川芎[23]、丹参、黄芪[24])、抗氧化剂类(维生素E[25])等。但由于可能具有的潜在副作用,还需大量毒理实验证实,因此营养干预方法受到越来越多的人们广泛的关注。这些营养干预方法普遍从增加蛋白质合成、减少蛋白质分解或改善氧化应激等[26]方面缓解肌肉萎缩症状。Beasley、夏志等[27-28]研究表明,摄入富含亮氨酸等支链氨基酸的优质蛋白如乳清蛋白,可改善骨骼肌丢失的状况并可减轻体内引发的炎症反应。Bueno等[29]发现,给予病人包含益生元的营养组合物,可增加HMB内源性产生,进而增加mTOR浓度从而促进蛋白质合成。Murata等[30]发现摄入花翠素可通过抑制MuRF-1表达起到预防肌肉萎缩的作用。Valcarce等[31]研究发现,给予小分子PPAR-δ可通过增加肌纤维的线粒体密度增强有氧能力[32],治疗肌肉萎缩。
大豆多肽是大豆蛋白酶解成的小分子产物,必需氨基酸齐全且平衡,同时较大豆蛋白更易消化吸收,因而具有广阔的应用前景[33]。目前关于大豆多肽对机体的功能性研究主要集中在抗氧化[34]、治疗烧伤[35]、降血脂[36]、降血压[37]、调节血糖[38]等方面,对蛋白质合成和分解的作用鲜有报道。因此,本文通过建立大鼠尾吊模型模拟失重,对大豆多肽对蛋白质代谢和氧化应激的影响进行深入探讨,以期为营养干预预防和治疗肌肉萎缩的方法提供一定参考。
1 材料与方法
1.1 材料与仪器
SPF级8周龄Wistar雄性大鼠(动物许可证号:SCXK(京)2016-0006,体质量260~280 g) 北京维通利华实验动物技术有限公司;大鼠维持饲料 斯贝福(北京)生物技术有限公司;大豆多肽(蛋白含量90%) 诺利如一(安阳)生物科技有限公司;IGF-1 ELISA检测试剂盒、FoxO3 ELISA检测试剂盒、SOD ELISA检测试剂盒 北京方程生物科技有限公司;普通RIPA裂解液(组织/细胞) 北京索莱宝科技有限公司;BCA蛋白定量分析试剂盒、ECL免疫印迹底物 赛默飞世尔科技(中国)有限公司;兔抗MAFbx/Fbx32/Atrogin-1单克隆抗体、兔抗GAPDH单克隆抗体、HRP标记的山羊抗兔IgG 艾博抗(上海)贸易有限公司。
玻璃匀浆器 北京半夏科技发展有限公司;Allegra X-30R离心机 美国贝克曼库尔特有限公司;Infinite M200 Pro多功能酶标仪 帝肯(上海)贸易有限公司;PowerPac通用电泳仪、Trans-Blot Turbo全能型蛋白转印系统、ChemiDoc MP全能型凝胶成像分析系统 伯乐生命医学产品(上海)有限公司。
1.2 实验方法
1.2.1 动物分组及灌胃设计 将35只大鼠分笼饲养,每天昼夜循环光照12 h,环境温度20~25 ℃,相对湿度50%~60%。自由进食进水,每天更换饲料和饮水。适应性喂养1周后,随机选取15只用于验证大豆多肽预防作用实验,设为地面-对照组1(C1)、尾吊-对照组(M)、尾吊-肽组(T),每组5只,灌胃40 d;剩余20只用于验证大豆多肽治疗作用实验,其中随机选取5只作为地面-对照组(C2),15只进行尾吊。饲养40 d后,将15只尾吊大鼠放回地面,分为尾吊后-高剂量肽治疗组(HT)、尾吊后-中剂量肽治疗组(MT)、尾吊后-低剂量肽治疗组(LT),每组5只,与C2共同灌胃60 d。参照Morey-Holton E等[39]的方法进行尾部悬吊,使大鼠后肢离地30 °、前肢可自由活动,随大鼠生长及时调节尾吊高度。按照人体每天额外补充5 g大豆多肽进行换算得到大鼠每天补充量并以此作为治疗中剂量,即0.45 g/(kg·BW·d),治疗高剂量和低剂量分别设为0.75 g/(kg·BW·d)和0.15 g/(kg·BW·d)。预防剂量设为0.30 g/(kg·BW·d)。所有大鼠均按照0.50 mL/(kg·BW·d)进行灌胃,对照组灌胃蒸馏水。
1.2.2 血清和肌肉样品采集 预防实验中,于5、10、17、25、32、40 d称量大鼠体质量并记录。治疗实验中,每周第4 d和第7 d称量大鼠体质量并记录,并于7、21、35 d进行尾静脉取血。预防实验灌胃40 d时,对C1、M、T组进行解剖。治疗实验灌胃60 d时,对C2、HT、MT、LT组大鼠进行解剖。解剖前禁食不禁水12 h。解剖时,麻醉后采用腹主动脉法取血。将血液室温静置1~2 h,于4 ℃放置一夜。次日4 ℃、3000 r·min-1离心10 min,取上层血清,-80 ℃保存备用。取大鼠左侧后肢腓肠肌和比目鱼肌,分别称量腓肠肌和比目鱼肌湿重并计算腓肠肌和比目鱼肌湿重/体质量比:腓肠肌或比目鱼肌湿重/体质量比(mg/g)=腓肠肌或比目鱼肌湿重/大鼠体质量,于-80 ℃冻藏备用。
1.2.3 血清相关指标测定 采用双抗体夹心法酶联免疫吸附试验检测大鼠血清中IGF-1、FoxO3、SOD浓度。向包被对应待测物捕获抗体的微孔中依次加入标准品/样品、HRP标记的检测抗体,37 ℃温育1 h,洗涤未结合的抗原抗体。加入底物TMB于37 ℃避光孵育30 min进行显色,用酶标仪在450 nm波长下测定吸光度(OD值),计算样品中对应待测物浓度。
1.2.4 总蛋白提取及蛋白定量 取0.1 g肌肉组织剪碎,加入1 mL RIPA裂解液(PMSF浓度为1 mmol/L),在冰水浴条件下用玻璃匀浆器研磨10 min,冰上裂解30 min。于4 ℃、12000 r·min-1离心10 min,收集上清即提取的总蛋白,制得肌肉匀浆样品,于-80 ℃保存备用。采用BCA法对各个样品进行蛋白定量,BSA蛋白标准曲线为:y=0.6892x+0.0100,决定系数R2=0.9991。最终将样品统一稀释成同一蛋白浓度。
1.2.5 Western Blot分析 将样品于100 ℃煮沸5 min使蛋白充分变性,采用12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,浓缩胶浓度为5%。初始电压为80 V,20 min后将电压调至120 V,约1 h停止。将胶上蛋白转移至PVDF膜,5% BSA中(溶于TBST)于37 ℃封闭2 h,在1∶1000稀释的一抗中于4 ℃孵育过夜,TBST洗膜3次,每次5 min。加入HRP标记的二抗于37 ℃孵育2 h,TBST洗膜3次,每次5 min。加入ECL化学发光底物对条带进行染色,避光结合2 min,在凝胶成像仪中对目的蛋白Atrogin-1和内参蛋白GAPDH进行显影,利用Image Lab软件对图像进行分析。实验重复3次。
1.3 数据处理
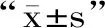
2 结果与分析
2.1 大豆多肽营养干预对大鼠肌肉萎缩的预防作用
2.1.1 大豆多肽对大鼠体质量、肌肉湿重及肌肉湿重/体质量比的影响 由图1A可知,各组大鼠初始体质量无显著性差异。随饲养时间延长,与C1组相比,M和T组体质量增长趋势明显减缓,10 d后,M和T组体质量显著低于C1(p<0.05)。尾吊时,由于后肢活动减少导致能量消耗减少、摄食减少,机体无法正常合成蛋白,不能满足身体生长需要,因此与C1组相比,M组大鼠肌肉质量减少、体质量减轻。5~10 d时,M和T组体质量稳步增加;10~25 d时,M组体质量增长平缓,T组仍保持一定速度持续增长,且在17~25 d期间,T组体质量增长速率提升较快、体质量超过M组,但无显著性差异。将三组大鼠在预防实验始末的平均体质量变化量进行对比发现(图1B),M组体质量增长量显著低于C1组(p<0.05),T组体质量增长量较M组有一定提升,但未达到统计学水平上的显著性差异。大豆多肽营养干预为机体提供了外源蛋白质,作为合成身体生长所需蛋白质的原料,因而可在一定程度上改善大鼠体质量增长缓慢问题。
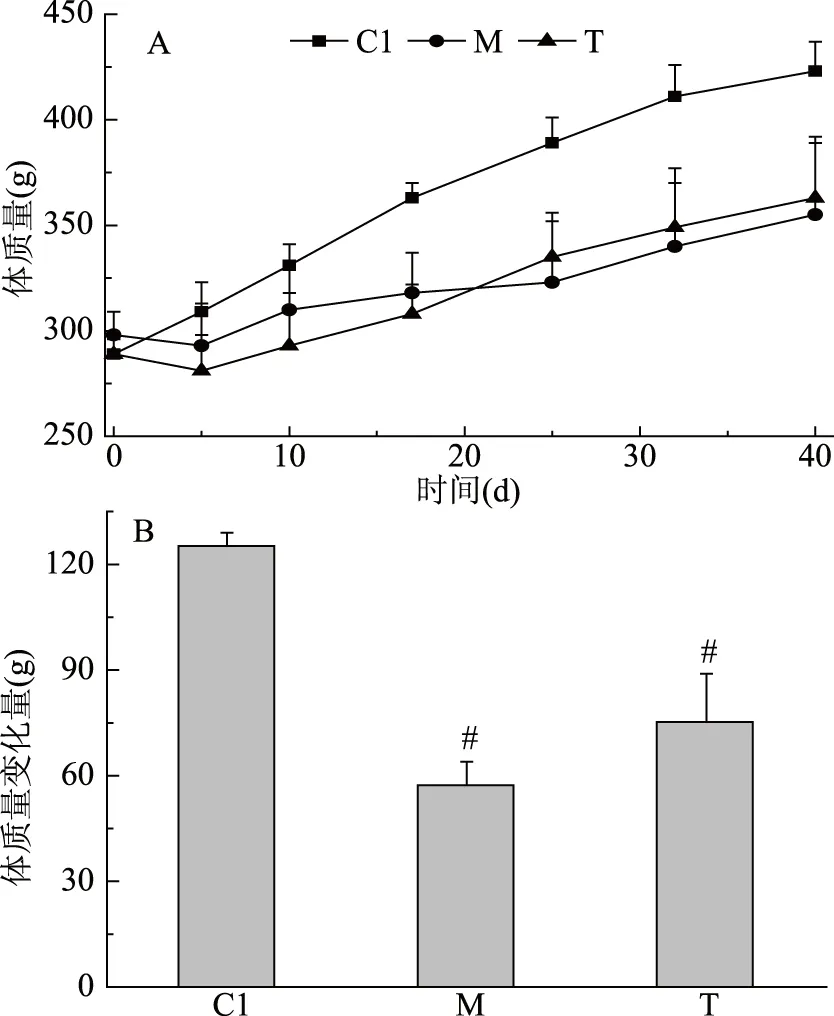
图1 预防实验大豆多肽营养干预对大鼠体质量(A)和体质量变化量(B)的影响
肌肉湿重是衡量肌肉萎缩程度最常用的指标之一[40]。由图2A可知,M组腓肠肌湿重和比目鱼肌湿重均显著低于C1(p<0.05),表明大鼠发生肌肉萎缩,尾吊模型建立成功。由图2B可知,M组腓肠肌湿重/体质量比显著低于C1组(p<0.05),但比目鱼肌湿重/体质量比与C1无显著性差异,这可能是由于比目鱼肌质量小造成的。同时说明,因尾吊导致的体质量减少量中,腓肠肌湿重减少占大部分。
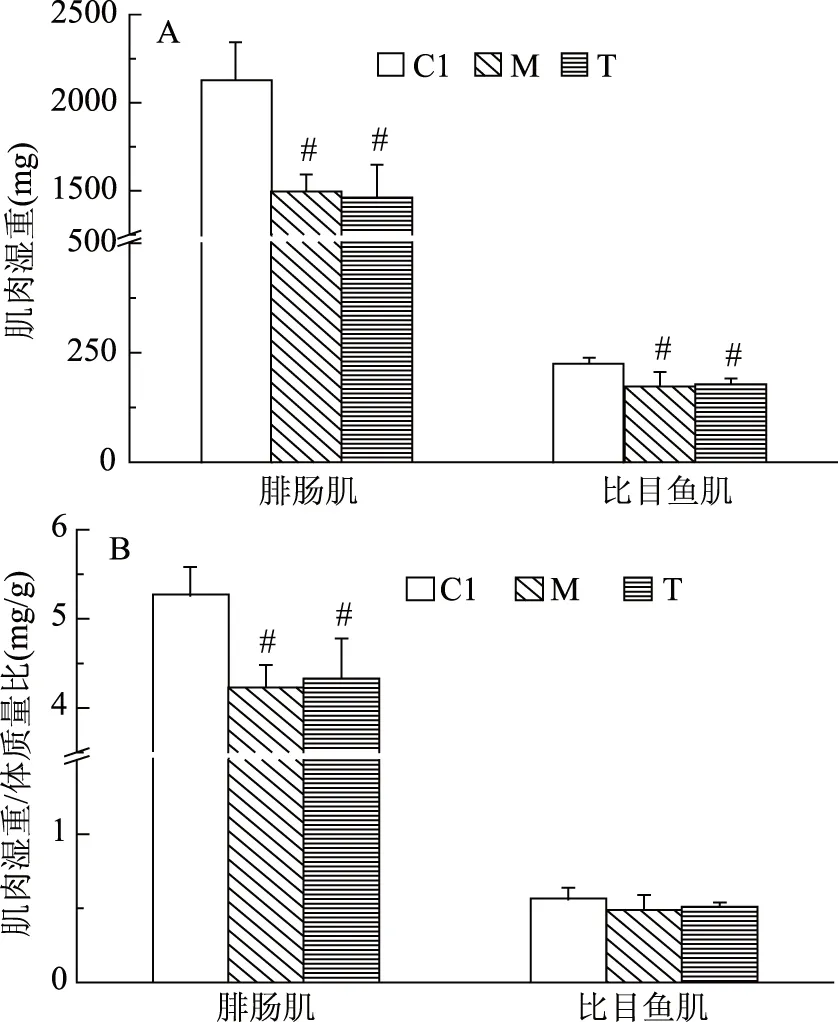
图2 预防实验大豆多肽营养干预对大鼠肌肉湿重(A)及肌肉湿重/体质量比(B)的影响
2.1.2 大豆多肽对蛋白质合成代谢和分解代谢相关因子及蛋白表达水平的影响 当蛋白质合成代谢通路中IGF-1浓度升高时,依次激活PI3K、Akt、mTOR使其磷酸化[12-13],蛋白质合成速率增加;同时,Akt下游FoxO3发生去磷酸化、活性被抑制[15-16],分解速率降低。反之,当IGF-1浓度降低时,PI3K和Akt的磷酸化水平降低,FoxO3磷酸化水平升高,蛋白质合成速率降低、分解速率提升。
由图3可知,与C1相比,M组大鼠血清中IGF-1浓度显著降低(p<0.05),血清中FoxO3浓度显著升高(p<0.05),腓肠肌和比目鱼肌中Atrogin-1蛋白相对表达量显著升高(p<0.05)。与M相比,T组大鼠血清中IGF-1浓度显著升高(p<0.05),血清中FoxO3浓度显著降低(p<0.05),比目鱼肌中Atrogin-1蛋白相对表达量显著降低(p<0.05)。这一结果表明,尾吊使蛋白质合成速率降低、分解速率增加,导致大鼠腓肠肌和比目鱼肌质量减少,发生肌肉萎缩。大豆多肽营养干预可减轻这一现象的发生程度,增加机体中蛋白质合成、抑制比目鱼肌中蛋白质加速分解,减轻尾吊对蛋白质代谢造成的影响,但对腓肠肌无明显作用。
图3 预防实验大豆多肽营养干预对大鼠血清中IGF-1(A)和FoxO3(B)浓度及肌肉中Atrogin-1蛋白相对表达量(C)(D)的影响
2.1.3 大豆多肽对机体氧化应激水平的影响 SOD是一种含金属的酶,可清除体内代谢产生的过多的超氧阴离子自由基[41],使氧化产物维持在相对稳定的数量状态,延缓由于自由基累积侵害导致的机体衰老,间接影响蛋白质代谢。由图4可知,与C1相比,M组大鼠血清中SOD浓度显著降低(p<0.05)。与M相比,T组血清中SOD浓度有所提高,但未达到统计学水平上的显著性差异,与C1也无显著性差异。由此说明,尾吊造模使大鼠体内抗氧化物酶浓度降低,氧化产物积累较多至超过机体的抗氧化能力,导致氧化应激水平升高。大豆多肽营养干预可在一定程度上提高抗氧化物酶浓度,最终与机体内氧化产物达到平衡,减少体内氧化应激反应。
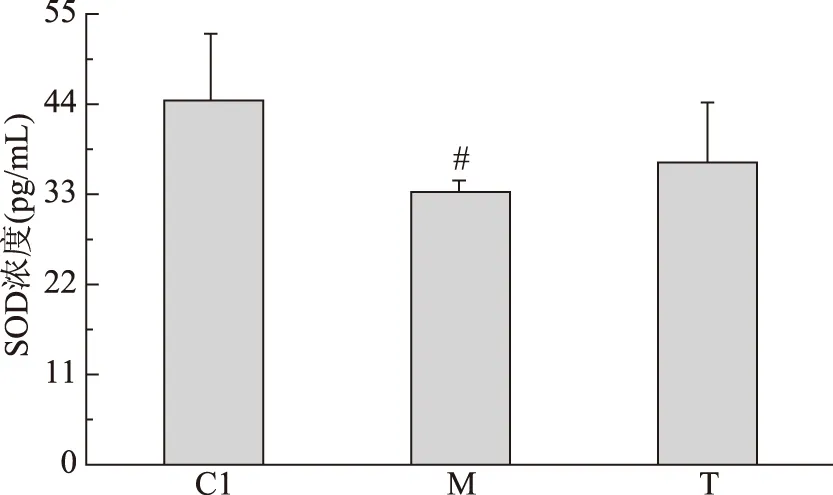
图4 预防实验大豆多肽营养干预对大鼠血清SOD浓度的影响
2.2 大豆多肽营养干预对大鼠肌肉萎缩的治疗作用
2.2.1 大豆多肽对大鼠体质量、肌肉湿重及肌肉湿重/体质量比的影响 由图5A可知,通过40 d尾吊造模,HT、MT、LT三组大鼠在治疗时的初始体质量显著低于C2(p<0.05);LT略高于HT和MT,这可能是由于个体差异造成的。在治疗期间,C2组大鼠体质量增长较为平缓,HT、MT、LT三组增长速度较快。治疗60 d结束时,四组大鼠体质量无显著性差异。通过对比图5B治疗始末四组大鼠的平均体质量变化量发现,HT、MT、LT的体质量增长量均显著高于C2(p<0.05)。结果表明,不同剂量的大豆多肽可提高大鼠体质量增长速率,使发生肌肉萎缩的大鼠逐步恢复正常生长。
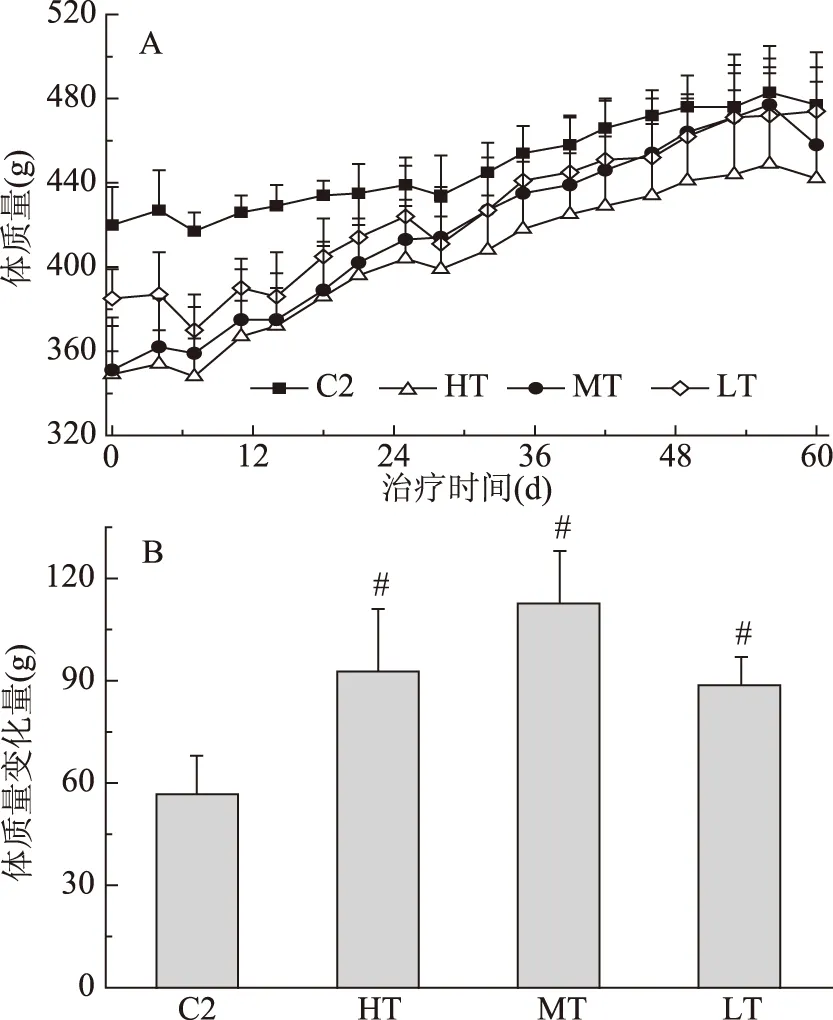
图5 治疗实验大豆多肽营养干预对大鼠体质量(A)及体质量变化量(B)的影响
由图6可知,治疗60 d结束时,HT、MT、LT三组大鼠腓肠肌和比目鱼肌湿重及湿重/体质量比与C2组均无显著性差异。这一结果表明,不同剂量大豆多肽营养干预可使发生肌肉萎缩大鼠损失的肌肉质量提升至恢复正常。
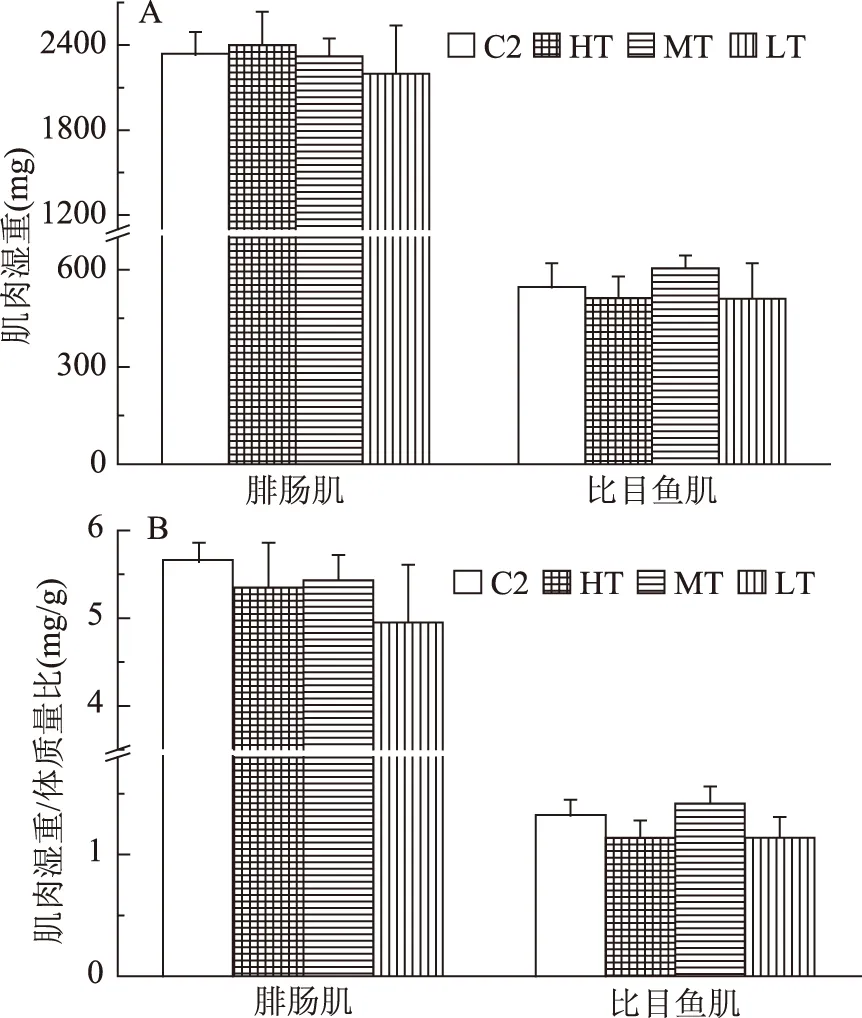
图6 治疗实验大豆多肽营养干预对大鼠肌肉湿重(A)及肌肉湿重/体质量比(B)的影响
2.2.2 大豆多肽对蛋白质合成代谢和分解代谢相关因子及蛋白表达水平的影响 由图7A和图7B可知,治疗7 d时,HT、MT、LT三组大鼠血清中IGF-1浓度与尾吊造模第40 d时的M相比几乎无变化且均显著低于C2(p<0.05);三组大鼠血清中FoxO3浓度与M相比有一定程度降低,但HT和LT仍显著高于C2(p<0.05)。随治疗时间延长,HT组大鼠血清中IGF-1浓度有一定程度提高,HT和LT组大鼠血清中FoxO3浓度显著降低(p<0.05)。治疗末期,HT、MT、LT三组大鼠血清中IGF-1和FoxO3浓度与C2均无显著性差异。结果表明,不同剂量的大豆多肽可提升肌肉萎缩大鼠机体内蛋白质合成代谢速率,减缓蛋白质分解代谢速率。营养干预一段时间后,发生肌肉萎缩的大鼠体内蛋白质合成和分解代谢可重新达到平衡。此外,推测大豆多肽营养干预对大鼠肌肉萎缩的治疗作用首先表现在抑制蛋白质分解,而后对促进蛋白质合成产生作用。
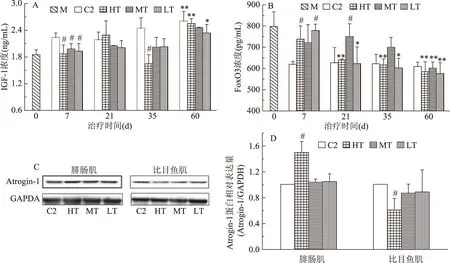
图7 治疗实验大豆多肽营养干预对大鼠血清中IGF-1(A)和FoxO3(B)浓度及肌肉中Atrogin-1蛋白相对表达量(C)(D)的影响
由图7C和图7D可知,治疗60 d后,MT和LT组大鼠腓肠肌中Atrogin-1蛋白相对表达量与C2组相比无显著性差异,HT组显著高于C2组(p<0.05)。同时,MT和LT组大鼠比目鱼肌中Atrogin-1蛋白相对表达量与C2组相比无显著性差异,HT组显著低于C2组(p<0.05)。结果表明,中低剂量的大豆多肽可抑制肌肉中蛋白质分解,同时由于蛋白质合成作用增强,导致蛋白质净生成量增多,因此中低剂量组腓肠肌和比目鱼肌湿重提高,肌肉质量恢复正常。高剂量大豆多肽对快肌和慢肌的作用并不相同,其可抑制比目鱼肌中蛋白质分解、增强腓肠肌中蛋白质分解。但结合图6得知,治疗60 d后,HT组腓肠肌湿重及湿重/体质量比与C2组无显著性差异,因此推测治疗期间高剂量大豆多肽对增强腓肠肌中蛋白质合成的作用更显著。
2.2.3 大豆多肽对机体氧化应激水平的影响 由图8可知,治疗初期,MT组大鼠血清中SOD浓度与M相比显著提高(p<0.05),但仍显著低于C2(p<0.05),HT和LT组与M相比无明显变化。治疗21 d时,MT和LT组大鼠血清中SOD浓度与M相比极显著提高(p<0.01)且与C2无显著性差异。治疗后期35~60 d期间,HT组大鼠血清中SOD浓度与M相比极显著提高(p<0.01)且与C2无显著性差异。这一结果表明,中低剂量大豆多肽在短期内能提高大鼠体内抗氧化物酶浓度,高剂量大豆多肽可逐步提高抗氧化物酶浓度,使机体氧化应激水平降低。
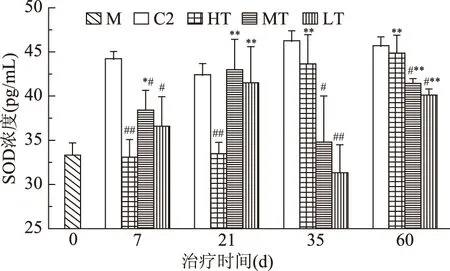
图8 治疗实验大豆多肽营养干预对大鼠血清SOD浓度的影响
3 结论
本研究表明,大豆多肽营养干预为机体提供了良好的外源蛋白质,可提高大鼠体质量增长速率,通过增强蛋白质合成、减弱蛋白质分解代谢提高腓肠肌和比目鱼肌湿重,同时降低体内氧化应激水平,在一定程度上能有效预防肌肉萎缩的发生或治疗修复肌肉损伤。因此,大豆多肽对废用性肌肉萎缩的预防和治疗作用具有重要的研究价值和广阔的应用前景。在后续研究中,大豆多肽预防和治疗肌肉萎缩的作用机制仍有待进一步实验探讨,如大豆多肽是否对细胞增殖有作用、是否在提升抗氧化酶浓度同时减少氧化物积累等,以期为大豆多肽营养干预预防和治疗肌肉萎缩的方法提供更详尽的科学依据。
