两种植物甾醇纳米粒的降胆固醇效果研究
2019-08-28焦文佳夏廉臣王雪晖祝爱侠王春维
焦文佳,程 铭,夏廉臣,王雪晖,陶 冶,祝爱侠,王春维,,3,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.武汉轻工大学动科科学与营养工程学院,湖北武汉 430023;3.国家粮食局粮油资源综合开发工程技术研究中心,湖北武汉 430023)
植物甾醇是一种重要天然甾醇资源,也是一种存在于植物中的天然活性物质[1]。它广泛分布于自然界,是植物体内构成细胞膜的成分之一,也是机体中多种激素、维生素D及甾体化合物合成的前体[2]。植物甾醇不仅可以影响脂质体膜上磷脂分子聚集,调节膜对小分子物质的通透性[3],改变膜的表面性质[4],还可以降低胆固醇的肠道吸收[5]。植物甾醇因其与胆固醇有着极为相似的结构,可影响胆固醇在人体内的代谢,且对人体无副作用,被认为是治疗和预防高血脂症的最佳天然物质[6]。
天然植物甾醇具有不溶于水,微溶于油,熔点高等特性,目前,其主要以物理改性后的形式加入到食品体系中,如乳液、脂质体、微胶囊和纳米粒等,以提高植物甾醇的水溶性。Chao等[7]采用乳化蒸发法制备植物甾醇纳米粒,将植物甾醇溶解在正己烷中,注入含蛋白的水相中,通过高速分散、均质形成植物甾醇纳米粒;彭捷[6]分别采用反溶剂法和白蛋白结合技术制备了水溶性植物甾醇纳米颗粒和富含植物甾醇的高蛋白7S豆奶;曹文君[8]利用乳化蒸发技术构建食物蛋白-植物甾醇纳米颗粒,提高植物甾醇的溶解性和生物利用率。
植物甾醇纳米粒增加了植物甾醇的水溶性,扩大了植物甾醇的应用范围,但目前,对制备的植物甾醇纳米粒的降胆固醇功效研究报道较少。因此,本课题研究了自制的两种植物甾醇纳米粒对高血脂症小鼠的降胆固醇效果,为植物甾醇纳米粒的降胆固醇效果提供理论依据。
1 材料与方法
1.1 材料与仪器
C57BL/6J小鼠 雄性,SPF级,96只,4~5周龄,体重18~22 g,北京华府康生物科技股份有限公司,实验动物合格证号:SCXK(京)2014-0004;普通饲料、垫料 武汉市疾控中心;高脂饲料配方为:普通饲料88.8%,猪油10%,胆固醇1%,猪胆盐0.2%;植物甾醇(纯度≥95%)、阿托伐他汀钙(纯度≥99.5%) 武汉远成共创科技有限公司;大豆分离蛋白(纯度≥95%) 新西兰恒天然有限公司;大豆卵磷脂(纯度≥70%)、壳聚糖(脱乙酰度≥95%,粘度100~200 mpa.s) 阿拉丁试剂有限公司;苏木素 美国Sigma-Aldrich公司;伊红Y(水溶性)、无水乙醇、二甲苯、盐酸、包埋石蜡、中性树胶 国药集团化学试剂有限公司;胆固醇(纯度≥90%)、猪胆盐(胆酸含量≥60%)、猪油 上海源叶生物科技有限公司;总胆固醇(Total Cholesterol,TC)试剂盒、总甘油三酯(Triacylglycerol,TG)试剂盒、高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)试剂盒 南京建成生物工程研究所。
AL204型分析天平 梅特勒-托利多仪器有限公司;DF-101S型磁力搅拌机 上海科尔仪器设备有限公司;T18型高速分散机、Lab Dancer涡旋仪 德国IKA公司;ST2100型pH计 上海奥豪斯仪器有限公司;R3型旋转蒸发仪 瑞士Buchi公司;Zetasizer Nano ZS型激光粒度仪 英国Malvern公司;Turbiscan Lab Expert型稳定性分析仪 法国Formulaction公司;AH-2010型高压均质机 安拓思纳米技术(苏州)有限公司;GC 7890A型气相色谱仪 美国Agilent科技有限公司;PICO 17型高速离心机 赛默飞世尔科技(中国)有限公司;FD5系列冷冻干燥机 美国SIM公司;Enspire酶标仪 美国铂金埃尔默公司;RM 2016病理切片机 德国Leica公司;BX53显微镜 日本奥林巴斯。
1.2 实验方法
1.2.1 样品的制备及表征
1.2.1.1 植物甾醇纳米粒(PNP)制备 将大豆分离蛋白(SPI)溶解在去离子水中,室温搅拌溶解,调节溶液pH为7.0,4 ℃水化过夜。将植物甾醇与卵磷脂按一定比例(1∶1、1∶2、1∶3、1∶4、1∶5)溶解在无水乙醇中,室温搅拌溶解,形成有机相;蛋白分散液于高速分散机下以10000 r/min的转速进行高速分散,用带有针头的注射器将有机相缓慢注入其中,并继续分散5 min;所得混合溶液通过高压均质形成稳定的植物甾醇纳米分散液(Phytosterol Nano-dispersions,PND),旋转蒸发除去乙醇,加水稀释至原蛋白浓度即得植物甾醇纳米粒(Phytosterol Nanoparticles,PNP)。通过对PNP进行表征,稳定性分析及包埋效果进行研究,得到PNP的制备最佳工艺为:均质压力为900 bar,均质次数为6次,植物甾醇与卵磷脂比例为1∶4,大豆分离蛋白浓度为0.75%(w/w),无水乙醇体积为16 mL;所得纳米粒的粒径为(93.35±1.222) nm,电位为(-29.3±0.611) mV,植物甾醇的包埋率为97.26%。且PNP冻干后复溶性良好,经复溶后植物甾醇在水中的溶解度达到了2.122 mg/mL。
1.2.1.2 壳聚糖修饰植物甾醇纳米粒(CS-PNP)制备 按上述方法制备0.75%的SPI溶液,按照PND的最佳工艺条件及制备方法(无需进行高压均质)制备植物甾醇分散液(Phytosterol Dispersions,PD),将壳聚糖按0.2%的比例溶于1%醋酸溶液中,40 ℃搅拌溶解,4 ℃水化过夜,按比例稀释备用。取一定浓度(0、0.1、0.2、0.4、0.6、0.8 mg/mL)的壳聚糖溶液,与植物甾醇分散液按1∶1 (v/v)混合,调节混合液pH至3.5,10000 r/min高速分散2 min,95 ℃水浴搅拌30 min,冷却至室温,得到CS-PNP。所得CS-PNP的最佳制备工艺为:壳聚糖浓度0.4 mg/mL,pH为3.5,加热温度为95 ℃,加热时间为30 min;所得纳米粒的粒径为(182.6±2.05) nm,电位为(35.3±1.58) mV,植物甾醇的包埋率为91.37%。CS-PNP在低温下稳定性良好。
1.2.1.3 空白纳米粒(NP)和空白壳聚糖修饰纳米粒(CS-NP)制备 空白纳米粒(NP)和空白壳聚糖修饰纳米粒(CS-NP)分别按照PNP和CS-PNP的最佳制备工艺条件及制备方法(无需添加植物甾醇)进行制备。
1.2.2 试验动物及饲养条件 试验选用4~5周龄SPF级雄性C57BL/6J小鼠96只,体重18~22 g。实验室温度控制在22~25 ℃,相对湿度为55%~70%,自然光照,自由进食和饮水,适时更换饲料和饮用水,并清理鼠笼。
1.2.3 动物模型建立及干预 在小鼠适应饲养一周后,将小鼠随机分成8组:正常组、高脂模型组、阳性对照组、植物甾醇(PS)组、植物甾醇纳米粒(PNP)组、空白纳米粒(NP)组、壳聚糖修饰植物甾醇纳米粒(CS-PNP)组、空白壳聚糖修饰纳米粒(CS-NP)组,每组12只,每组两笼。正常组饲喂普通饲料,其他组饲喂高脂饲料,自由进食和饮水,建立高脂模型。饲喂8周后,测定小鼠血清指标TG、TC、HDL-C、LDL-C含量,判定高脂模型是否建立成功。模型建立成功后,再对小鼠进行干预,正常组:饲喂普通饲料;高脂模型组:饲喂高脂饲料;阳性对照组:饲喂高脂饲料+0.0075%阿托伐他汀钙;PS组:饲喂高脂饲料+0.2%植物甾醇;PNP组:饲喂高脂饲料+1.75%植物甾醇纳米粒;NP组:饲喂高脂饲料+1.55%空白纳米粒;CS-PNP组:饲喂高脂饲料+1.83%壳聚糖修饰植物甾醇纳米粒;CS-NP组:饲喂高脂饲料+1.63%空白壳聚糖修饰纳米粒。试验药物根据要求按照一定比例与高脂饲料混合均匀后使用,阳性药物(阿托伐他汀钙)按照人体最大摄入量80 mg/d计算,饲料中阿托伐他汀钙以0.0075%的比例添加在高脂饲料中,试验药物均按照PS添加量为0.2%比例换算。
1.2.4 样品收集 建模期间,每周记录小鼠的体重,每日记录采食量,每隔两周小鼠眼眶采血,测定其血脂水平。药物干预4周,干预结束后,小鼠禁食16 h,眼眶取血,颈椎脱臼致死,分离小鼠心、肝、脾、肺、肾,用生理盐水漂洗,滤纸吸干并称重。收集建模期和给药期小鼠粪便,冻干保存,以便进一步分析。
1.2.5 小鼠脏器指数 将分离得到的脏器组织(心、肝、脾、肺、肾)用滤纸吸干称重后,按下列公式计算小鼠的脏器指数:
脏器指数(%)=脏器湿重(g)×100/体重(%)[9]
1.2.6 血清指标测定 眼眶取血所得血浆,室温下静置4 h,8000 r/min离心15 min,取上层血清,4 ℃冷藏保存,试剂盒检测血清中总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)含量。
1.2.7 肝脂检测 利用Folch法[10]抽提肝脏中的脂类物质:取0.5 g肝脏组织在2 mL生理盐水中充分匀浆后,加入10 mL氯仿:无水乙醇(2∶1,v/v)溶液,涡旋混匀,超声10 min,静置10~15 min,5000 r/min离心10 min,收集下层清液保存。用试剂盒方法检测肝脏中的TG含量。取1 mL肝脏提取液,加入200 μL 5α-胆甾烷,氮气吹干,加入10 mL 1 mol/mL氢氧化钾乙醇溶液,80 ℃皂化1 h,加入5 mL水和10 mL正己烷,萃取分液,水洗三次[11-12]。取有机相氮气吹干,加入100 μL吡啶与100 μL BSTFA∶MCS(99∶1),70 ℃衍生1 h,气相分析,检测肝脏中胆固醇与植物甾醇含量。
1.2.8 肝脏组织病理学观察 小鼠解剖后,取一小片新鲜肝脏组织用生理盐水洗净,立即置入4%多聚甲醛中保存。检测时样品经脱水处理(75%乙醇4 h,85%乙醇2 h,90%乙醇1.5 h,95%乙醇1 h,无水乙醇Ⅰ 0.5 h,无水乙醇Ⅱ 0.5 h),透明处理(无水乙醇∶二甲苯为1∶1处理10 min,二甲苯Ⅰ 10 min,二甲苯Ⅱ 7 min)后,在60 ℃浸入石蜡(石蜡Ⅰ 1 h,石蜡Ⅱ 1 h,石蜡Ⅲ 1 h),使生物组织充分脱水,并用石蜡进行包埋;蜡块冷冻后,用Leica RM2235切片机切取厚度为4 μm薄片,贴附于载玻片上,置于42 ℃温水中展开,再放入60 ℃烤箱中烘烤3 h;然后脱去石蜡,将石蜡切片依次放入二甲苯Ⅰ(10 min)-二甲苯Ⅱ(10 min)-无水乙醇Ⅰ(5 min)-无水乙醇Ⅱ(5 min)-95%乙醇(3 min)-90%乙醇(3 min)-80%乙醇(2 min)-70%乙醇(2 min),然后蒸馏水浸洗2 min;接着将切片依次放入Harris氏苏木素染液染色5~7 min,自来水洗浸洗返蓝,1%的盐酸酒精分化2~5 s,自来水洗浸洗返蓝,1%水溶性伊红染液染色2 min,自来水洗浸洗30 s,无水乙醇脱水,二甲苯透明,风干后中性树胶封片;最后在显微镜下观察[13-14]。
1.2.9 粪便中甾醇含量测定 将收集的老鼠粪便冷冻干燥,研成粉末;取0.5 g粪便粉末,加入10 mL氯仿:无水乙醇(2∶1,v/v)超声提取1 h,5000 r/min离心10 min,收集上清液[15]。取1 mL粪便提取液,氮气吹干,按上述1.2.5中的方法测定胆固醇与植物甾醇含量。
1.3 数据处理
2 结果与分析
2.1 建模期小鼠体重、采食量变化
建模期(8周)各组小鼠的平均初始体重为(20±2) g,喂养8周后,小鼠的平均体重增加到(26±3) g(如图1A)。可以看出,饲喂普通饲料和高脂饲料的小鼠体重同步增长,建模结束时,各组小鼠体重并无显著差异。由于饲料配方差异,饲喂高脂饲料组的小鼠采食量均高于饲喂普通饲料组,且7组高脂饲料组小鼠采食量差别不大(如图1B)。
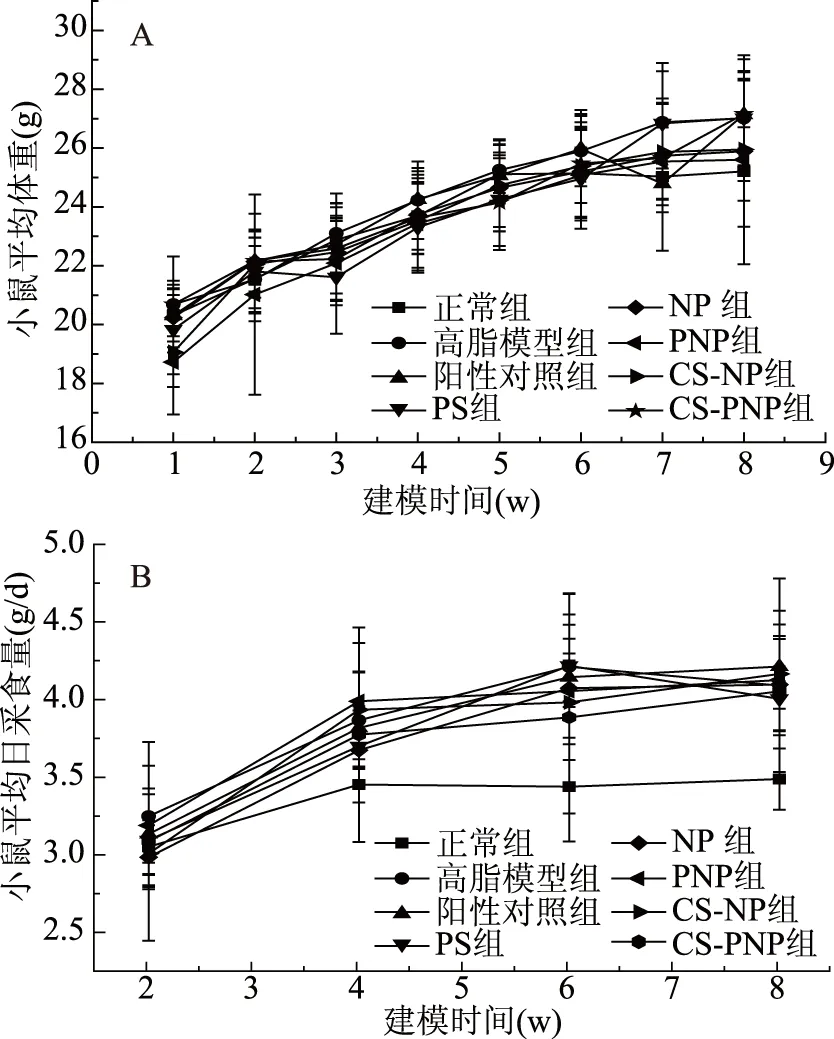
图1 建模期小鼠平均体重(A)及平均日采食量(B)变化
2.2 建模后小鼠血清指标测定
高脂血症是由于脂肪代谢或转运异常导致血脂类浓度异常,包括血清总胆固醇升高、甘油三脂升高、低密度脂蛋白胆固醇升高或高密度脂蛋白胆固醇降低[16]。建模后正常组和高脂模型组小鼠血清指标如表1所示。从表1中可以看出,高脂模型组经过8周高脂饲料喂养后,与正常组相比,高脂模型组TG显著升高(p<0.05),TC和LDL-C极显著升高(p<0.01),而HDL-C显著降低(p<0.05),说明小鼠高血脂模型建立成功。

表1 建模后小鼠血清指标(mmol/L)
2.3 给药期小鼠体重、采食量变化
各组小鼠平均采食量和体重如图2所示,阳性对照组、PNP组、CS-NP组和CS-PNP组小鼠平均采食量呈现先下降后升高的趋势,但无显著性差异(p>0.05),而其他组小鼠平均体重随着饲喂时间延长,采食量逐渐增加。可能是由于降脂药物的添加改变了饲料组成引起老鼠采食的不适,但第2周后均恢复正常,且总的来说,各组小鼠在给药的4周内,采食量呈上升趋势。在前3周,各组小鼠的平均体重逐渐增加,由26 g左右增加到28 g左右;在第4周时,饲喂阿托伐他汀钙的阳性对照组小鼠平均体重从28.82 g降至26.23 g,而其他给药组小鼠平均体重在第4周并无显著变化,且与正常组小鼠无显著差别,略低于高脂模型组小鼠,但无显著差异(p>0.05)。这说明PS、NP、PNP、CS-NP和CS-PNP对小鼠体重没有影响,而阳性药物阿托伐他汀钙会显著(p<0.05)降低高脂小鼠体重。何文森[13]也发现植物甾醇、植物甾烷醇及其酯化产物均不会影响高脂模型组小鼠体重,这可能是由于植物甾醇与阿托伐他汀钙的降胆固醇原理并不相同引起的。
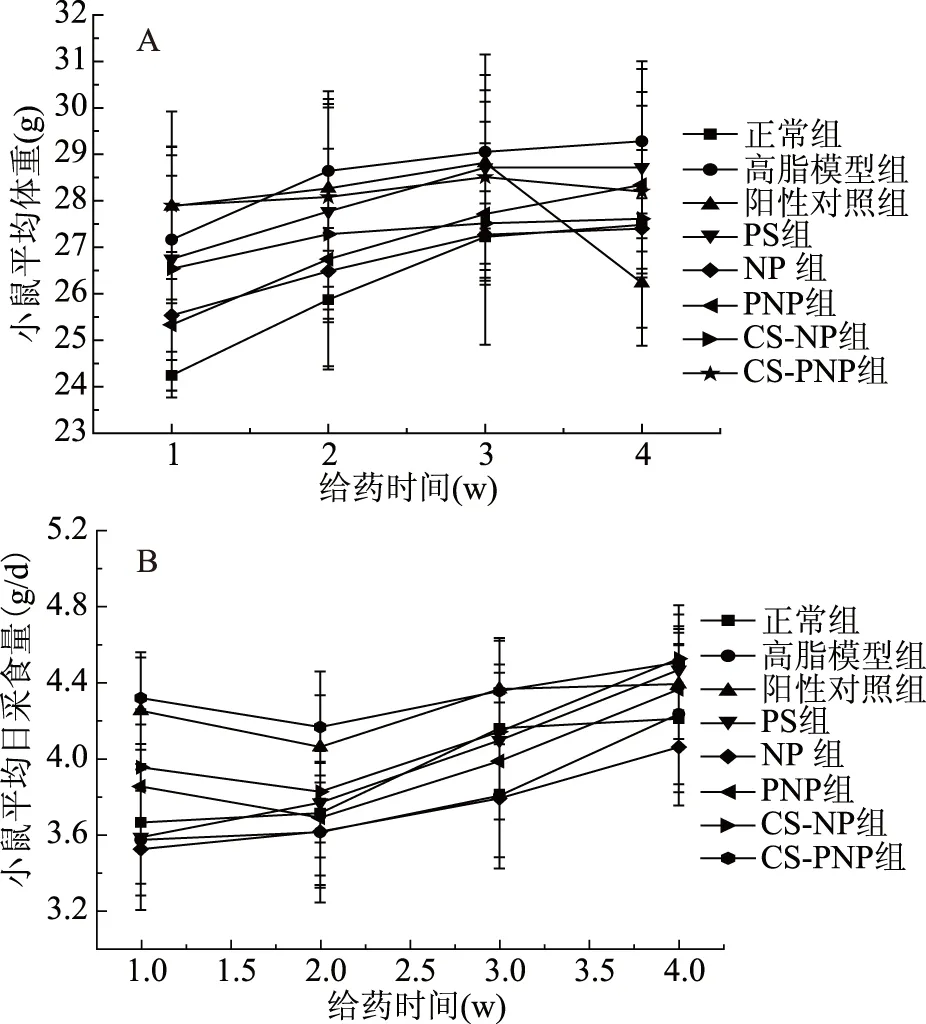
图2 给药期小鼠平均体重(A)及平均日采食量(B)变化
2.4 小鼠脏器指数
给药4周后,小鼠平均脏器指数如表2所示。高脂模型组肝系数显著高于正常组(p<0.05),说明高脂饲料的摄入会影响小鼠肝的健康[17],而其它给药组与正常组肝系数并无显著差异(p>0.05),且除NP组外,均显著低于高脂模型组(p<0.05),说明阳性药物、PS、PNP、CS-NP和CS-PNP均可以显著降低高血脂小鼠肝系数(p<0.05),NP也能降低小鼠肝系数,但效果不显著(p>0.05)。对于心系数,高脂模型组小鼠相对于正常组小鼠有所下降,但其变化并不显著(p>0.05),说明高血脂并未显著影响小鼠心系数,这与侯冬梅[18]的研究结果存在微小差异,但趋势相同,这可能是由于所选试验小鼠品种的差异造成。与高脂模型组相比,PS组和CS-PNP组能显著升高高血脂小鼠心系数水平(p<0.05),与正常组无显著差异(p>0.05),其他给药组与高脂模型组并无显著差别(p>0.05)。高脂模型组小鼠脾系数与正常组均在0.26左右,而给药组小鼠显著提高了小鼠脾系数(p<0.05),说明高血脂并不能影响小鼠脾系数,但阳性药物及其它给药均会升高小鼠脾系数,这可能是植物甾醇及其他活性物质的添加造成了脾脏组织的部分肿大。但对于肺系数和肾系数,各组小鼠之间并未观察到显著差异(p>0.05)。
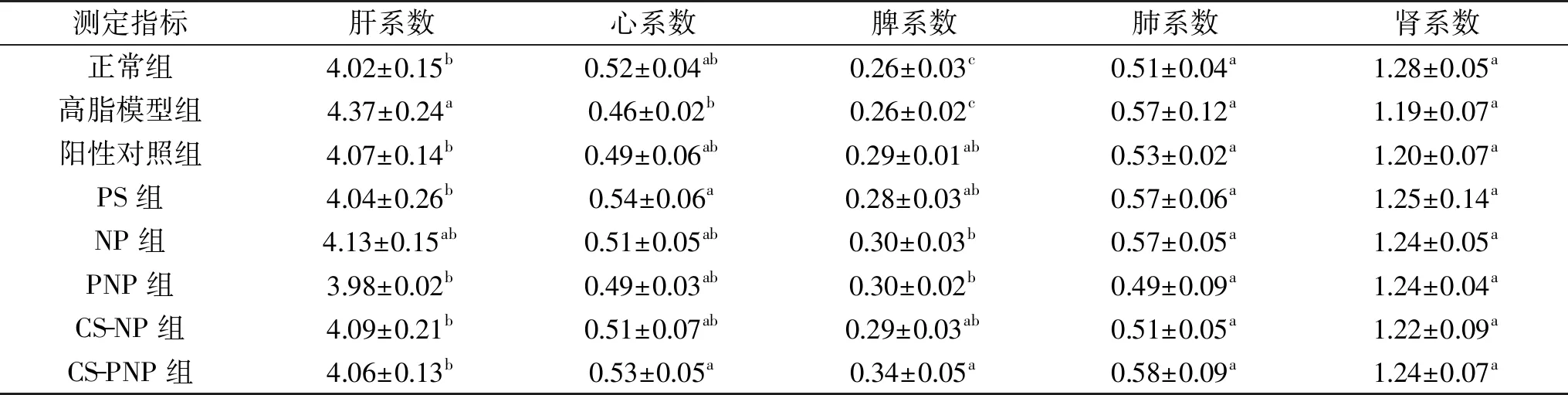
表2 小鼠脏器指数(%)
2.5 给药后小鼠血清指标测定
给药4周后,小鼠血清指标变化如表3所示。对于TG,高脂模型组小鼠显著高于正常组(p<0.05),达到了1.61 mmol/L;与高脂模型组相比,给药后,PS组、PNP组、CS-NP组和CS-PNP组TG含量显著下降(p<0.05),而阳性对照组和NP组TG下降不显著(p>0.05),说明阳性药物阿托伐他汀钙和NP对于高血脂小鼠血清TG并无显著效果,其他给药组对TG疗效显著。对于TC,可以看出,给药组均显著降低了高血脂小鼠TC水平(p<0.05),但PS组、NP组和CS-NP组TG水平仍显著高于正常组(p<0.05),而阳性对照组、PNP组和CS-PNP组与正常组间无明显差异(p>0.05),说明各组药物均对TC有一定的疗效,但阿托伐他汀钙、PNP和CS-PNP对于降低血清TC效果更好。小鼠饲喂高脂饲料后,HDL-C显著降低(p<0.05),而饲喂PNP和CS-PNP后,HDL-C恢复到了正常组水平,其他给药组对于提高高血脂小鼠HDL-C水平并无显著效果(p>0.05)。给药4周后,普通组小鼠LDL-C为0.26 mmol/L,高脂模型组显著升高达到了0.44 mmol/L(p<0.05),给药组均显著降低了高血脂小鼠LDL-C水平(p<0.05),阳性药物和CS-PNP效果最好,LDL-C水平降至0.27 mmol/L,PNP效果次之,也达到了0.29 mmol/L,PS与NP组和CS-NP组也有一定的效果。在一项关于植物甾烷醇酯的研究中也表明,胆固醇轻微升高的个体每日摄入2.6 g谷甾烷醇酯持续一年后,与对照组相比谷甾烷醇酯摄入组的TC和LDL-C水平分别降低10.3%和13%[19]。
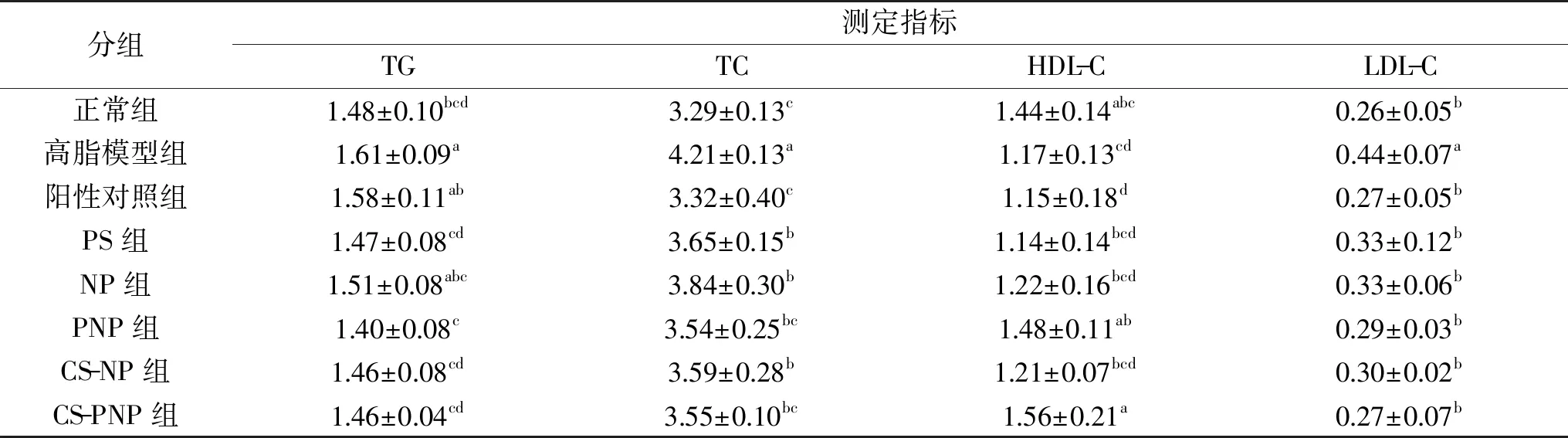
表3 给药后小鼠血清指标(mmol/L)
2.6 肝脂含量测定
肝脏是机体新陈代谢最活跃的组织,且脂质的合成、分解、转运和代谢等活动主要发生在肝脏[20]。同时肝脏也是机体中调节胆固醇和甘油三酯平衡的重要器官[21],如果肝脏受损,脂肪细胞就不能向血液细胞释放甘油三酷、胆固醇和磷脂等,从而造成脂质的积累,引起肝脏病变,所以肝脏中TG和TC的含量可以直接反应植物甾醇对胆固醇代谢的影响[18]。给药后,小鼠肝脏中TG和TC含量变化如图3所示。高脂模型组肝脏TG、TC水平均显著高于正常组(p<0.05),给药后,阳性对照组、PS组、PNP组和CS-PNP组均显著降低了肝脏TG水平(p<0.05),且与正常组无显著差异(p>0.05);NP和CS-NP虽然能降低肝脏TG水平,但效果不显著(p>0.05)。各药物干预组均显著降低了肝脏TC水平(p<0.05),其中阳性对照组、PNP组和CS-PNP组对于降低肝脏TC效果最明显(p<0.05),均达到了普通组水平。PS组、NP组和CS-NP组效果次之。说明两种植物甾醇纳米粒对小鼠肝脏的代谢活动有显著的影响。
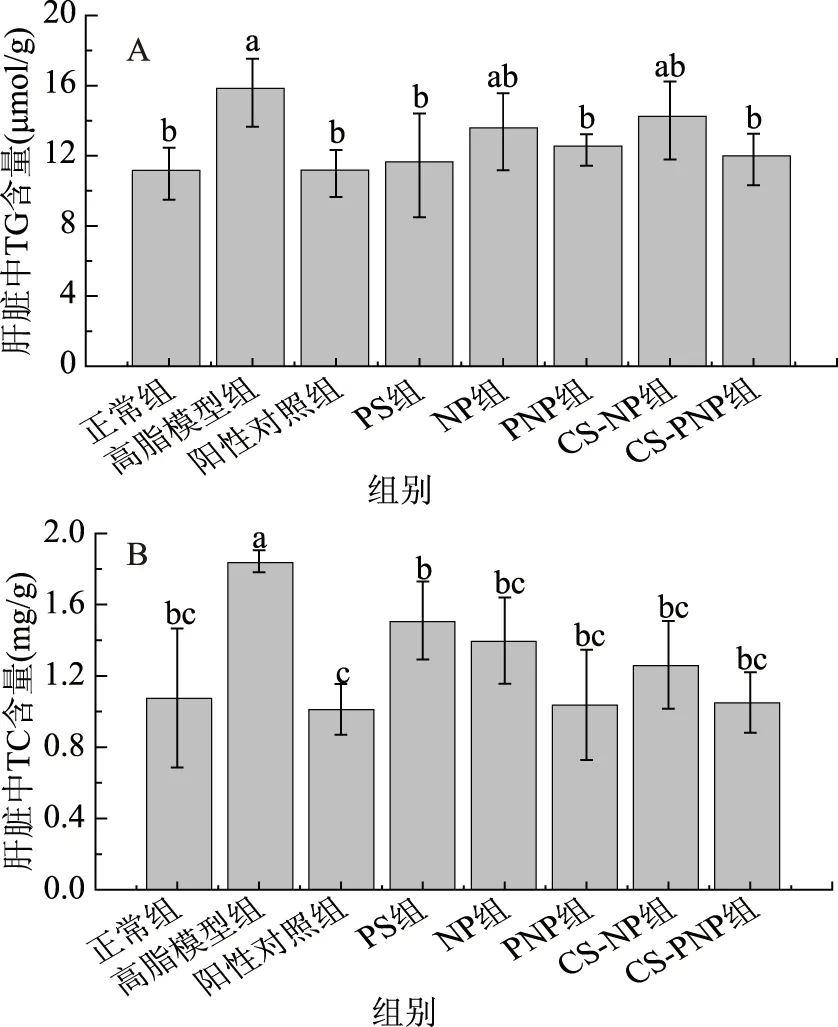
图3 肝脏中甘油三酯(TG)(A)和总胆固醇(TC)(B)含量
2.7 肝脏组织病理学观察
脂肪肝是指由于各种原因引起的肝细胞内脂肪堆积过多的病变,高脂血症常常并发脂肪肝。给药结束后,对小鼠肝脏切片,进行组织病理学观察,结果如图4所示。正常组小鼠肝细胞形态结构规整,分布均匀,细胞质无明显空泡,没有发生脂肪变性。高脂模型组小鼠肝细胞肿大,结构松散,细胞间隙内存在大量大小不一白色空泡,明显发生脂肪变性。给药后,阳性对照组、PS组、NP组和CS-NP组肝细胞形态结构正常,分布较均匀,但可见大量不规则间隙,脂肪变性略微改善。而PNP组和CS-PNP组小鼠肝细胞的形态、结构,细胞质等分布均趋于正常,对小鼠脂肪肝有明显在改善。说明阿托伐他汀钙、PS、NP、CS-NP和PNP、CS-PNP均能改善高血脂小鼠脂肪肝,但后两者效果更好。可以看出肝脏组织切片观察所得结果与图3所示的数据具有很好的一致性,这表明两种植物甾醇纳米粒具有良好的缓解肝脏脂肪病变的功能。
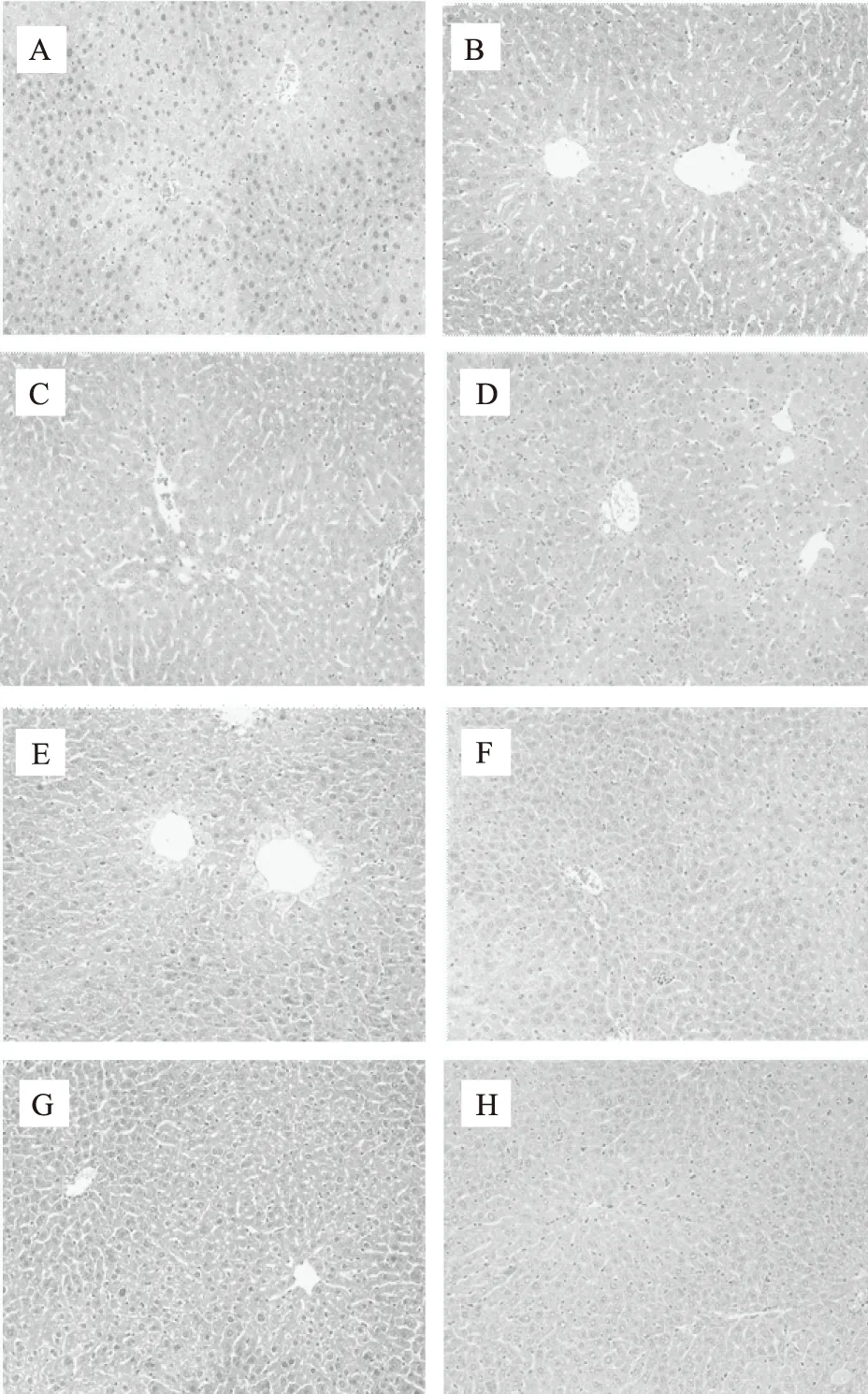
图4 小鼠肝脏组织病理学观察(200×)
2.8 粪便中甾醇含量测定
如图5所示,正常组小鼠粪便中胆固醇含量为1.04 mg/g,而高脂模型组小鼠粪便中胆固醇含量高达30.72 mg/g。添加阳性药物后,胆固醇排出量增加到了34.29 mg/g。对于植物甾醇给药组,由于植物甾醇可以降低胆固醇的吸收,PS组小鼠粪便中胆固醇含量增加到了33.37 mg/g,其效果与阿托伐他汀钙接近;PNP组中植物甾醇纳米化后排出胆固醇相对于PS组又有所增加,但同时植物甾醇的排出也从7.20 mg/g增加到9.42 mg/g,CS-PNP组也发现了类似的结果。据介绍,胆固醇在机体的吸收率可达35%~70%,植物甾醇的吸收率仅为0.4%~3.5%[22]。高脂饲料中添加了1%的胆固醇,加大了机体对胆固醇的摄入量,同时也增加了胆固醇的排出。
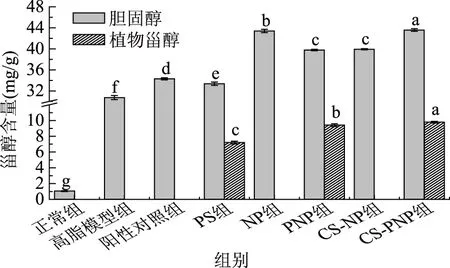
图5 粪便中甾醇含量
3 结论
本研究通过建立高血脂模型考察自制的两种植物甾醇纳米粒(PNP和CS-PNP)对高血脂小鼠的降胆固醇效果。PNP和CS-PNP可通过降低小鼠肝脏和血脂中TG与TC含量、血清LDL-C水平,升高血清中HDL-C水平,促进机体胆固醇的排出,来改善膳食诱导的脂肪肝、高脂血症和高胆固醇血症。本研究为植物甾醇纳米粒的降胆固醇效果提供理论依据,为植物甾醇纳米粒作为膳食补充剂的应用提供了技术支持。
