不同放牧条件下绒山羊肌肉脂肪代谢和沉积变化的研究
2019-08-28王柏辉杨明阳赵丽华田建军
王 宇,王柏辉,杨明阳,杜 瑞,苏 琳,赵丽华,田建军,靳 烨
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
内蒙古绒山羊是我国优良的绒肉兼用型地方品种,相比绵羊肉,山羊肉脂肪含量低,蛋白含量高,更有益于人体健康,肌内脂肪的含量对肌肉嫩度、风味和多汁性具有重要影响,Chartrin等[1]研究表明,胸肌中脂质含量从1.7%增加到8.5%会增加鸭肉的亮度值、黄度值、蒸煮损失、嫩度和风味;肉类脂肪酸种类在烹饪过程中的氧化稳定性中起着重要作用,影响肉的嫩度、风味和多汁性[2]。
目前内蒙古绒山羊饲养模式主要有放牧、舍饲和放牧+舍饲三种模式[3]。对绒山羊的研究主要集中在生产性能和疾病预防、养殖管理等方面。万里强等[4]研究表明放牧山羊的生产性能受山羊有效的采食量、放牧季节和可食植物营养价值等因素的影响;毕台飞等[5]研究表明舍饲山羊的产肉性能优于放牧和放牧补饲,而放牧补饲山羊产绒性能高于其他放牧方式,可能是高运动量和优良的牧草造成的。目前,对绒山羊肌肉脂肪代谢和沉积变化的研究较少。不同放牧区域牧草的多样性和新鲜度不同,Scollan等[6]研究表明牧草种类的多样性和新鲜度及牧草摄入量和摄入时间的延长均可增加肌肉中n-3系列多不饱和脂肪酸的沉积。脂蛋白脂酶(lipoprteinlipase,LPL)可水解血液中乳糜微粒和极低密度脂蛋白中的甘油三酯为游离脂肪酸和甘油,而产生的游离脂肪酸被运送到不同组织中氧化供能或作为脂肪合成的原料,对调控脂肪沉积具有重要的作用[7];硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)是催化饱和脂肪酸合成单不饱和脂肪酸的限速酶,影响肌肉中脂肪酸的组成,SCD基因的高表达有利于脂肪的沉积[8]。Zhang等[9]研究表明SCD和LPL基因表达量的上调,会提高肌肉中肌内脂肪含量的沉积。Dervishi等[10]研究表明羔羊肉中多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)、饱和脂肪酸(saturated fatty acid,SFA)、共轭亚油酸(conjugated linoleic acid,CLA)的含量和n-6/n-3值与SCD和LPL的基因表达量密切相关。
本试验主要通过测定山地放牧和草地放牧绒山羊的营养指标、肌肉脂肪酸含量和脂肪代谢基因mRNA的表达量,分析不同放牧条件下绒山羊肌肉的脂肪代谢和沉积变化,并建立脂肪代谢基因与脂肪和脂肪酸沉积间的联系,旨在了解绒山羊脂肪沉积规律和脂肪调控的机制,增加肌内脂肪和有益脂肪酸的沉积量,减少低营养价值脂肪含量的沉积,从而提高脂肪的利用率。以期为今后通过调控脂肪代谢基因的表达来提高绒山羊肌内脂肪和脂肪酸的沉积,从而为改善羊肉的营养价值和品质提供参考,同时提高对内蒙古绒山羊这一优良的绒肉兼用型地方品种的保护。
1 材料与方法
1.1 材料与仪器
绒山羊的饲养 在阴山山脉中部的大青山地区,气候类型为典型的温带大陆性气候,年降雨约为380 mm,大青山草原是典型荒漠化草原,山地放牧(1800 m以上)选择在大青山山腰处,摄食植物包括黄芩、沙棘、秦艽等;草场放牧(1500 m以下) 选择在大青山地区的草原上,牧草类型为蒙古葱、蒺藜、芨芨草、碱韭等[11];甲醇、正己烷(均为色谱纯)、三氯甲烷、三氯化硼-乙醚络合物、氯化钠、硫酸铜、硫酸钾、硼酸、盐酸、氢氧化钠、无水硫酸钠、硫酸、无水乙醚、氯仿、异丙醇、无水乙醇 均为分析纯,国药集团化学试剂有限公司;37种脂肪酸甲酯的混标 Sigma公司;RNase-free 水 北京天根生物技术有限公司;琼脂粉 天津市风船化学试剂科技有限公司;核酸染料 北京百泰克生物技术有限公司;焦碳酸二乙酯 Intrivogen公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq® Version2.0、Preme Script TMRT reagent Kit with gDNA Eraser、TaKaRa SYBR® Premix Ex TaqTMII 大连宝生物工程有限公司。
SXT-02索氏抽提器 上海洪纪仪器设备有限公司;KDY-9830凯氏定氮仪 北京市通润源机电技术有限责任公司;KDN-D20D消化炉 上海精隆公司;Trace 1300气相色谱质谱联用仪 赛默飞世尔科技公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HJ-6型多头磁力搅拌加热器 江苏荣华仪器制造有限;HH-4水浴锅 上海福玛实验设备有限公司;GRX-9053A 型热空气干燥箱、SX2-4-10箱式电阻炉 上海一恒科技有限公司;ZHJH-C1112C超净台 上海智城分析仪器制造有限公司;Eppendorf5430R低温台式冷冻离心机 北京百晶生物科技有限公司;BG-power5000型稳压稳流电泳仪 北京百晶生物科技有限公司;Mini-sub Cell GT Cel水平电泳槽、GelDoc XR+凝胶成像分析仪、CFX96TM Real-TimePCR仪 美国Bio-rad;Veriti PCR仪 美国Applied Biosystems。
1.2 实验方法
1.2.1 样品采集 在内蒙古土默特左旗大青山牧区,随机选择草场放牧和山地放牧条件下发育正常、健康的1.5岁绒山羊各12只,将该24只绒山羊屠宰后,取背最长肌50 g于-20 ℃保藏待用,取背最长肌10 g于液氮中保存,并置于实验室-80 ℃保藏待用。
1.2.2 营养指标的测定 肌肉中蛋白质根据国标GB 5009.5-2016[12]采用凯氏定氮仪进行测定;肌肉中水分根据国标GB 5009.3-2016[13]采用直接干燥法进行测定;肌肉中脂肪根据国标GB 5009.6-2016[14]采用索氏抽提法进行测定;肌肉中灰分根据国标GB 5009.4-2016[15]采用直接灰分法进行测定。
1.2.3 羊肉中脂肪酸的测定 根据王柏辉等[16]的方法对脂肪酸进行提取:称取碎肉样5 g并加氯仿-甲醇混合液(2∶1,V/V),振摇2 h,浸泡过夜后用G3漏斗过滤,滤液中加5 mL 20%氯化钠溶液,静止分层,下层的氯仿层即为脂肪提取液。经无水硫酸钠脱水后,40 ℃旋转蒸发浓缩得到脂肪。然后加0.5 mol/L的氢氧化钠甲醇溶液5 mL,70 ℃回流5 min,进行脂肪皂化,随后加5 mL三氟化硼乙醚溶液,70 ℃回流2 min,进行脂肪甲酯化。最后加2 mL正己烷,70 ℃回流1 min,再加5 mL饱和NaCl溶液,静置10 min,吸取1 mL正己烷层用0.22 μm有机滤膜过滤于进样瓶中,进行气相色谱分析。
气相色谱条件:色谱柱:反式色谱柱(100 m×0.25 mm×0.20 μm),载气为氦气,载气流速为1 mL/min,进样口温度:240 ℃,进样量为1 μL,分流比为100∶1。采用程序升温:初始温度为60 ℃,保持1 min,然后以20 ℃/min的速度升至120 ℃,保持1 min;再以5 ℃/min的速度升至240 ℃,保持15 min。
MS条件:离子源温度为300 ℃,传输线温度240 ℃,质量扫描范围50~500 (m/z),溶剂延迟时间:4 min。
1.2.4 引物合成 引物序列如表1,LPL、SCD 由上海生工生物工程有限公司设计并合成,β-action作为管基因。

表1 实时定量引物
1.2.5 脂肪基因表达量的测定
1.2.5.1 RNA提取与反转录 称取适量样品于干净的研钵中,多次加液氮且研磨样品至粉状用于RNA提取,并用1%琼脂糖凝胶电泳检测提取的总RNA的质量。样品RNA的最终浓度均为500 ng/μL。使用RT-qPCR的试剂盒将提的RNA反转录为cDNA[8],最后置于-20 ℃下保存备用。
1.2.5.2 实时定量PCR 本试验按照CFX96TM Real-Time PCR Detection System进行操作。以反转录得到的cDNA为模板,使用CFX96TM Real-Time PCR仪进行实时定量PCR扩增。
实时定量PCR反应体系如表2所示。

表2 实时定量PCR反应体系
实时定量PCR扩增反应条件:预变性95 ℃,30 s;变性95 ℃,5 s,退火60 ℃,30 s,延伸72 ℃,30 s(变性、退火和延伸35个循环);延伸72 ℃,10 min。
1.2.6 相关性分析 相关性采用SPSS 19.0 软件中的双变量相关分析(Pearson),在SPSS中导入变量数据,依次点击“分析-相关-双变量”,选择变量导入变量框,并勾选Pearson选项框进行分析,显著性p<0.05表示相关性显著,p<0.01表示相关性极显著。
1.3 数据分析
使用SPSS 19.0软件进行统计分析,采用Excel 2003软件进行图表处理。差异性采用单因素方差(One Way ANOVA)分析进行LSD和Duncan多重比较,相关性采用双变量相关分析(Pearson)。
2 结果与分析
2.1 不同放牧条件下绒山羊营养指标的差异性分析
由表3可知,不同放牧条件下绒山羊的水分、灰分和蛋白质的含量均无显著差异(p>0.05),而山地组肌内脂肪(intramuscular fat,IMF)含量显著高于草地组(p<0.05),这可能与山羊摄入的牧草类型和活动量不同有关,蒋建生[17]研究表明坡度40度以上的草地杂草繁茂,灌丛居多,在陡坡草地上山羊表现得比在平缓草地上更活跃且食欲更旺盛。逯来章等[18]研究表明高海拔地区低氧寒冷,藏羊皮下脂肪层厚,可以增强御寒能力。赵国华等[19]研究表明亚高山草甸草地是优质的放牧地,虽然产草低,但草质好,适口性好,营养丰富,具有显著的“三高一低”(粗脂肪高)的特点。本试验的绒山羊肌内脂肪含量约在3.99%~5.61%之间,Hopkins等[20]研究指出就羊肉的肌内脂肪范围,感官性状模型指出最高脂肪水平(18%)总体喜爱程度比最低脂肪水平(2%)高出13%,并且消费者满意的肌内脂肪含量最低为5%,这与山地组肌内脂肪含量更为接近。汪踔[21]研究表明肌内脂肪含量影响肉的多汁性、嫩度和风味,适度的脂肪沉积使肌肉细嫩多汁,香味浓郁。
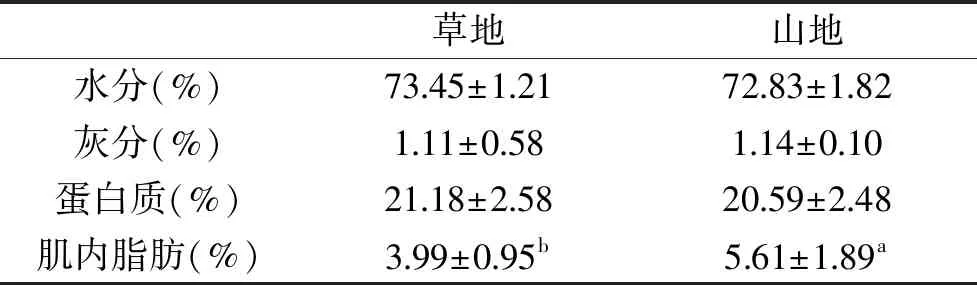
表3 不同放牧条件下绒山羊营养指标的差异性分析
2.2 不同放牧条件下绒山羊肌肉中脂肪酸含量的差异性分析
由表4可知,草地组及山地组绒山羊肌肉中脂肪酸主要以棕榈酸、硬脂酸和油酸为主,分别为92.42%、87.88%,其含量油酸>棕榈酸>硬脂酸的趋势,这与王柏辉等[16]对苏尼特羊的研究结果一致,但绒山羊三种脂肪酸的总比例高于苏尼特羊,原因可能是品种不同导致的。草地组单不饱和脂肪酸(monounsaturated fatty acids,MUFA)含量显著高于山地组(p<0.05);山地组PUFA含量显著高于草地组(p<0.05);SFA含量在两组中无显著差异(p>0.05)。

表4 不同放牧条件下绒山羊肌肉中脂肪酸组成的差异性分析
在SFA中,两种放牧条件下绒山羊肌肉中SFA均以棕榈酸和硬脂酸为主,草地组癸酸含量显著高于山地组(p<0.05);其他脂肪酸含量在两组中差异均不显著(p>0.05)。
在MUFA中,山地组反油酸含量显著高于草地组(p<0.05);草地组油酸含量显著高于山地组(p<0.05),王志武等[22]研究表明油酸能降低胆固醇在血液中的含量,减少其在血管上的沉积,有预防动脉硬化的作用;豆蔻油酸和棕榈油酸含量在两组中无显著差异(p>0.05)。
在PUFA中,山地组反亚油酸、亚油酸、α-亚麻酸和CLA的含量均显著高于草地组(p<0.05),这可能与山羊摄入的牧草类型和活动量的不同有关。张东杰[23]研究表明天然草地各类型中高寒草原类牧草饲料品质最好,其次是低平地草甸类、高寒草甸类、温性荒漠类、温性荒漠草原类、温性草原类,表明山地牧草品质优于草地牧草。山地组绒山羊的运动量大于草地组,漆艳娥等[24]研究表明运动能增加肠道菌群的多样性,厚壁菌门和瘤胃球菌含量增加,拟杆菌门和乳酸杆菌科含量下降。王柏辉等[25]研究表明羊肉中CLA和α-亚麻酸与瘤胃球菌属存在显著正相关,而与拟杆菌属存在显著负相关;反油酸与拟杆菌属存在显著负相关,这与本试验结果相一致。两组的CLA含量有差异可能与瘤胃微生物群体的损伤以及SCD基因表达的抑制有关[26]。亚油酸作为风味物质分解合成的重要底物,对羊肉的风味形成起着重要作用[27]。亚麻酸具有降血压、抗动脉粥样硬化和益智等作用。赵天章[28]研究表明羊肉中含有高含量的CLA,远高于猪肉和禽类,是人类获得CLA的主要食物来源之一。草地组花生三烯酸和花生四烯酸的含量均显著高于山地组;Urrutia等[29]研究表明饲喂高水平的α-亚麻酸会降低肌肉组织中花生三烯酸和花生四烯酸的含量,但低水平的α-亚麻酸饮食会增加花生四烯酸的含量。山地组二十二碳六烯酸(docosahexenoic acid,DHA)含量显著高于草地组(p<0.05),而二十碳五烯酸(docosahexenoic acid,EPA)含量在两组中无显著差异(p>0.05)。EPA和DHA具有降血胆固醇、提高人体免疫力、增加肌肉重量和减少脂肪组织等有益功能[30]。畜禽肉的脂肪酸组成受饮食中脂肪酸组成的影响,产生上述结果的原因可能是山地牧草中含有的n-3PUFA含量高于草地组,使山地山羊肌肉中沉积较多的α-亚麻酸。Scollan等[6]研究表明草类植物含有高比例的(50%~75%)总脂肪酸为α-亚麻酸,而α-亚麻酸的延长和去饱和作用会增加肌肉中EPA和DHA的合成。两组的EPA含量无显著差异可能是由于α-亚麻酸向其长链PUFA产物的转化率是有限的[31]。山地组n-3 PUFA显著高于草地组(p<0.05);山地组n-6/n-3 PUFA值显著低于草地组(p<0.05),比值为3.34,符合营养专家的推荐值n-6/n-3 PUFA≤4[26]。n-6/n-3PUFA值是影响人体健康的重要因素,Simopoulos[32]研究表明饮食中适当的n-6/n-3 PUFA值能预防人类许多慢性疾病的发生,如心血管疾病,癌症以及炎症和自身免疫疾病等,这进一步表明山地放牧组羊肉的营养价值较高。
2.3 不同放牧条件下肌肉中脂肪代谢基因的表达量
SCD和LPL是调控机体脂肪沉积的重要因子。由图1可知,草地组SCD基因表达量显著高于山地组(p<0.05);而山地组LPL基因表达量显著高于草地组(p<0.05),推测原因可能与牧草类型和所处环境有关。相比草地牧草,山地牧草类型多样且营养丰富,使得山地组绒山羊摄入较多的n-3 PUFA,研究表明饮食中高水平的n-3 PUFA会抑制SCD酶的表达活性[33]。相比草地,山地较为寒冷,杨莉[34]研究表明寒冷应激后阿勒泰羊和湖羊各组织中LPL的表达量均显著得升高。Bahnamiri等[35]研究表明相对于饱和脂肪酸,高的SCD mRNA丰度能导致更多的不饱和脂肪酸的合成,主要使棕榈酸和硬脂酸去饱和形成棕榈油酸和油酸[36],这与本试验结果一致。LPL基因在控制肌肉组织和脂肪组织之间的三酰基甘油分配中起关键作用[33]。

图1 不同放牧条件下SCD和LPL基因的表达量
2.4 脂肪代谢基因与肌内脂肪和脂肪酸含量的相关性分析
由表5可知,SCD 和LPL基因的表达量均与肌内脂肪含量呈正相关,且LPL基因的表达量与肌内脂肪含量呈显著正相关(p<0.05),相关系数为0.587。与Wang等[37]和Jeong等[38]的研究结果一致,说明SCD和LPL基因高表达有利于肌内脂肪沉积。SCD基因表达量与MUFA含量呈显著正相关(p<0.05),与Wang等[37]研究结果一致,在不饱和脂肪酸合成中SCD基因起着重要的作用,可将SFA转化为MUFA。LPL基因表达量与PUFA呈极显著负相关(p<0.01),与SFA呈正相关,这与田佳[39]的研究结果一致。有研究表明高含量的PUFA能够干扰生脂酶LPL基因的转录和破坏其mRNA的稳定性,进而会抑制LPL基因的表达[40]。祝仁铸[41]研究表明LPL酶活性的增加,会促使脂肪酸再生能力的增加,更有利于脂肪的沉积。通过相关性可以证实SCD和LPL基因对于羊肉的脂肪沉积和脂肪酸组成是重要的,并且这些基因的评估和使用可以用于改善羊肉的质量。

表5 脂肪代谢基因与肌内脂肪和脂肪酸含量的相关性分析
3 结论
山地组肌内脂肪含量显著高于草地组(p<0.05)。在脂肪酸含量方面,山地组中多不饱和脂肪酸的含量显著高于草地组,特别是α-亚麻酸、DHA和CLA(p<0.05),且山地组n-6/n-3 PUFA比值为3.34,说明山地组绒山羊的肌内脂肪含量分布合理,且山地羊肉具有较高的营养价值。
在调控脂肪代谢的基因中,草地组SCD基因的表达量显著高于山地组(p<0.05);而山地组LPL基因的表达量显著高于草地组(p<0.05);通过相关性分析可知,SCD基因的高表达能促进MUFA的沉积;LPL基因高表达能促进肌内脂肪的沉积,但却会抑制肌肉中PUFA的沉积。因此,未来可通过调控SCD和LPL基因的表达来改善畜禽肉中脂肪和脂肪酸含量的沉积,从而提高羊肉的营养价值和品质。
