电针合谷对牙髓痛大鼠模型三叉神经节和牙髓中 P2X4受体的影响
2019-08-28张英陈莉刘宇炜乐凯严琴李超英
张英,陈莉,刘宇炜,乐凯,严琴,李超英
(1.江汉大学,武汉 430056;2.湖北省中山医院,武汉 430033)
牙髓痛为口腔疾患中常见的症状之一[1-2],可见于西医学的龋齿、牙髓炎、根尖周围炎和牙本质过敏等[3-5]。中医学称之为“骨槽风”“牙咬痛”“牙宣”[6-7]。针刺合谷对牙髓痛具有良好的镇痛作用[8-10],但其作用机理尚不明确。P2X受体作为配体门控型离子通道,在体内组织、部位均有表达,当前已克隆出P2X1-77种亚型[11], P2X1-6亚型大多在初级感觉神经元表达,如结状神经节、背根神经节及三叉神经节。近年来已有研究证实P2X受体中 P2X4受体与神经病理痛相关[12],在疼痛信息的传递过程中起重要作用[13-15]。电针合谷治疗牙髓痛的作用与P2X4受体的关系还不明确。本实验以大肠杆菌内毒素(LPS)诱导的牙髓痛大鼠为研究对象,利用RT-PCR检测三叉神经节和牙髓中P2X4受体mRNA的表达量,以探索电针合谷治疗牙髓痛的可能机制。
1 材料与方法
1.1 实验动物
牙体、牙列完整,无龋坏、牙齿畸形及牙周病,咬合正常的健康成年雄性SD大鼠42只,由武汉大学动物实验中心提供,许可证号为 SCXK(鄂)2008-0004,体质量180~250 g,随机分为正常组(N组)、对照组(C组)、牙髓痛组(M组)、拮抗剂组(A组)、电针组(E组)、拮抗剂+电针组(AE组),每组7只。
1.2 主要药品与仪器
微量移液器(德国Eppendorf公司),Realtime PCR仪(ABI公司),冷冻离心机(Sigma公司),大肠杆菌内毒素(上海禾丰制药,生产批号 120801),A-317491(美国Sigma公司),Trizol(Invitrogen公司),氯仿、异丙醇、无水乙醇(沪试公司),PrimeScriptTM RT reagent Kit、SYBR® Premix Ex TaqTM Ⅱ(TAKARA 公司),β-actin引物(上海生工公司),P2X4引物(上海生工公司)。
1.3 动物造模及治疗方法
N组不做任何处理;C组在钻好的牙髓腔内注入与M组等量的生理盐水,浸润5~6 min后用牙科填料将牙洞封闭;M组用小型电钻或手钻(钻头直径约 1 mm)在上颌一侧第一和第二磨牙上钻孔,深入牙髓腔并暴露牙髓,用微量注射器注入浓度为 5 μg/μL的大肠杆菌内毒素(LPS)溶液(每孔注入约 1~3 μL),浸润 5~6 min后用牙科填料将牙洞封闭[16];A组同M组造模后,在注射器注入LPS溶液时,将A-317491(0.5 mg/kg)同时注射进牙髓;E组针刺双侧合谷[17]穴,接电针治疗仪,选连续波,频率2 Hz,强度为1 mA,留针30 min,每日1次,共治疗3次;AE组同M组造模后,在注射器注入LPS溶液时,将 A-317491(0.5 mg/kg)同时注射进牙髓,针刺双侧合谷穴,接电针治疗仪,选连续波,频率2 Hz,强度为1 mA,留针30 min,每日1次,共治疗3次。
1.4 样本采集
大鼠腹腔注射 10%水合氯醛麻醉后断颈处死,立即取出三叉神经节、牙髓。
1.5 行为学分析
观察每组大鼠开始治疗第一天至最后一天的体质量变化及外观变化,观察每组大鼠造模后半小时行为学变化,包括大鼠甩头、嘶叫和舔足动作[18-20]。具体行为学观测方法:每天将各组大鼠经造模后,放入 Face Crooming观测仪内,待其适应环境5 min后,通过仪器底部的摄像机进行实时拍摄,并分别记录每只大鼠在30 min内甩头、嘶叫和舔足动作次数。
1.6 实时定量聚合酶链反应(ReaI-time poIymerase chain reaction, RT-PCR)检测三叉神经节、牙髓中P2X4受体基因(messenger RibonucIeic Acid, mRNA)表达
1.6.1 逆转录反应
用 Trizol RNA提取试剂盒提取三叉神经节总RNA。将 4 μL 5×RT Buffer、2 μL dNTP、1 μL Oliga(dT)18、1 μL RNase Inhibitor、1 μL ReverTra Ace和1 μg RNA,加RNase free H2O调至20 μL。42℃ 20 min,将mRNA逆转录为cDNA,95℃ 5 min灭活逆转录酶后-20℃保存。
1.6.2 实时荧光定量检测P2X4的mRNA
采用SYBR Green荧光染料法针对P2X4的mRNA进行实时RT-PCR检测,吸取逆转录反应产物10 μL引物上下游各 2 μL,加缓冲液 10 μL、ddH2O 4 μL及 SYBR Green荧光染料1 μL,放入荧光定量PCR仪,50℃持续2 min,接着95℃持续10 min,然后95℃持续15 s,退火1 min后,95℃持续15 s,然后60℃持续15 s,最后95℃持续 15 s,如上进行 45个循环,经 4℃延伸10 min。设置阴性对照和β-actin内参照。对P2X4受体CT值进行标准化,得到各组P2X4受体mRNA相对表达量。
1.7 统计学方法
所有数据采用 SPSS19.0统计软件进行单因素方差分析(one-way-ANOVA),继以 LSD检验,实验结果以均数±标准差表示。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠行为学及体质量变化情况
正常大鼠皮毛光润,行动自如,体质量稳定增长。LPS造模后大鼠皮毛萎缩无光泽,行动迟缓,并有体质量增加不明显等现象。观察造模后30 min大鼠的行为变化可以发现,造模大鼠甩头、嘶叫和舔足次数明显增多,各组大鼠行为学及体质量变化情况见表1和表2。
由表1可以看出,M组、A组、E组、AE组行为学变化均显著高于C组和N组(P<0.01);A组、E组、AE组行为学变化均显著低于M组(P<0.01)。
由表 2可以看出,C组体质量显著低于 N组(P<0.01);M组、A组、E组、AE组体质量均显著低于 C组和N组(P<0.01);E组、AE组体质量均显著高于M组(P<0.01);A组体质量稍高于M组(P<0.05);AE组体质量显著高于A组和E组(P<0.01);E组体质量稍高于A组(P<0.05)。
表1 各组大鼠行为学变化 (±s,次)

表1 各组大鼠行为学变化 (±s,次)
注:与 N组比较1)P<0.01;与 C组比较2)P<0.01;与 M组比较3)P<0.01
组别 n 甩头次数和 嘶叫次数和 舔足次数和N 组 7 5.6±1.15 1.8±1.30 7.0±1.58 C 组 7 5.8±1.30 2.2±0.45 7.2±1.10 M 组 7 14.0±1.581)2) 7.4±1.141)2) 17.4±1.521)2)A 组 7 12.0±1.481)2)3) 5.2±0.841)2)3) 13.0±1.581)2)3)E 组 7 11.2±1.301)2)3) 5.6±0.891)2)3) 13.4±1.141)2)3)AE 组 7 10.4±1.141)2)3) 5.0±1.001)2)3) 12.0±1.581)2)3)
表2 各组大鼠体质量变化 (±s,g)
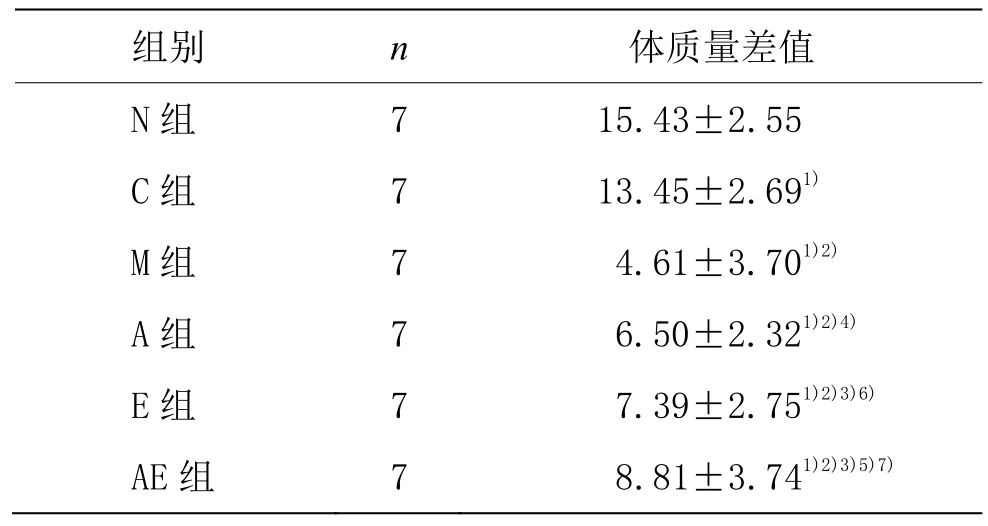
表2 各组大鼠体质量变化 (±s,g)
注:与 N组比较1)P<0.01;与 C组比较2)P<0.01;与 M组比较3)P<0.01,4)P<0.05;与A组比较5)P<0.01,6)P<0.05;与E组比较7)P<0.01
组别 n 体质量差值N组 7 15.43±2.55 C组 7 13.45±2.691)M组 7 4.61±3.701)2)A组 7 6.50±2.321)2)4)E组 7 7.39±2.751)2)3)6)AE组 7 8.81±3.741)2)3)5)7)
2.2 电针合谷对大鼠三叉神经节和牙髓中 P2X4受体mRNA表达量的影响
由表3可以看出,C组三叉神经节P2X4受体mRNA表达量稍高于 N组(P>0.05);M组、A组、E组、AE组 P2X4受体 mRNA表达量明显高于 N组(P<0.01);M组、E组、AE组P2X4受体mRNA表达量高于C组(P<0.05);A组 P2X4受体 mRNA表达量高于 C组(P<0.01);E组、AE组大鼠P2X4受体mRNA表达量低于M组(P<0.01)。
由表4可以看出,C组牙髓P2X4受体mRNA表达量稍低于N组(P>0.05);M组、A组、E组、AE组P2X4受体mRNA表达量明显高于N组(P<0.01);M组、A组、E组、AE组P2X4受体mRNA表达量高于C组(P<0.01);E组、AE组大鼠 P2X4受体 mRNA表达量低于 M组(P<0.01)。
表3 各组大鼠三叉神经节P2X4受体mRNA相对表达量比较(±s)

表3 各组大鼠三叉神经节P2X4受体mRNA相对表达量比较(±s)
注:与N组比较1)P<0.01;与C组比较2)P<0.01,3)P<0.05;与M组比较4)P<0.01
组别 n P2X4受体mRNA相对表达量N组 7 0.269±0.036 C组 7 0.308±0.046 M组 7 0.353±0.0271)3)A组 7 0.387±0.0291)2)E组 7 0.347±0.0311)3)4)AE组 7 0.332±0.0311)3)4)
表4 各组大鼠牙髓P2X4受体mRNA相对表达量比较(±s)

表4 各组大鼠牙髓P2X4受体mRNA相对表达量比较(±s)
注:与N组比较1)P<0.01;与C组比较2)P<0.01;与M组比较3)P<0.01
组别 n P2X4受体mRNA相对表达量N组 7 1.065±0.043 C组 7 1.023±0.079 M组 7 1.768±0.0471)2)A组 7 1.888±0.1311)2)E组 7 1.693±0.0811)2)3)AE组 7 1.728±0.3201)2)3)
3 讨论
牙髓痛由牙髓的神经末梢传导至外周感受器三叉神经节的感受神经元,经收集后传入下一级神经元,最后到中枢相应部位,由大脑皮层作出痛反应[21-23]。牙髓内仅存在伤害感受器/疼痛感受器,当牙髓受到刺激时,唯一的感觉就是痛[18]。动物不能用言语表达其疼痛状态,创建病理性疼痛模型还需利用行为学观察进行分析,目前运用较多是采用不同的行为学方法评价牙髓痛模型[18-20],如甩头、嘶叫和舔足等。LPS诱导的炎性牙髓痛大鼠痛反应明显增强,牙髓痛组与正常大鼠相比,牙髓痛组大鼠食量减少、体质量增长缓慢、皮毛光泽度降低,且出现甩头、嘶叫和舔足等疼痛表现增多,提示LPS诱导大鼠牙髓痛模型的可行。
P2X受体作为非选择性配体门控型离子通道可与细胞外ATP结合,允许Na+、K+、Ca2+离子通过[24],诱发动作电位沿神经轴突向中枢神经系统传导,从而产生痛觉[25],在机体痛觉的构成、传导和调节中起重要作用[26-27]。P2X4受体在小胶质细胞及外周巨噬细胞均有表达,参与感觉神经元兴奋及痛觉产生[28-29]。实验显示髓痛组大鼠三叉神经节、牙髓中 P2X4受体 mRNA表达量均显著高于对照组、正常组。由此可推断P2X4受体参与牙髓痛的信号传导。
P2X受体亚型P2X3受体在神经病理性疼痛中发挥重要作用[30-32],A-317491是P2X3受体特异性拮抗剂,可有效抑制P2X3受体的表达[33]。而前期的研究发现P2X3受体高表达于牙髓痛模型,A-317491作为拮抗剂可有效抑制 P2X3受体高表达,从而产生镇痛效应[34]。本次实验显示拮抗剂组大鼠三叉神经节和牙髓中 P2X4受体 mRNA表达量与牙髓痛组无明显统计学差异,说明A-317491作为P2X3受体的特异性拮抗剂,对P2X4受体并无明显抑制作用。
合谷是手阳明大肠经的原穴,出自《灵枢·本输》,善治头面、五官疾患,是针灸临床治疗牙痛的效穴。实验显示,电针组、拮抗剂+电针组两组大鼠三叉神经节、牙髓中P2X4受体mRNA表达量明显低于牙髓痛组,提示电针合谷可抑制 P2X4受体的表达,从而抑制牙髓痛伤害信息的传导。于此同时,电针组、拮抗剂+电针组大鼠三叉神经节、牙髓中 P2X4受体 mRNA表达量无统计学差异,说明在电针合谷有效抑制P2X4受体,与拮抗剂的参与与否并无明显影响,由此推断电针合谷不但能协同拮抗剂 A-317491抑制 P2X3受体表达产生镇痛效应,而且某种程度上更优于拮抗剂A-317491能进一步抑制P2X4受体表达,从而达到镇痛作用。
本研究结果提示P2X4受体参与了实验性牙髓痛的产生与传导,电针对牙髓痛的镇痛作用与 P2X4受体参与密切相关,这可能是电针合谷镇痛的机制之一,电针合谷如何调节 P2X4受体的信号转导还有待进一步研究。
