杜英内生真菌Aspergillus versicolor倍半萜类次级代谢产物及(8S)-hydroxysydonic acid的含量测定研究
2019-08-28余紫荆谭明慧包尚松刘呈雄邓张双郭志勇
余紫荆 谭明慧 包尚松 刘呈雄 邓张双 郭志勇 邹 坤
(三峡大学 生物与制药学院 天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
植物内生菌种类繁多,具有复杂的多样性,是植物微生态系统的重要组成部分.植物和微生物在长达近亿年的进化过程中,形成稳定的互惠共生关系,为植物在应对环境胁迫,病原菌的入侵等方面提供保护,被誉为植物的“第二套免疫系统”[1-3].植物内生菌作为产生活性新颖的次级代谢产物的能力,广泛的应用于生物防治,外源基因载体及新药来源等[4].杜英(Elaeocarpus decipiensHemsl)系杜英属常绿植物,由于其病虫害较少,生长快,而广泛用于城市绿化.本文在从植物内生菌中寻找活性次级代谢产物过程中,杜英叶片内生真菌混合培养提取物显示强的抗菌活性,因而从中分离得到的一株内生真菌Aspergillus versicolor,在实验室中发酵,并分离鉴定其次级代谢产物,一共分离得到8个化合物,并测定了化合物1在固体发酵条件下的含量.

图1 化合物1-8的结构图
1 实验部分
1.1 仪器
微型台式5415D型高速离心机(德国Eppendof公司),SW-CJ-ZF型双人双面净化工作台(苏州净化设备有限公司),立式压力蒸汽灭菌器(上海博讯实业有限公司),DZ-900大容量振荡器(太仓市实验设备厂),冰箱(中国Haier公司),电子分析天平(中国上海梅特勒-托利多有限公司),X-4数字显示显微熔点测定仪(北京泰克仪器有限公司),S-3100紫外可见分光光度计(SCINCO公司),紫外线分析仪ZF-6型(上海精密实验设备有限公司),DHG-9140A型电热恒温鼓风干燥箱(上海精密实验设备有限公司),N-1001旋转蒸发仪(上海爱郎仪器有限公司),圆二色谱仪(qCD,英国),HPLC DIONEX Ultimate 3000(DAD美国戴安液相色谱有限公司),HPLC Waters1525EF分析兼半制备(美国 Waters有限公司),Ultrashied TM 400 MHz Plus核磁共振波谱仪(瑞士),ISQ四级杆质谱仪(赛洛菲有限公司),Nicoler Auatar Speltrometer series FT360红外光谱仪(美国),酶联免疫检测仪(Genios Tecan),XDS-1B倒置显微镜(重庆光学仪器厂),Kromasil分析型色谱柱;(250×4.6 mm,5μm,250×4.6 mm,10μm)北京英莱克科技发展有限公司.
1.2 试剂
分析纯葡萄糖(国药集团化学试剂厂),琼脂粉(中国惠兴生化试剂有限公司),化学纯薄层层析硅胶(200~300 mesh,硅胶H)青岛海洋化工厂,RP-18硅胶填料(日本YMC公司),葡聚糖凝胶Sephadex LH-20(美国安玛西亚公司),分析纯氯仿,甲醇,丙酮,石油醚,乙酸乙酯,正丁醇,冰乙酸,次氯酸钠医用酒精(国药集团化学试剂厂),色谱纯甲醇、乙腈(J.T.Baker.USA),色谱纯乙醇、正己烷(J.T.Baker.USA).
1.3 内生真菌分离及鉴定菌株
从植物杜英叶片分离得到一株内生真菌,并保存在4℃的PDA斜面培养基上,保存在三峡大学生物与制药学院天然产物研究利用湖北省重点实验室内,经18S RDNA-ITS分子生物学手段鉴定为Aspergillusversicolor.
1.4 内生真菌培养及浸提
内生真菌Aspergillusversicolor,先采用液体培养方法制取种子液,在500 m L三角瓶中装200 m L马铃薯葡萄糖培养液,经121℃高温灭菌20 min,在超净工作台上从平板中接入真菌,接种5瓶,在室温下摇床培养7 d,摇床转速为120 r·min-1,作为种子液待用.然后把种子液接入3 000 m L三角瓶固体培养基(大米麸皮培养基)中,培养40 d后,收集捣碎的固体培养基,用乙酸乙酯萃取,在旋转蒸发仪上浓缩得浸膏,把浸膏悬浮分散在500 m L蒸馏水中,分别以石油醚,乙酸乙酯,正丁醇萃取,分别得到石油醚,乙酸乙酯及正丁醇部位.
1.5 次级代谢产物分离
取乙酸乙酯部分浸膏20 g,用200~300目的硅胶干法拌样,选用合适的正相硅胶柱,用不同比例的石油醚-乙酸乙酯梯度洗脱,经TLC分析收集合并各组分,得到8个不同的片段.片段4经正相硅胶柱层析,Sephadex LH-20层析及半制备HPLC,得到化合物1(2 g),2(10 mg),3(6 mg)和4(8 mg),片段5通过正相硅胶柱层析,Sephadex LH-20层析及半制备HPLC分离得到化合物5(4 mg),6(3 mg),7(7 mg),8(9 mg),9(3 mg).
1.6 (8S)-hydroxysydonic acid(1)含量测定
采用HPLC对真菌发酵产物乙酸乙酯粗提物中主成分的含量进行测定,以纯化的主成分化合物为对照品.HPLC条件:以49%色谱甲醇/水(水中加入0.02%冰乙酸)为流动相,Kromasil分析型色谱柱(250 mm×4.6 mm×10μm),柱温25℃,流速1 m L/min,检测波长为254 nm,进样量10μL.
1)仪器精密度实验.精密称取20 mg对照品于EP管中,加入1 m L色谱甲醇溶解,超声处理20 min,溶解为20 mg/m L,取该溶液50μL,加色谱甲醇至1 m L,稀释至1 mg/m L,连续进高效液相仪5次,统计对照品5次测量峰面积的RSD值,确认仪器精密度是否良好.
2)标准曲线的绘制.依次吸取上述20 mg/m L照品溶液25μL、50μL、75μL、100μL、125μL于EP管中,再分别加入色谱甲醇至1 m L,超声处理20 min,得主成分化合物对照品系列溶液.将上述系列对照品溶液依次注入液相色谱仪以检测色谱峰的峰面积,然后将对照品的质量浓度(mg/m L)设为横坐标(X),其对应的峰面积设为纵坐标(Y),得出标准曲线方程.
3)稳定性试验.精密称取粗提物浸膏25 mg于EP管中,加入色谱甲醇1m L,超声处理20 min,溶解为25 mg/m L.吸取该溶液200μL,加入色谱甲醇至1 m L,稀释至5 mg/m L.然后将该5 mg/m L的溶液于0 h、2 h、4 h、6 h、8 h重复进样.计算这5次测量的峰面积的RSD值,确认样品溶液在8 h内是否稳定.
4)重现性实验.称取粗提物浸膏5份,制备5份供试品溶液,制备方法同上.将5份供试品依次进行HPLC测定.统计这5次测量的峰面积的RSD值,确认该测定方法是否具有良好的重现性.
5)加样回收试验.依次吸取上述1 mg/m L对照品溶液800μL、900μL、1 000μL至EP管中,再分别加入色谱甲醇至1 m L,配制成0.8 mg/m L、0.9 mg/m L、1.0 mg/m L的对照品溶液.分别取对照品溶液各200μL至3个EP管中,再各自加入200μL已知主成分含量的8 mg/m L的粗提物供试品溶液.超声处理20 min.将3份混合样品依次进行HPLC测定,计算加入的对照品的回收率.
6)计算8 mg/m L粗提物溶液中化合物1的含量.
2 结果与讨论
2.1 结构鉴定
化合物1为无色晶体,熔点135~136℃.紫外光谱显示在248和304 nm处有吸收.其氢谱较为简单,在芳香氢信号区域有3组信号分别位于δ7.28(d,8.2,1H),7.46(dd,2.4,8.2,1 H),7.39(d,2.4,1 H)处,通过耦合常数判断该3组氢信号可能是1,3,4-三取代苯环特征峰信号.而高场区仅有δ1.96(m,1H),1.80(m,1H),1.40(m,2H),1.39(m,1H),1.28(m,1 H)的氢信号,此外还有3个甲基信号,分别位于δ1.60(s,3H),1.11(s,3H)和1.10(s,3H)处.而化合物1的碳谱中显示15个碳信号,其中烯碳信号7个,分别位于δ169.9,156.8,137.9,131.5,127.7,121.6,118.6,推测化合物1中可能含有1个与苯环共轭羧基存在;2个连氧季碳分别位于δ77.8和71.5处,3个CH2信号分别位于δ44.9,43.9,和19.9处,3个甲基信号位于δ28.8,29.1和29.2处.通过查阅文献发现化合物1与(-)-hydroxysydonic acid的波谱数据一致[5].
化合物1的NMR数据:1H NMR(400 MHz,CD3OD-d4):δ7.46(dd,2.4,8.2,1H),7.39(d,2.4,1H),7.28(d,8.2,1H),1.96(m,1 H),1.80(m,1H),1.60(s,3H),1.39(m,1H),1.28(m,1H),1.40(m,2H),1.10(s,3 H),1.11(s,3 H);13C NMR(100 MHz,CD3OD-d4):δ169.9(C),156.8(C),137.9(C),131.5(C),127.7(CH),121.6(CH),118.6(CH),77.8(C),71.5(C),44.9(CH2),43.9(CH2),29.2(CH3),29.1(CH3),28.8(CH3),19.9(CH2).
化合物2为一无色油状物,易溶于甲醇、丙酮.紫外光谱显示在250和304 nm处有吸收.比较化合物2与化合物1的氢谱和碳谱发现,两者之间在氢谱上的差别主要在于δ0.86(d,6.8,3H)的甲基氢信号,而在化合物1中该甲基信号为单峰,其次是明显多了1个位于δ2.00(s,3 H)处的单峰甲基信号,根据其化学位移推断该甲基可能为乙酰基上的甲基氢信号,最后在δ3.88(m,1H),3.80(m,1H)处多出来2个连氧碳上的氢信号.进一步分析其碳谱和DEPT谱发现,化合物2与化合物1相比,明显多了1个δ173.1的碳信号,少了1个连氧季碳信号,多了1个位于δ70.5的CH2的碳信号.通过与文献[6] 对比,因而确定化合物2为12-acetoxysydonic acid.
化合物2的NMR数据:1H NMR(400 MHz,CD3OD-d4):δ7.44(d,8.0.1H),7.38(br s,1H),7.27(d,8.0,1 H),3.88(m,1H),3.80(m,1 H),2.00(s,3H),1.96(m,1H),1.81(m,1H),1.72(m,1H)1.60(s,3 H),1.35(m,1 H),1.29(m,2H),1.11(m,1 H),0.86(d,6.8,3 H);13C NMR(100 MHz,CD3OD-d4):δ173.1(C),169.9(C),156.8(C),137.6(C),132.5(C),127.7(CH),121.5(CH),118.6(CH),77.7(C),70.5(CH2),43.4(CH2),34.7(CH2),33.7(CH),28.8(CH3),22.4(CH2),20.8(CH3),17.1(CH3).
化合物3为无色油状物,易溶于甲醇、丙酮.紫外光谱显示在249和301 nm处有吸收.化合物3的高分辨质谱显示其在m/e[M+Na]+=303.1202(Cacld.303.1203),表明其分子式为C15H20O5,不饱和度为6,苯环和羧基共满足5个不饱和度,说明化合物3中还有一个环存在.化合物3与化合物1相比,苯环上的部分氢和碳的波谱数据几乎是一模一样的,主要差别在于侧链部分,化合物3中少了1个CH2,而多了1个连氧的CH;与化合物1相比,侧链末端甲基明显是相隔较开的2个单峰甲基信号,分别位于δ1.30(s,3H),δ1.01(s,3H)处,推测化合物3中的侧链还是通过醚键成环,只不过是在侧链环上多了1个羟基而已.通过与文献对比发现化合物3与(-)-(8S,11R)-11-hydroxysydowic acid的波谱数据一致[7],因而确定化合物3为(-)-(8S,11R)-11-hydroxysydowic acid.
化合物3的NMR数据:1H NMR(400 MHz,CD3OD-d4):δ7.26(d,8.1,1 H),7.48(dd,1.5,8.1,1H),7.38(d,1.5,1H),2.23(m,2H),2.00(m,1 H),1.79(m,1 H),3.43(m,1H),1.30(s,3H),1.01(s,3H),1.52(s,3H);13C NMR(100 MHz,CD3OD-d4):δ157.6(C),137.8(C),126.0(CH),122.1(CH),132.6(C),119.2(CH),170.1(C),78.8(C),29.7(CH2),25.2(CH2),71.6(CH),78.8(C),26.2(CH3),26.1(CH3),30.5(CH3).
化合物4为一无色油状物,易溶于甲醇、丙酮.紫外光谱显示在250和307 nm处有吸收.化合物4的高分辨质谱显示其在m/e[M+H]+=265.1440(Cacld.265.1440),[M+Na]+=287.1259(Cacld.287.1259),表明其分子式为C15H20O4,不饱和度为6,苯环和羧基满足5个不饱和度,说明化合物4中还有一个环存在.化合物4与化合物(-)-hydroxysydonic acid(1)氢谱和碳谱非常相似.化合物4中3个甲基信号分别位于δ1.47(s,3 H),1.28(s,3 H)和0.94(s,3H)处,而在化合物1中3个甲基分别位于δ1.60(s,3H),1.11(s,3H)和1.10(s,3 H);化合物4中的3个CH2分别位于δ2.51(m,1H)/1.68(m,1H),1.72(m,2 H)和1.54(m,2H)处,而在化合物1中同样的CH2位于δ1.96(m,1H)/1.80(m,1H),1.39(m,1 H)/1.28(m,1 H)和1.40(m,2 H)处;同样的其碳谱也是一样,低场的碳信号很相似,但是高场的碳信号是不一样的.
通过比较两者的分子量发现化合物4比化合物1的分子量少18,显然是少了1个水分子,因而推测,化合物4可能是化合物1分子内缩水产物,因为侧链上的2个羟基发生了分子内的缩水而形成1个六元环的醚环结构,因而其高场的氢信号发生较大的变化;通过ChemDraw简单计算化合物4的最低能量构象,表明化合物4中的苯环与六元醚环之间几乎是垂直的,如下图所示,恰好侧链末端2个甲基通过醚键环合后,有一个甲基伸向苯环中间,而另一个甲基向外.

图2 化合物4的最低能量构象图
根据核磁共振的环电流对基团化学位移的影响,苯环外围是去屏蔽区域,而靠近苯环中央是屏蔽区域,所以δ0.94的甲基信号位于苯环的屏蔽区域,δ1.28的甲基位于苯环去屏蔽区域,所以化合物4的甲基与化合物1的甲基化学位移相差比较大.通过查阅文献发现化合物4与sydowic acid[8]的波谱学数据一致,因而确定化合物8为sydowic acid.
化合物4的NMR数据:1H NMR(400 MHz,CD3OD-d4):δ7.48(dd,1.7,8.1,1 H),7.37(d,1.7,1H),7.23(d,8.1,1H),2.51(m,1H),1.72(m,2 H),1.68(m,1 H),1.54(m,2H),1.47(s,3H),1.28(s,3H),0.94(s,3H);13C NMR(100 MHz,CD3OD-d4):δ169.8(C),158.1(C),137.5(C),132.3(C),126.1(CH),122.0(CH),119.1(C),78.8(C),76.2(C),37.7(CH2),34.8(CH2),32.3(CH3),31.7(CH3),25.2(CH3),17.7(CH2).
化合物5为无色油状物,紫外光谱显示在247和301 nm处有吸收.熔点158~159℃,EI-MS谱中的m/z:[M]+266.一维1H-NMR(CD3OD,400 MHz)中显示10组峰,其中:δH7.45(dd,J=8.1,1.8 Hz,1H),δH7.41(d,J=1.9 Hz,1H),δH7.14(d,J=8.1 Hz,1H)为苯环上的3个氢信号;δH0.78(d,J=6.7 Hz,6 H)和δH1.59(s,3H)为3个甲基质子信号;δH1.81(dddd,J=35.7,13.7,11.4,4.9 Hz,2H),δH1.44(dq,J=13.2,6.7 Hz,1 H),δH1.30(s,1H),δH1.25(m,1H),δH1.09(m,2H)5组多重峰为3个亚甲基质子信号和1个叔氢信号.碳谱有明显的6个苯环碳信号和1个苯环上羧基信号δ:118.54,121.33,127.14,131.28,136.85,156.43,169.8.根据一维核磁谱推测化合物5是化合物1的类似物.通过查阅文献[9] 对比,发现化合物5与sydonic acid的波谱数据基本一致.1H-NMR(CD3OD,400 MHz):δH7.45(dd,J=8.1,1.8 Hz,1H),7.41(d,J=1.9 Hz,1H),7.14(d,J=8.1 Hz,1 H),1.81(dddd,J=13.7,11.4,Hz,2 H),1.44(dq,J=13.2,6.7 Hz,1H),1.30(s,1H),1.25(m,1H),1.09(m,2H),0.78(d,J=6.7 Hz,6H),1.59(s,3H);13C-NMR(CD3OD,100 MHz)δ:22.37(C-10),22.80(C-14),22.86(C-13),28.43(C-12),28.60(C-15),39.86(C-11),43.48(C-9),77.92(C-8),118.54(C-6),121.33(C-3),127.14(C-4),131.28(C-5),136.85(C-2),156.43(C-1),169.8(C-7).
化合物6为无色油状物,易溶于甲醇.其紫外光谱显示其在250和310 nm处有吸收.EI-MS谱中m/z:[M]+264,比化合物5分子量少2.一维1H-NMR图谱相比,化合物6在低场部分比化合物5少了一组甲基氢信号多了一组化学位移值较大的亚甲基氢信号:δH4.65(s,2 H),推测化合物6在侧链8号位或12号位有1个双键,且碳谱的低场区有明显的6个苯环碳信号和1个苯环上羧基信号和2个烯碳信号δ:113.13,120.10,122.36,123.59,125.64,138.93,139.70,157.51,167.44.两组甲基氢信号化学位移较大,δH分别为:2.20(s,3H),1.90(s,3H),推断双键在12号位.13C-NMR(CD3OD-d4,100 MHz)δ:18.38(C-10),22.35(C-13),24.20(C-15),40.02(C-11),44.50(C-9),79.02(C-8),113.13(C-14),120.10(C-6),122.36(C-3),123.59(C-4),125.64(C-2),138.93(C-5),139.70(C-12),157.51(C-1),167.44(C-7).通过查阅文献[6] ,发现化合物6与(S)-(+)-11-dehydrosydonic acid波谱数据一致.
化合物7为无色的油状物,一维1H-NMR(CD3OD-d4,400 MHz)与化合物5对比,发现高场部分的氢信号基本相同,0.82(d,J=6.7 Hz,6H),1.13(m,2 H),1.29(m,2 H),1.47(m,1 H),1.57(s,3H),1.92(m,2H),表示与化合物5有相同的侧链.4.58(s,2 H)是连有烯碳且连氧原子的氢信号,6.73(m,1H),6.79(d,J=1.8 Hz,1H),7.08(d,J=7.9 Hz,1 H)是苯环上的3个氢信号,结合13CNMR显示的15个碳信号,推测化合物7比化合物5少了1个苯环共轭羧基.13C-NMR(CD3OD-d4,100 MHz)δ:22.92(C-13),22.93(C-14),22.92(C-10),29.05(C-15),29.11(C-12),40.51(C-11),44.14(C-9),64.86(C-7),78.11(C-8),116.16(C-6),118.76(C-4),127.60(C-3),131.27(C-2),142.79(C-5),157.06(C-1).通过查阅文献[10] 对比发现化合物7与sydonol 1b的波谱数据基本一致.
化合物8为无色油状物,一维1H-NMR(CD3OD-d4,400 MHz)中显示出3个苯环氢质子信号:δH7.46(d,J=7.5 Hz,2 H),δH7.34(d,J=8.0 Hz,1H);1个甲基氢质子信号:δH1.78(s,3H);δH2.68(m,2 H),δH2.48(m,2 H)两组多重峰为2个亚甲基质子信号.13C-NMR(CD3OD-d4,100 MHz)共有12个碳信号δ:26.60(C-12),29.71(C-9),35.05(C-10),88.71(C-8),118.04(C-3),121.58(C-6),125.66(C-4),133.12(C-5),135.14(C-2),154.49(C-1),170.13(C-7),179.62(C-11).通过查阅文献[11] 对比发现化合物8与1-hydroxyboivinianic acid的波谱数据基本一致.
2.2 化合物1的含量测定
1)仪器精密度实验.5次进样测定1 mg/m L标准品的峰面积依次为:8546806,8469320,8469320,8697596,8369344.经计算其RSD=1.5%,表明仪器精密度良好.

图3 粗提物浸膏和化合物1的HPLC分析图谱
2)绘制标准曲线.标准品浓度X与标准品吸收峰面积Y之间的回归方程:Y=9×106X+244 055,r=0.999 3.化合物1质量浓度在0.5~2.5 mg/m L内与峰面积呈良好的线性关系.
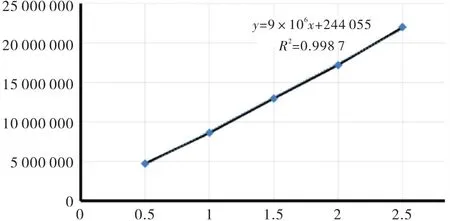
图4 化合物1的含量测定标准曲线
3)稳定性试验.取5 mg/m L粗提物溶液在0 h、2 h、4 h、6 h、8 h重复进样测量的峰面积分别为:5281021,5313669,5366448,5415220,5547225.RSD值为1.9%,确认样品溶液在8 h内是基本稳定的.
4)重复性实验.取5份8 mg/m L的粗提物溶液分别进样,其吸收峰面积分别为:8330197,8581113,8385639,8470685,8576934.RSD值为1.3%,确认此测定方法具有良好的重复性.
5)加样回收试验.取质量浓度为8 mg/m L粗提物200μL,分3批加入200μL 0.8,0.9,1.0 mg/m L标准容易,分别进样检测器峰面积,计算其回收率分别为102%,102.5及99%,平均回收率为101%,RSD值为1.9%,表明该测量方法的可信度较高.
6)化合物1的含量计算.8 mg/m L粗提物溶液的平均峰面积为8470685,代入上述回归方程:Y=9×106X+244055,算得化合物1的浓度为0.91 mg/m L,因而算得化合物1在粗提物中的含量为11.4%.
3 结 论
从植物杜英叶片内生真菌Aspergillusversicolor的固体培养基中分离得到8个次级代谢产物,经核磁共振,质谱等光谱学方法鉴定其结构,分别为(-)-hydroxysydonic acid(1),12-acetoxysydonic acid(2),10-hydroxysydowic acid(3),sydowic acid(4),sydonic acid(5),(S)-(+)-11-dehydrosydonic acid(6),sydonol 1b(7),(R)-hydroxyboivinianic acid(8).化合物1-8中,化合物1的量最大,通过HPLC测定了(-)-hydroxysydonic acid(1)的含量,在固体培养条件下其含量达11.4%.Sydonic acid衍生物实际上为倍半萜类化合物,是没药烷型倍半萜类结构中唯一含苯环的天然产物.从2010年至今,此类化合物的结构已经从自然界中分离得到40余个,其结构变化主要在羧基,酚羟基,侧链上的羟基位置的变化及羟基与双键的之间的转化等的变化.文献报道该此类没药烷型结构主要是抗病毒,抗菌等活性[11-12].在这些化合物中化合物的含量达11.4%,在实验室中纯度达98%的化合物1的量已经累计至8 g,为进一步的开发以化合物1为母核结构的活性先导化合物的应用提供了物质保障.
