溶解氧对HLB-MR反应器内有机物的生物絮凝影响
2019-08-28万立国张丽君张文华刘红波龙北生
万立国,林 巧,张丽君,张文华*,刘红波,龙北生,熊 玲
溶解氧对HLB-MR反应器内有机物的生物絮凝影响
万立国1,2,林 巧1,张丽君1,张文华1,2*,刘红波1,2,龙北生1,2,熊 玲1
(1.长春工程学院水利与环境工程学院,吉林 长春 130012;2.长春工程学院,吉林省城市污水处理重点实验室,吉林 长春 130012)
为了研究溶解氧(DO)对高负荷生物絮凝-膜反应器(HLB-MR)内有机物生物絮凝规律的影响,采用平行对比实验,考察了不同DO条件下反应器内有机物的生物絮凝效果、胞外聚合物(EPS)含量、金属阳离子浓度和微生物群落结构.结果表明:DO浓度分别为1~2mg/L和6~8mg/L时, HLB-MR反应器的絮凝效率分别为83%和89%,两反应器内上清液的浊度差别也进一步证实,较高的DO浓度下,反应器的生物絮凝效果更好.DO浓度在6~8mg/L时,HLB-MR反应器内结合态EPS和自由态EPS的含量分别为15.64mg /(g•VSS)和8.71mg/L,两者均显著高于DO为1~2mg/L时的11.83mg /(g•VSS)和6.56mg/L,反应器浓缩液中镁和铝的浓度也均明显高于低DO浓度时所对应的值,这说明在高DO条件下,有更多的EPS与金属阳离子结合而固定在污泥基质中,促进了生物絮凝.高通量测序表明,DO浓度分别为1~2mg/L和6~8mg/L时,HLB-MR反应器内细菌的群落结构差异明显,高DO浓度反应器底泥中Actinobacteria和Saccharibacteria的相对丰度较高,可能对生物絮凝有促进作用.
膜反应器;生物絮凝;溶解氧;胞外聚合物;金属阳离子;微生物群落
随着人口的快速增长和城镇化水平的不断提高,城市污水的产生量急剧增加.城市污水中蕴含大量的能源,据报道每m3城市污水中通常含有1.9kWh的有机化学能[1],然而城市污水中有机物的浓度较低,难以直接实现其经济高效能源化,城市污水中有机物的高效浓缩富集技术成为了保障污水有机能源经济回收的关键[2-3].一般城市污水中约70%的有机物以悬浮或胶体形态存在,因而膜分离浓缩污水中有机物的方法受到很多研究者的青睐,但直接膜过滤城市污水存在膜污染严重和膜通量急剧下降的问题[4-5],本研究构建了高负荷生物絮凝-膜反应器(HLB-MR),其理念为在膜分离浓缩污水中的有机物时,利用微生物产生的胞外聚合物生物絮凝污水中的悬浮和胶体物质,降低膜污染,保证工艺的稳定性.生物絮凝对HLB-MR反应器回收污水中有机物、缓解膜污染和降低整个系统的运行能耗均有重要影响.溶解氧(DO)是微生物与底物反应的重要生化参数,对微生物的活性、菌胶团的形成以及污泥絮体特性都有重要的影响,是反应器内有机物生物絮凝过程的重要控制参数,但关于DO对高负荷膜反应器内生物絮凝影响的研究报道较少,本研究采用中空纤维超滤膜反应器,以中国北方实际的城市污水为处理对象,对比分析了HLB-MR反应器在1~2mg/L和6~8mg/L 2个DO浓度条件下的生物絮凝效果,并对2反应器内浓缩液的胞外聚合物(EPS)浓度、絮体粒径分布、有关金属阳离子浓度和微生物种群结构进行了检测和对比分析,以期阐明DO对这种新型结构的HLB-MR反应器生物絮凝的影响及机制,为将来该技术的实际应用提供理论支撑.
1 材料与方法
1.1 实验装置与运行
实验装置如图1所示,实验过程中控制2组相同HLB-MR反应器的DO浓度分别为1~2mg/L和6~8mg/L,分别记为LDO反应器和HDO反应器,并保持2个反应器在20℃平行运行.实验中选择1~ 2mg/L的DO浓度是认为该浓度对微生物的有氧生长还没有限制,考察是否存在降低HLB-MR反应器运行能耗的可能性;选择6~8mg/L相对高的DO浓度是避免在污泥絮体中产生厌氧区域,排除厌氧对生物絮凝的抑制作用.每组HLB-MR反应器的容积为1.87L,内配备1束中空纤维膜组件(天津膜天膜科技股份有限公司,聚偏氟乙烯(PVDF)),膜面积为0.28m2,膜孔径为0.03μm,扣除膜组件所占的体积后反应器的有效容积为1.70L.HDO反应器完全采用空气曝气,用气体流量计调节曝气流量DO浓度为6~8mg/L.LDO反应器采用氮气和空气混合气体曝气,通过调整混合比例使反应器内的溶解氧浓度为1~2mg/L,为了保证2个反应器的气体剪切力相同, LDO反应器混合气体流量与HDO反应器的空气流量相同. 2个反应器均采用蠕动泵抽吸的方式出水,时间继电器控制蠕动泵每抽吸8min,停止2min,蠕动泵采用恒通量模式运行,通过控制出水通量保证2个反应器的水力停留时间(HRT)为1h,通过蠕动泵控制浓缩液排出量保证2个反应器的污泥停留时间(SRT)为0.6d.
实验原水取自吉林省长春市某城市污水处理厂的沉砂池出水,每次取来的污水在4℃下储存且最多不超过3d,在进原水箱之前将污水通过3mm孔径的筛网过滤并将其温度调至室温(20℃左右).
1.2 样品与分析
反应器通常在运行3倍的SRT时长后才会趋于稳定,本研究中2个反应器平行运行了15d,分别在第13、14、15d对反应器进水、浓缩液和出水进行取样分析, 每个样品取3个平行.
在对样品COD进行检测时,将其分级为4类,即总COD(CODTO)、悬浮COD(CODSS)、胶体COD(CODCO)、溶解COD(CODSO).CODTO为样品直接测定的COD,CODSS为CODTO与样品经过滤纸(12~25μm)过滤后滤液的COD之差,CODCO为滤纸过滤后滤液的COD与滤液经滤膜(0.45μm)过滤后的COD之差,CODSO为滤膜(0.45μm)过滤后所得滤液的COD.COD参照标准方法[6]测定.
EPS测定:取30mL的反应器浓缩液置于离心管中,在离心力12000×g下离心5min,然后将上清液通过0.45μm滤膜过滤,所得滤液测定的EPS即为自由态EPS.用纯水将离心管中剩余污泥重新定容至原体积,混匀后置于80℃水浴30min,待离心管冷却后再次于离心力12000×g下离心5min,将上清液通过0.45μm的滤膜,所得滤液测得的EPS即为结合态EPS.对自由态EPS和结合态EPS中的蛋白质和多糖进行测定,EPS-蛋白质采用改进的Lowry法测定[7],EPS多糖采用蒽酮比色法测定[8].
金属离子测定:浓缩液样品经30min沉淀后取其上清液,上清液经过0.45μm滤膜过滤后,利用ICP-OES(Perkin Elmer,Optima 5300DV)测量金属离子(镁、钙、铝).一定量的浓缩液沉淀物经冷冻干燥后,取已知重量的冻干固体至聚四氟乙烯管中,加入10mL 65% HNO3并置于石墨消解仪(SCP,DigiPREP MS)上在180℃条件下消解45min,去酸,使剩余液体积约1mL,冷却至室温后用2% HNO3淋洗,过滤后定容至50mL,并利用ICP-OES(Perkin Elmer,Optima 5300DV)测量金属离子(镁、钙、铝).
浓缩液沉淀30min后收集上清液,采用浊度仪(HACH,2100Q)测定其浊度.采用溶解氧仪(WTW, OXI 3310-SET1)测定两反应器内的DO浓度.采用激光粒度粒形分析仪(EyeTech)测量浓缩液样品的絮体粒径,其测量结果以个数粒度分布的数据形式记录.
在反应器运行第15d时,对2个反应器内的浓缩液和进水进行取样,为了保证反应器内浓缩液取样的代表性,取样时将膜组件拿出反应器,将反应器内的浓缩液充分混匀后取出浓缩液,对浓缩液进行30min的沉淀分离,分别取上清液和底泥与进水一起进行DNA提取及高通量测序.利用 DNA 提取试剂盒 Fast DNA Spin Kit for Soil(QBIOgen Inc.,Carlsba, CA,美国)提取样品的总DNA.采用338F(ACTC CTAC GGGA GGCA GCAG)和806R (5'-GGAC TACH VGGG TWTC TAAT-3')引物对样品进行V3和V4区16S rRNA基因扩增[9],采用20 μL的PCR扩增体系,配置如下:5×FastPfu Buffer,4μL、2.5mM dNTPs,2μL、Forward Primer(5µM),0.8μL、Reverse Primer (5µM),0.8μL、FastPfu Polymerase,0.4μL、BSA,0.2μL、样品DNA,10ng并用ddH2O补齐至20μL.在PCR仪(ABI GeneAmp® 9700型)中的反应条件为:95℃预加热3min,随后进行30周期扩增反应(95℃变性30s,55℃退火30s,72℃延伸45s,72℃延伸10min,72℃直至终止).DNA 扩增样品送上海某生物技术公司采用 Illumina MiSeq 测序仪测序,通过序列比对和数据统计,分析细菌在门水平上的相对丰度.
2 结果与讨论
2.1 生物絮凝效果
如表1和图2所示.进水中CODSS和CODCO百分比分别为73.5%和13.7%,LDO和HDO反应器浓缩液中它们的比例分别为94.9%和3.2%,96.7%和1.8%.而对CODSO而言,它在进水、LDO和HDO反应器浓缩液中比例分别为12.8%、1.9%和1.5%.基于CODCO在进水中和浓缩液中的质量负荷所计算出的LDO和HDO反应器的絮凝效率分别为83%和89%.由此可见,在2个反应器中,有大量的CODCO转化为CODSS.相比LDO反应器,HDO反应器内这种生物絮凝程度较高、絮凝效果较好.LDO和HDO两反应器内浓缩液沉淀的上清液的浊度分别为32NTU和27NTU,HDO反应器上清液中较低的浊度值也证实了在该反应器中生物絮凝效果较好.
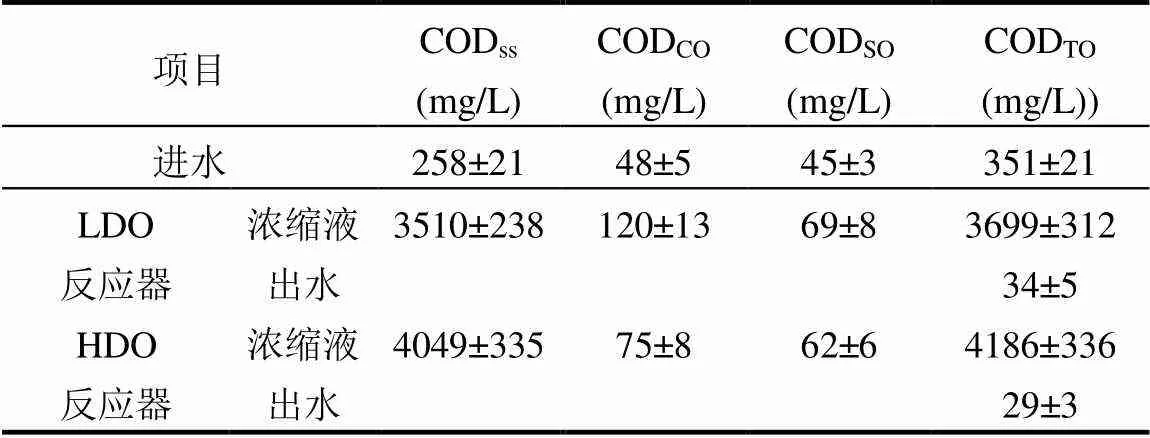
表1 进水、浓缩液和出水中各分类COD浓度
LDO和HDO 2个反应器内浓缩液中颗粒的个数浓度均为2.2×105/mL,两反应器内浓缩液中不同粒径范围的颗粒所占百分比如图3所示.HDO反应器中浓缩液所含的0~1μm区间段的颗粒百分比为26.2%,明显高于LDO反应器中所对应区间段的值(19.0%),但在1~10μm和10~30μm 2个区间段, HDO反应器中浓缩液所含的颗粒百分比分别为58.4%和14.3%,均低于LDO反应器中所对应区间段的值(64.4%和15.6%).两反应器内浓缩液中30~100μm区间段的粒径数量均较少,而且它们所占百分比在两反应器中差别不大.相对LDO反应器而言,HDO反应器内浓缩液中0~1μm区间段的颗粒比例较高,而10~30μm区间段的颗粒比例较低.这可能因为过高的DO浓度条件下HLB-MR产生了解絮凝效应,导致反应器内浓缩液中较大颗粒解体为更加细小的颗粒,从而出现细小颗粒的比例增大的现象.DO是影响污泥絮体性质的重要参数,已有相关学者进行了大量研究[10-12],但关于5mg/L以上的DO浓度对污泥絮体大小的影响机制尚不十分清楚,需要进一步研究.

图2 不同DO下反应器内各类COD比例及絮凝效率

图3 2反应器浓缩液浓中不同粒径范围的颗粒占比
关于DO对絮凝效率的影响,Faust等[13]报道了类似的结果,高负荷膜生物反应器在DO浓度为4mg /L时的絮凝效率为92%,明显高于DO浓度为1mg/ L时的69%.与本研究不同的是,DO浓度为6~8mg/L和1~2mg/L条件时,HLB-MR反应器的絮凝效率差别不明显,且均在80%以上.但其所报道的DO对反应器内浓缩液颗粒尺寸大小分布的影响与本研究呈相反的规律,这可能由于进水水质和反应器结构形式不同所致.低DO浓度下活性污泥系统有机物絮凝效果较差的原因文献提供了以下几种解释:1)在低DO浓度下有氧活性的降低可能导致了作用于生物絮凝的EPS的产生速率降低或者在厌氧条件下降解的速率加快[14-16],2)低DO浓度水平下微生物能将Fe3+还原成Fe2+而出现反絮凝现象,因为Fe3+与微生物胞外聚合物之间能产生比Fe2+更强的阳离子架桥作用[17-18],3)低DO浓度条件下开始过度生长的丝状细菌对絮凝产生了的负面作用[19].鉴于上述报道中所控制的DO浓度水平不尽相同而且相关的环境因子(例如污泥浓度、温度、pH值和底物成分)不同,导致最佳的DO浓度控制范围也仅能只做参考,而在未经刻意污泥接种的HLB-MR反应器内,在极短的SRT和HRT条件下,DO浓度对生物絮凝过程的影响机制是否与上述相同尚需进一步研究.
2.2 EPS与金属阳离子浓度
浓缩液沉淀部分和上清部分的EPS分别被称为结合态EPS和自由态EPS,总EPS由EPS-蛋白质和EPS-多糖两部分组成.如图4所示, LDO反应器内的总EPS有77.0%以结合态形式存在,23.0% 以自由态形式存在;而HDO反应器内的总EPS有79.9%以结合态形式存在,20.1% 以自由态形式存在.可见2个反应器中,结合态EPS的含量比自由态EPS含量高3倍以上,为总EPS的主要存在形态.文献报道污水中颗粒的生物絮凝主要缘于微生物分泌出的EPS[20],由于EPS的粘性作用,它可以在颗粒间形成互连的基质[21].沉淀中结合态EPS含量较高,这正好能解释LDO和HDO反应器均发生了较广泛的生物絮凝.HDO反应器结合态EPS和自由态EPS的含量分别为15.64mg/(g·VSS)和8.71mg/L,两者均显著高于LDO反应器内所对应含量(11.83mg /(g·VSS)和6.56mg/L),这表明较高DO浓度下,HLB-MR内产生了更多的EPS.有研究报道EPS的功能基团,如氨基,羧基和磷酸基团,有助于絮凝污水颗粒和保持絮凝体的稳定性[22-23].LDO和HDO两反应器内自由态EPS中只存在EPS-多糖,没有EPS-蛋白质,而两反应器在结合态EPS中EPS-蛋白质的含量分别为12.3%和19.0%,均远小于50%,这表明EPS-蛋白质含量低于EPS-多糖的含量,而且主要存在污泥基质中.然而,一些研究文献却报道EPS-蛋白质是污泥和生物膜中总EPS的主要成分[24-25],这可能是由于实验水质和EPS提取方法的不同导致了不同的结论.
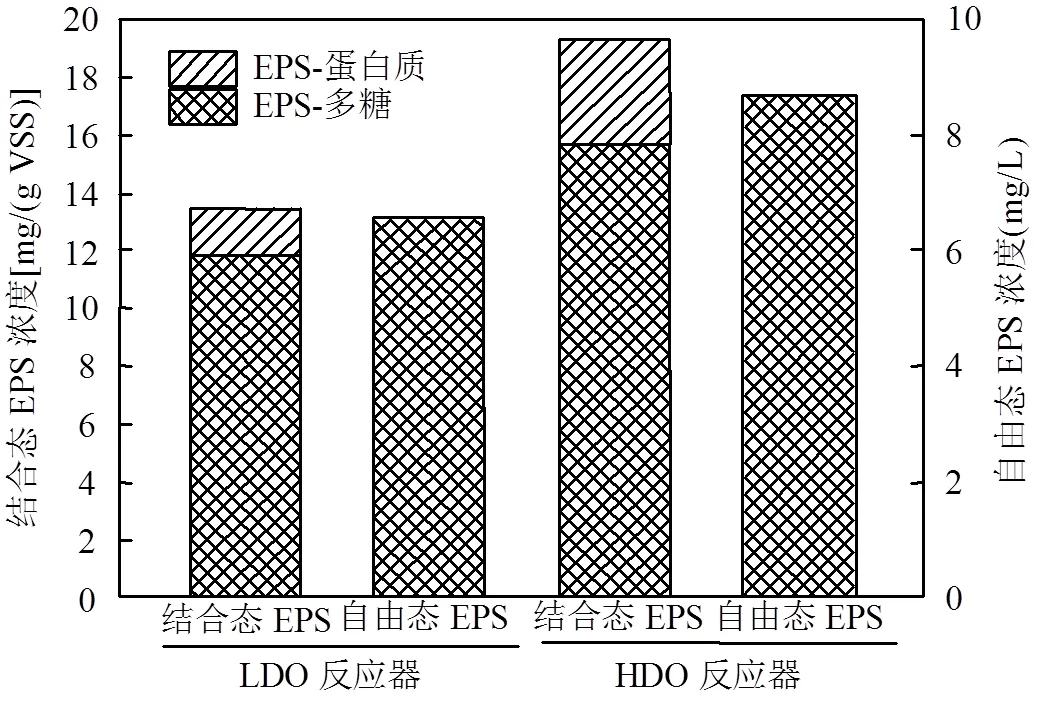
图4 2个反应器浓缩液结合态和自由态EPS含量及所含多糖和蛋白浓度
表2给出了多价金属阳离子Ca2+, Mg2+和Al3+在浓缩液沉淀物和上清液中的浓度.在浓缩液沉淀物中,钙的浓度最高,其次是铝和镁,钙和铝的浓度超过镁浓度的2倍.这3种阳离子,在浓缩液沉淀物中,HDO反应器中的镁和铝的浓度均明显高于LDO反应器中的浓度,钙的浓度两者相差不大;而在上清液中,镁的含量极低而且两反应器中浓度差别极小,而钙和铝在HDO反应器中的浓度均明显低于LDO反应器中的浓度.这些数据表明,与LDO反应器相比,HDO反应器中有更多的阳离子分配到浓缩液的固体中,这与HDO反应器有更高的结合态EPS浓度的结果相一致,这可能因为多价金属阳离子与EPS之间形成了桥连作用并嵌入到了浓缩液的污泥基质中,常用双电层相互作用理论、离子架桥理论和藻朊酸盐理论来解释其促进生物絮凝的机理[26-27].多价金属离子对生物絮凝的促进作用已被研究者广泛证明, jin等[28]通过对7个污水处理厂进行研究,发现金属阳离子浓度的提高能改善污泥的沉降性和可压缩性,Wen 等[29]报道Al3+浓度的增加能提高活性污泥的絮凝效果,Bruus等[30]发现Ca2+的排出导致了活性污泥絮凝体的分散.本研究上清液中钙、镁和铝的浓度数据还说明:镁和钙离子与固相污泥基质结合较紧密,不易从沉淀中分离进入上清液,而铝离子则较易分配至上清液中,这可能与铝离子絮凝形成的沉淀物容易受环境因素比如pH值、剪切力等的影响有关.
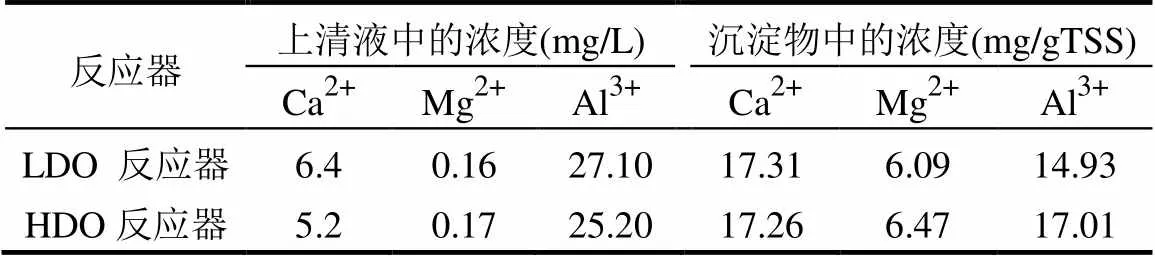
表2 HLB-MRs内浓缩液沉淀物和上清液中Ca2+、Mg2+和 Al3+的浓度
2.3 微生物群落结构特性
对进水(Wastewater)、LDO反应器上清液(LDO- S)、HDO反应器上清液(HDO-S)、LDO反应器底泥(LDO-R)、HDO反应器底泥(HDO-R)共5个样品进行了高通量测序分析.5个样品中不同门水平细菌的相对丰度如图5所示,图中相对丰度低于1%的菌群合并为others.由图5可知,DO浓度的不同导致了2个HLB-MR反应器内上清液和底泥中细菌的群落结构出现了差异.Proteobacteria在所有样品(进水、底泥和上清液)中均为优势菌群,该现象与之前一些文献报道一致[31-32].Proteobacteria在LDO-S和HDO-S样品中相对丰度分别为49.6%和49.1%,在LDO-R和HDO-R样品中的相对丰度分别为38.9%和32.8%.当DO浓度升高时,上清液中Proteobacteria的相对丰度几乎无变化,仅降低了0.5%,而底泥中Proteobacteria的相对丰度则变化显著,降低了6.1%,说明随着DO浓度的升高,污泥相中的其他种类微生物开始竞争生长,Proteobacteria的相对丰度有所降低,而其在上清液中维持较高的相对丰度,说明Proteobacteria容易呈现为游离状态或者较易从污泥絮体或聚集体中脱离.
在上清液样品LDO-S和HDO-S中, Actinobacteria的相对丰度分别为6.14%和4.84%,而在底泥样品LDO-R和HDO-R中,其相对丰度分别为14.47%和21.08%.在上清液中相对丰度明显小于其在底泥中的相对丰度,这说明Actinobacteria更有可能形成污泥絮体或粘附在已经形成的絮体上.随着DO浓度的升高,Actinobacteria在反应器底泥中的相对丰度增加,可能对有机物的生物絮凝有促进作用.这与Agunbiade等[33]的研究相吻合,他们指出Actinobacteria能促进生物絮凝,可以用其制备经济廉价的生物絮凝剂.Saccharibacteria在上清液和底泥样品中的相对丰度则呈现出与Actinobacteria相反的现象,在上清液样品LDO-S和HDO-S中, Saccharibacteria的相对丰度分别为14.49%和17.87%,而在底泥样品LDO-R和HDO-R中其相对丰度分别为3.99%和4.77%,这说明Saccharibacteria大部分呈现游离状态或者较易从污泥絮体脱离.但随着DO浓度的升高,HLB-MR反应器内Saccharibacteria相对丰度明显增大,这可能也对有机物的生物絮凝有积极作用,其相关机制需进一步研究.

图5 5个样品中细菌在门水平的相对丰度分布
3 结论
3.1 DO浓度在1~2mg/L和6~8mg/L时, HLB-MR反应器的絮凝效率分别为83%和89%, DO浓度越高,生物絮凝效果越显著.
3.2 DO浓度在6~8mg/L时,HLB-MR反应器中结合态和自由态EPS的含量、浓缩液中的镁和铝的浓度均显著高于低DO浓度所对应的值,高DO条件下,有更多的金属阳离子与EPS结合固定在污泥基质中,促进了生物絮凝过程.
3.3 DO浓度的不同导致HLB-MR反应器内细菌的群落结构出现了差异,随着DO的提高, Actinobacteria和Saccharibacteria在反应器底泥中的相对丰度增加,可能对生物絮凝有促进作用.
[1] Mccarty P L, Bae J, Kim J. Domestic wastewater treatment as a net energy producer--can this be achieved? [J]. Environmental Science and Technology, 2011,45(17):7100-7106.
[2] 万立国,林 巧,张文华,等.HLB-MR反应器直接处理城市污水及回收有机物 [J]. 中国环境科学, 2019,39(4):1596-1601. WAN Li-guo, LIN Qiao, ZHANG Wen-hua, et al. Direct treatment and organics recovery of municipal wastewater via high loaded bioflocculation membrane reactor [J].China Environmental Science, 2019,39(4):1596-1601.
[3] Guven H, Dereli R K, Ozgun H, et al. Towards sustainable and energy efficient municipal wastewater treatment by up-concentration of organics [J]. Progress in Energy and Combustion Science, 2019,70: 145-168.
[4] Yamamura H, Okimoto K, Kimura K, et al. Hydrophilic fraction of natural organic matter causing irreversible fouling of microfiltration and ultrafiltration membranes [J]. Water Research, 2014,54:123-136.
[5] Huang H, Lee N, Young T, et al. Natural organic matter fouling of low-pressure, hollow-fiber membranes: Effects of NOM source and hydrodynamic conditions [J]. Water Research, 2007,41(17):3823- 3832.
[6] 国家环境保护总局.水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社, 2002:200-284. State environmental protection administration of china. Monitoring and analytic methods of water and wastewater [M]. 4th ed. Beijing: Environmental Science Press of China, 2002:200-284.
[7] Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent. [J]. Journal of Biological Chemistry, 1951,193(1):265-275.
[8] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric Method for Determination of Sugars and Related Substances [J]. Analytical Chemistry, 1956,28(3):350-356.
[9] Dennis K L, Wang Y, Blatner N R, et al. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10-producing T cells. [J]. Cancer Research, 2013,73(19):5905- 5913.
[10] BrittMarie Wilén. The effect of dissolved oxygen concentration on the structure, size and size distribution of activated sludge [J]. Water Research, 1999,33(2):391-400.
[11] Zhang Y, Allen D G. Strategies for minimizing deflocculation of biosolids due to oxygen disturbances [J]. Water Science and Technology, 2007,55(6):173-180.
[12] Suresh A, Grygolowiczpawlak E, Pathak S, et al. Understanding and optimization of the flocculation process in biological wastewater treatment processes: Areview [J]. Chemosphere, 2018,210:401-416.
[13] Faust L, Temmink H, Zwijnenburg A, et al. Effect of dissolved oxygen concentration on the bioflocculation process in high loaded MBRs [J]. Water Research, 2014,66:199-207.
[14] Rasmussen H, Bruus J H, Keiding K, et al. Observations on dewaterability and physical, chemical and microbiological changes in anaerobically stored activated sludge from a nutrient removal plant [J]. Water Research, 1994,28(2):417-425.
[15] Starkey J E, Karr P R. Effect of Low Dissolved Oxygen Concentration on Effluent Turbidity [J]. Journal - Water Pollution Control Federation, 1984,56(7):837-843.
[16] Wilén B M, Nielsen J L, Keiding K, et al. Influence of microbial activity on the stability of activated sludge flocs [J]. Colloids & Surfaces B Biointerfaces, 2000,18(2):145-156.
[17] Caccavo F, Frolund B, Van Ommen K F, et al. Deflocculation of Activated Sludge by the Dissimilatory Fe(III)-Reducing Bacterium Shewanella alga BrY. [J]. Applied & Environmental Microbiology, 1996,62(4):1487-1490.
[18] Rasmussen H, Nielsen P H. Iron reduction in activated sludge measured with different extraction techniques [J]. Water Research, 1996,30(3):551-558.
[19] Wilén B M, Balmér P. The effect of dissolved oxygen concentration on the structure, size and size distribution of activated sludge flocs [J]. Water Research, 1999,33(2):391-400.
[20] Salehizadeh H, Shojaosadati S A. Extracellular biopolymeric flocculants. Recent trends and biotechnological importance [J]. Biotechnology Advances, 2001,19(5):371-385.
[21] Fang H H P, Jia X S. Extraction of extracellular polymer from anaerobic sludges [J]. Biotechnology Techniques, 1996,10(11):803- 808.
[22] Eriksson L, Alm B. Study of flocculation mechanisms by observing effects of a complexing agent on activated sludge properties [J]. Water Science and Technology, 1991,24(7):21-28.
[23] Liao B Q, Allen D G, Leppard G G, et al. Interparticle interactions affecting the stability of sludge flocs [J]. Journal of colloid and interface science, 2002,249(2):372-380.
[24] Urbain V, Block J C, Manem J. Bioflocculation in activated sludge: an analytic approach [J]. Water Research, 2011,27(5):829-838.
[25] Wilén B M, Jin B, Lant P. The influence of key chemical constituents in activated sludge on surface and flocculating properties [J]. Water Research, 2003,37(9):2127-2139.
[26] Liu X M, Sheng G P, Yu H Q. DLVO approach to the flocculability of a photosynthetic H2-producing bacterium, Rhodopseudomonas acidophila [J]. Environmental Science & Technology, 2007,41(13): 4620-4625.
[27] Sobeck D C, Higgins M J. Examination of three theories for mechanisms of cation-induced bioflocculation [J]. Water Research, 2002,36(3):527-538.
[28] Park C. Cations and activated sludge floc structure [D]. Blacksburg: Virginia Tech, 2002.
[29] Wen Y, Zheng W, Yang Y, et al. Influence of Al3+addition on the flocculation and sedimentation of activated sludge: Comparison of single and multiple dosing patterns. [J]. Water Research, 2015,75:201- 209.
[30] Bruus J H, Nielsen P H, Keiding K. On the stability of activated sludge flocs with implications to dewatering [J]. Water Research, 1992, 26(12):1597-1604.
[31] Zhang T, Shao M F, Ye L. 454Pyrosequencing reveals bacterial diversity of activated sludge from 14sewage treatment plants [J]. Isme Journal, 2012,6(6):1137–1147.
[32] Hu M, Wang X, Wen X, et al. Microbial community structures in different wastewater treatment plants as revealed by 454- pyrosequencing analysis [J]. Bioresource technology, 2012,117:72-79.
[33] Agunbiade M, Pohl C, Ashafa A. A Review of the Application of Biofloccualnts in Wastewater Treatment [J]. Polish Journal of Environmental Studies, 2016,25(4):1381–1389.
Effect of dissolved oxygen on bioflocculation of organic matter in high loaded bioflocculation membrane reactor.
WAN Li-guo1,2, LIN Qiao1, ZHANG Li-jun1, ZHANG Wen-hua1,2*, LIU Hong-bo1,2, LONG Bei-sheng1,2, XIONG Ling1
(1.School of Water Conservancy & Environment Engineering, Changchun Institute of Technology, Changchun 130012, China;2.Jilin Provincial Key Laboratory of Municipal Wastewater Treatment, Changchun Institute of Technology, Changchun 130012, China)., 2019,39(8):3340~3346
In order to study the effect of dissolved oxygen (DO) on bioflocculation law of organic matter in high loaded bioflocculation membrane reactor (HLB-MR), parallel contrast experiments were conducted to investigate the bioflocculation effect of organic matter, the content of extracellular polymeric substance (EPS), the concentration of metal cations and the microbial community structure under different DO conditions. When the DO concentrations were at 1~2mg/L and 6~8mg/L, the flocculation efficiencies of HLB-MRs were 83% and 89%, respectively. The difference in turbidity of the supernatant in the HLB-MRs further confirmed that the higher DO concentration had induced a better bioflocculation effect. When the DO concentration was at 6~8mg/L, the content of bound EPS and supernatant EPS in the HLB-MR were 15.64mg/(g×VSS) and 8.71mg/L, respectively, both of which were significantly higher than 11.83mg/(g×VSS) and 6.56mg/L at 1~2mg/L of DO concentration, and the concentrations of magnesium and aluminum in the concentrate in the HLB-MR were also significantly higher than those at 1~2mg/L of DO concentration. Under high DO concentration conditions, more EPS are combined with metal cations to be immobilized in the sludge matrix, which promotes bioflocculation.High-throughput sequencing showed that when the DO concentrations were at 1~2mg/L and 6~8mg/L, the community structure of bacteria in the HLB-MRs were significantly different. The relative abundance of Actinobacteria and Saccharibacteria in the sediment of HLB-MR at higher DO concentration were higher, which might promote bioflocculation.
membrane reactor;bioflocculation;dissolved oxygen;extracellular polymeric substance;metal cation;microbial community
X703.1
A
1000-6923(2019)08-3340-07
万立国(1982-),男,湖北天门人,副教授,硕士,主要从事污水处理及其资源化研究.发表论文25篇.
2019-01-19
吉林省自然科学基金资助项目(20180101317JC);吉林省省级产业创新专项资金资助项目(2019C055);国家科技重大专项(2012ZX07202-009-01);吉林省重点科技攻关项目(20160204006SF);长春工程学院种子基金资助项目(320180027)
* 责任作者, 教授, wenhuazhang1029@163.com
