近红外二区成像载药脂质体的制备、体外成像及抗肿瘤活性
2019-08-28王紫安蒋逸飞
王紫安,刘 洋,王 鹏,蒋逸飞,吉 民*
(1东南大学生物科学与医学工程学院,南京210096;2中国药科大学工学院,南京211198)
肿瘤是人类医学发展史上的巨大挑战,随着纳米技术的发展,纳米医药技术被认为在实现肿瘤的高效和个性化治疗上具有极大的优势[1-3]。但迄今为止,纳米药物的临床转化仍然面临许多挑战,包括纳米颗粒的生物相容性,临床结果与动物模型实验的巨大差异和肿瘤的多药耐药性等。即使已经进入临床阶段的纳米药物也被发现更多的是降低药物不良反应而非增强治疗效果[4]。由于人体生理环境复杂,纳米药物的靶向递送低于预期设计[5]。研究人员指出通过被动靶向递送药物时,纳米颗粒从血管渗漏的速度很慢,药物在积累达到治疗水平所需浓度前排泄或代谢[6]。因此,有必要对纳米药物的体内行为进行监控,以便掌握药物分布和疗效的实时信息,从而以受控和合理的方式调整治疗策略,改善治疗效果。
近年来,基于不同成像方式与治疗方法的组合迅速发展[7]。将成像剂与治疗药物共载于同一纳米平台,能够对纳米药物的体内递送、生物分布、代谢过程进行原位实时监控。相较于PET、CT以及MRI等成像方式,荧光成像具有高灵敏度、高时间分辨率和无放射性污染等优点,更重要的是由于荧光成像的操作简便及成像设备的便携可移动,相较于其他成像方式,荧光成像具备辅助临床手术中的优势[8]。近几年近红外二区(NIR-II:1 000~1 700 nm)成像技术迅速发展。通过减少光子散射、光吸收和自发荧光,NIR-II探针提供更高穿透率和分辨率的成像[9]。当前,NIR-II荧光成像技术已应用于脑成像、血管成像、肿瘤成像等多个领域,并显示出比近红外一区更佳的成像效果。
目前,已有多种NIR-II探针见于报道,包括镧系元素(Ln)掺杂纳米结构(LDNCs)、单壁碳纳米管(SWCNT)、红外量子点(QD)、共聚物及有机小分子染料等。其中大多数NIR-II探针属于无机纳米材料,体内代谢缓慢,可能导致长期毒性[8]。相比之下,基于小分子荧光团的造影剂具有良好的排泄药代动力学和最小的细胞毒性,这将有助于加速FDA批准和NIR-II成像的临床转化[8]。目前临床上批准的NIR荧光团,吲哚菁绿(ICG)和亚甲蓝(MB)都是小分子染料[10]。
IR-1061是一种水不溶性多甲川NIR-II探针,由于其高度疏水,IR1061无法直接应用于人体[11]。阿霉素(DOX)作为一种广谱抗肿瘤药物广泛用于各种恶性肿瘤的化疗。同时DOX具有可以通过激光共聚焦显微镜分析的荧光,适合作为药物模型分析其细胞摄取。脂质体由磷脂双层和水核组成,具有两亲性,在表面改性,生物相容性和生物降解等多个方面具有优势[12]。因此,可以利用脂质体实现IR1061与阿霉素的共载。此外,研究表明与常见于应用的带负电荷脂质体不同,十八胺阳离子脂质体能够与肿瘤细胞表面外翻的磷脂酰丝氨酸(PS)以强亲和力和直接相互作用,表现出增强的细胞摄取,从而增强药物抗肿瘤作用[13]。
因此,本研究以IR1061作为成像剂,阿霉素作为治疗剂,制备DOX-IR1061阳离子脂质体,实现NIR-II成像与乳腺癌治疗的双重目标。其中,疏水性的IR1061装载于脂质体磷脂膜,在980 nm激发下可用于NIR-II成像;水溶性的DOX装载于脂质体水核,用于乳腺癌治疗。本研究还利用脂溶性荧光染料香豆素-6标记脂质体,结合DOX本身的荧光性能,分析阳离子脂质体的细胞摄取行为,并通过MTT实验验证其增强体外抑制肿瘤细胞活性。期望该脂质体的构建有利于推动近红外二区成像技术在肿瘤诊断与治疗中的应用与发展。
1 材 料
1.1 药品与试剂
大豆磷脂(Lipoid S 100,德国Lipoid公司);胆固醇(日本东京化成工业株式会社);十八胺(90%,麦克林化学试剂有限公司);盐酸阿霉素(99.92%,上海毕得医药科技有限公司);香豆素-6、DAPI、4%多聚甲醛固定液(源叶生物科技有限公司);其他试剂均国产分析纯。MDA-MB-231(人乳腺肿瘤细胞)由江苏省肿瘤发生与干预实验室提供。
1.2 仪 器
SHZ-B(III)循环多用真空泵(南京科博尔仪器设备有限公司);医用离心机(湖南湘仪实验室仪器开发有限公司);UV-3600紫外分光光度计(日本岛津公司);ZS90纳米粒径电位分析仪(英国Malvern公司);THZ-320台式恒温振荡器(上海精宏实验设备有限公司);SCIENTZ-IID超声波细胞粉碎机(宁波新芝生物科技股份有限公司);低温时间分辨荧光光谱仪(英国爱丁堡仪器公司);NIR-II活体成像系统(武汉光映美科技有限公司);酶标仪(美国伯腾仪器有限公司);场发射扫描电子显微镜(德国Zeiss公司);透射电子显微镜(日本电子株式会社)。
2 方 法
2.1 脂质体的制备及物理表征
根据文献合成 IR1061后[14],用薄膜水化-超声法制备NIR-II成像阳离子脂质体。精确称取卵磷脂、吐温-80、十八胺、胆固醇和IR1061(质量比120∶24∶12∶12∶1),用二氯甲烷/乙醇(体积比 8∶1)溶于圆底烧瓶内,37℃旋转蒸发成膜后,加入0.9%NaCl溶液10mL,37℃下振荡水化3 h,水浴超声 3 min,过 450和 220 nm滤膜各两次,得IR1061阳离子脂质体。制备载阿霉素NIR-II成像阳离子脂质体,精确称取卵磷脂、吐温-80、十八胺、胆固醇和 IR1061(质量比120∶24∶12∶12∶1)按原方案成膜后,根据硫酸铵梯度载药法加入3%硫酸铵溶液水化,将所得脂质体于0.9%NaCl溶液中透析48 h后,按配方加入阿霉素(PC-DOX,8∶1),在50℃下搅拌30 min。将制得阿霉素脂质体置于0.9%NaCl中透析48 h,去除游离阿霉素。制备非十八胺改性的DOX-IR1061脂质体(DOX-IR1061-Liposome)作为对照组,其配方为卵磷脂、吐温-80、胆固醇和 IR1061(质量比120∶24∶12∶1),制备方法同DOX-IR1061阳离子脂质体。选择香豆素-6,一种激光转化效率高,性能较稳定的脂溶性染料作为荧光探针用于监测阳离子脂质体及普通脂质体的细胞摄取行为。为了实现对脂质体的细胞摄取行为的观测,用等物质的量香豆素-6代替IR1061制备DOX-Coumarin-6阳离子脂质体及DOX-Coumarin-6脂质体。同时,DOX的荧光性质使其可作为荧光药物模型用于药物摄取分析。
通过马尔文粒度仪测量脂质体流体动力学尺寸,PDI及Zeta电位。通过透射电子显微镜(TEM)和扫描电子显微镜(SEM)观察载药脂质体形态。
2.2 脂质体包封率测定
精确称量DOX,用甲醇溶于5 mL量瓶中,定容,制备10,20,30μg/mL DOX溶液。同样精确称取DOX适量,与空白脂质体混合后,用甲醇破乳,配制10,20,30μg/mL阿霉素-脂质溶液。用紫外分光光度仪对配得溶液在200~600 nm光区进行扫描,得在495 nm处阿霉素有吸收峰,并且不受磷脂影响。选择495 nm为测定波长,测量10,20,30,40,50μg/mL阿霉素甲醇溶液紫外吸收,计算其线性回归方程后,根据公式计算DOX包封率。
2.3 脂质体稳定性
将DOX-IR1061阳离子脂质体储存在4℃环境下,脂质体的稳定性通过测定其两周后粒径和PDI变化评估。同时,卵磷脂的化学性质不稳定,易氧化水解,其氧化产物丙二醛(MDA)含量超过0.1μg/mg PC时,可造成溶血,因此有必要将脂质体氧化程度作为其稳定性的评估标准之一。实验中根据硫代巴比妥酸法[15]测定脂质体中磷脂氧化程度。
2.4 DOX-IR1061阳离子脂质体近红外二区成像性能
按一定比例稀释DOX-IR1061阳离子脂质体后用低温时间分辨荧光光谱仪测定其近红外二区光谱。将DOX-IR1061阳离子脂质体按一定浓度配比(1.6,3.2,4.8,6.4,8 mg PC/mL)置于离心管后,用NIR II生物成像系统(980 nm激发)收集荧光信号,并通过(1 000~1 200 nm)带通滤波器过滤测定脂质体体外成像性能。用毛细吸管吸取适量脂质体溶液后置于一定厚度组织下,用NIR-II生物成像系统观察。
2.5 激光共聚焦分析细胞摄取行为
将MDA-MB-231在含盖玻片的培养皿中培养24 h。观察细胞贴壁并生长至适宜密度后用DOXCoumarin-6阳离子脂质体和DOX-Coumarin-6脂质体,分别处理细胞1和2 h,并用PBS洗涤3次。然后用4%多聚甲醛固定细胞15 min,再次使用PBS洗涤3次。加入5μg/mL DAPI染液染色,避光放置5 min后去除染色剂,加入抗荧光淬灭剂封片。使用激光共聚焦显微镜观察玻片样品(405 nm:DAPI,488 nm:香豆素-6,555 nm:DOX)。
2.6 体外细胞毒性研究
用MTT试验评估DOX-IR1061脂质体和DOX-IR1061阳离子脂质体的肿瘤细胞抑制效果。将处于生长期的MDA-MB-231配成单细胞悬液后以一定密度接种至96孔板(100μL),在DMEM培养基中于37℃,5%CO2下培养24 h。随后将细胞分别与DOX,DOX-IR1061脂质体,DOX-IR1061阳离子脂质体(0.25,0.5,1,2,4,8,16,32μg DOX/mL,100μL),细胞复孔数5,温育24 h后向各孔中加入 MTT溶液(5 mg/mL,20μL)并孵育4 h。离心后小心吸弃孔内培养上清液并加入DMSO 100μL。通过使用酶标仪测量570 nm处的吸收度来计算细胞活力。
3 结 果
3.1 DOX-IR1061阳离子脂质体表征
通过薄膜水化-超声法制备脂质体,测得DOXIR1061阳离子脂质体流体动力学尺寸为(149.9±5.3)nm,多分散系数为0.175,Zeta电位为+(25.6±0.32)mV,DOX包封率(95.8±2.4)%。在 TEM下观察如图1-a所示,脂质体结构清晰完整,并由于硫酸铵与阿霉素形成结晶,观察到脂质体内部明显的内核结构。以上数据显示DOX-IR1061阳离子脂质体具有相对均匀的分布,并成功载入阿霉素。
通过薄膜水化-超声法制备脂质体,测得DOXIR1061脂质体流体动力学尺寸为(138.3±6.1)nm,多分散系数为0.151,Zeta电位为-(0.538±0.12)mV,略带负电荷。通过扫描电子显微镜观察在4℃环境下放置48 h的DOX-IR1061阳离子脂质体和 DOX-IR1061脂质体,可以观察到 DOXIR1061阳离子脂质体结构清晰,粒径分布相对均匀(图1-b);而DOX-IR1061脂质体结构模糊,出现大量聚集的情况(图1-c)。因此,DOX-IR1061阳离子脂质体比DOX-IR1061脂质体更加稳定。
此外,还对DOX-IR1061阳离子脂质体的稳定性做了进一步分析,置于4℃环境下保存2周后,可以观察到溶液仍保持澄清。利用马尔文粒度仪测量脂质体粒径,其流体动力学尺寸为(160.3±3.2)nm,粒径变化小,PDI为0.215(小于0.3)。
进一步对其进行磷脂氧化分析。根据文献,丙二醛(MDA)含量超过1μg/mg PC的氧化磷脂可造成溶血。其溶液中质量浓度可由535 nm处吸收度与系数4.15的乘积计算得到,MDA/PC=0.031 μg/mg PC,远小于1μg/mg PC。
因此实验制得DOX-IR1061阳离子脂质体能够在4℃下稳定保存。除了表面电位电荷(+25.6±0.32 mV)的存在降低了脂质体聚集的发生外,这可能与吐温-80吸附于脂质双层表面,形成“立体屏障”,增加了脂质体的稳定性有关[16]。
测试脂质体NIR-II光谱(980 nm激发),如图1-d所示,尽管其发射峰出现略微蓝移,但仍然处于NIR-II范围内,能够实现近红外二区成像。
3.2 NIR-II体外成像
NIR II生物成像系统(980 nm激发)收集NIRII荧光信号,可观察到DOX-IR1061阳离子脂质体在体外清晰明显的荧光,按质量浓度梯度稀释后,可观察到脂质体荧光强度随着质量浓度升高而增强(图1-e)。使用毛细吸管吸取脂质体溶液置于0.8 cm厚度组织下可观察到清晰明显的荧光,如图1-f所示。

Figure 1 (A)TEM picture of DOX-IR1061-Cationic liposome;(B)SEM picture of DOX-IR1061-Cationic liposome,48 h;(C)SEM picture of DOXIR1061-Liposome,48 h;(D)Emission spectrum of DOX-IR1061-Cationic liposome(excitation:980 nm);(E)1.6,3.2,4.8,6.4,8 mg PC/mL from left to right,NIR-II imaging(excitation:980 m,filter:1 000-1 200 nm);(F)Tissue thickness:0.8 cm NIR-II imaging in vitro(excitation:980 nm,filter:1 000 1 200 nm)
3.3 阳离子脂质体促进细胞对药物的摄取
通过激光共聚焦显微镜分析细胞的脂质体摄取行为,以 DOX-Coumarin-6脂质体作为对照组(control)。如图2所示,细胞核用DAPI染成蓝色,绿色荧光来自香豆素-6,红色荧光来自阿霉素。在孵育1 h后,在DOX-Coumarin-6阳离子脂质体处理的细胞中可以观察到明显的绿色荧光和红色荧光,而在对照组中几乎无法观察到来自脂质体的荧光。而在孵育2 h后,DOX-Coumarin-6阳离子脂质体处理的细胞的荧光也明显强于对照组。因此细胞对阳离子脂质体的摄取效率显著高于普通脂质体,相应地增加了肿瘤细胞对DOX的摄取,这有助于提高载药脂质体的细胞杀伤效率。
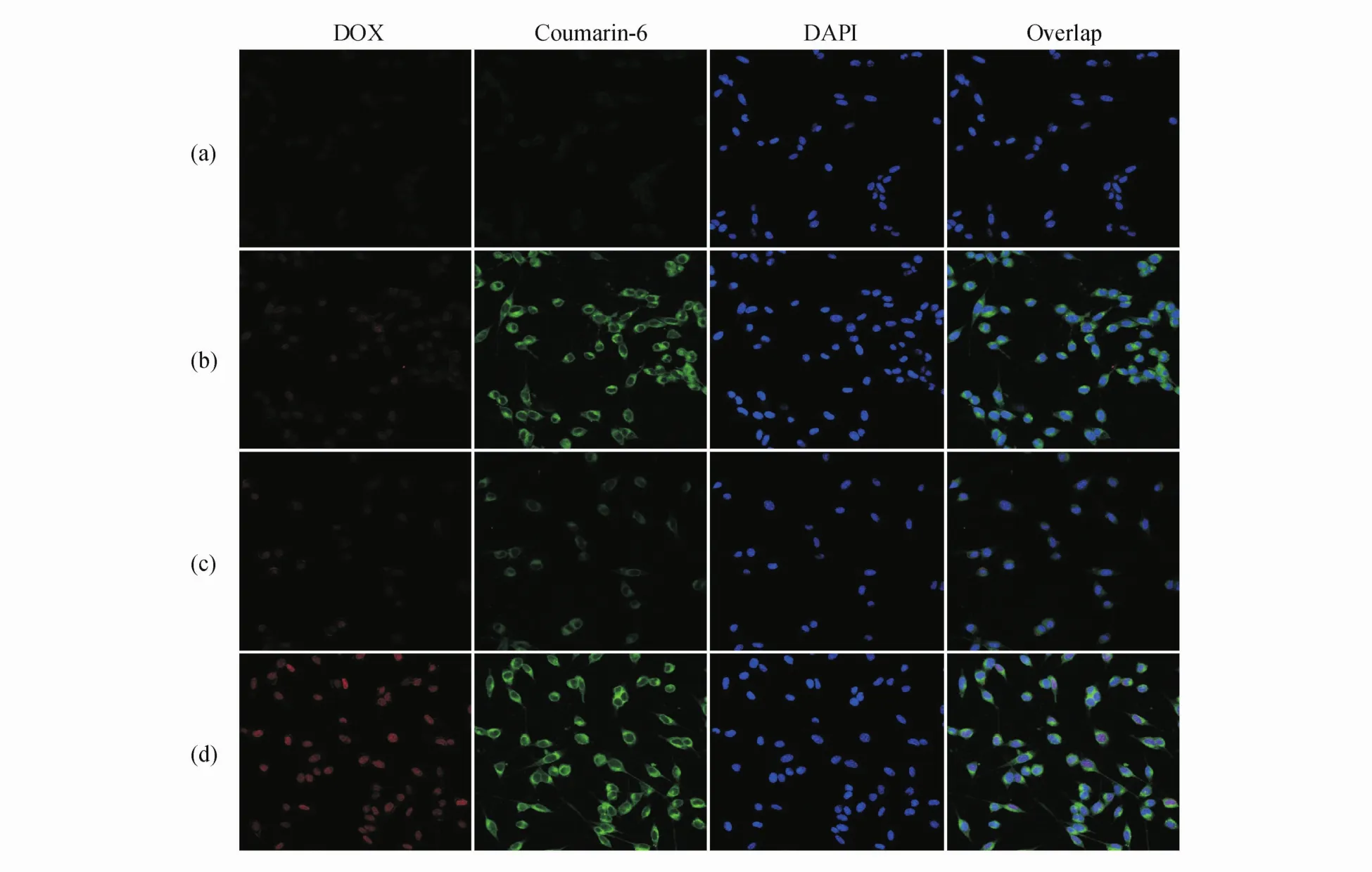
Figure2 Laser confocal image of(a)DOX-Coumarin-6 liposome treated cells for1 h;(b)DOX-Coumarin-6-Cationic liposome treated cells for1 h;(c)DOX-Coumarin-6 liposome treated cells for 2 h;(d)DOX-Coumarin-6-Cationic liposome treated cells for 2 h
3.4 体外细胞毒性研究
通过MTT测定评估 DOX,DOX-IR1061脂质体,DOX-IR1061阳离子脂质体对MDA-MB-231细胞的细胞毒性。如图3所示,非十八胺改性的DOX-IR1061脂质体的肿瘤细胞抑制率显著低于盐酸阿霉素。这可能是因为盐酸阿霉素本身为水溶性药物,能够迅速进入细胞,而阿霉素被普通脂质体包裹后,细胞摄取降低。DOX-IR1061阳离子脂质体具有比游离DOX及普通载药脂质体更高的细胞毒性,并呈剂量依赖性。即十八胺与DOX协同增强抗肿瘤作用,并随着脂质体质量浓度的提高而增强。

Figure 3 Viability of MDA-MB-231 cells treated with different drugs(±s,n=3)**P<0.01,***P<0.001 vs DOX group
4 总结与展望
近红外二区荧光成像技术的优势使其具有巨大的发展潜力,通过纳米技术将这一成像优势与化疗功能结合有利于推动肿瘤的诊疗发展。本研究成功构建了用于近红外二区荧光成像的IR1061脂质体,对脂质体进行表征并通过体外成像实验验证其近红外二区成像能力,并通过在脂质体水核载入DOX作为治疗剂,具备实现诊断与治疗联合的潜力。另一方面,通过激光共聚焦实验验证所制备阳离子脂质体引起细胞对DOX摄取增强,并进一步通过细胞实验证明,十八胺与DOX联合起到增强脂质体抗肿瘤能力的作用。此外,实验和理论研究表明,由于阳离子纳米颗粒对肿瘤血管壁的静电吸引,与带负电荷或中性纳米颗粒相比,具有更强的经肿瘤血管壁向肿瘤区域渗透的能力[3]。相信这一阳离子脂质体的构建有利于近红外二区成像应用的探讨及诊疗一体化的推进。在进一步研究中,考虑通过电子相互作用涂覆带负电的透明质酸壳,避免脂质体与正常血管的相互作用。当脂质体富集于肿瘤,存在于肿瘤微环境的透明质酸酶(HAase)会降解HA壳并暴露阳离子脂质体的高正电荷,以促进肿瘤细胞对脂质体的摄取[17],并在此基础上进行体内实验,结合近红外二区成像与组织分析探讨诊疗一体化的实现。
