喉鳞状细胞癌ESRRG基因启动子甲基化及临床意义研究
2019-08-28胡燕沈志森周重昌袁洁徐捷郝文娟叶栋邓红霞
胡燕 沈志森 周重昌 袁洁 徐捷 郝文娟 叶栋 邓红霞
喉癌是常见的头颈部恶性肿瘤之一[1],其中喉鳞状细胞癌(LSCC)是最常见的病理学类型[2]。手术和放化疗是目前临床上治疗LSCC的主要方法。据统计,LSCC患者的5年生存率较低,这主要是由于患者淋巴结转移率、复发率和第二原发肿瘤发生率较高所致[3]。LSCC的发生是多因素共同作用的结果,其中包括遗传因素及吸烟、饮酒、人乳头瘤病毒感染等环境因素[4],但LSCC发生的具体分子机制尚待深入探讨。DNA甲基化是最早发现的基因修饰方式之一,启动子区域CpG岛的甲基化修饰对基因表达的影响十分重要,高甲基化修饰会导致基因转录抑制或沉默。抑癌基因高甲基化会导致抑癌作用异常,从而导致癌症发生、发展[5]。人雌激素相关受体 γ(ESRRG)基因位于人体染色体 1q41[6]。ESRRG蛋白属孤儿核受体,可在无天然配体的条件下发挥生物学作用[7]。研究表明,ESRRG基因与肿瘤细胞代谢、增殖、转移等有关,起抑癌作用,包括乳腺癌[8]、子宫内膜癌[9]、卵巢癌[10]及前列腺癌[11]等性别相关肿瘤。据世界癌症组织统计,LSCC男性高发,在女性中发生率较低,笔者推测LSCC的发生亦与性别相关基因有关。基于此,本研究探讨ESRRG基因启动子在男性LSCC组织中的甲基化状态,分析其与临床病理特征及预后的关系,并评估其对LSCC的诊断价值,现报道如下。
1 对象和方法
1.1 对象 选取2011年4月至2015年2月在宁波大学附属李惠利医院耳鼻咽喉头颈外科行手术治疗的男性 LSCC 患者 89 例,年龄 40~86(60.15±9.06)岁。患者术前均未接受过放化疗。病理学诊断严格按照国际癌症控制联盟(UICC)分类指南(TNM 2002)分期,其中Ⅰ期28例、Ⅱ期15例、Ⅲ期12例、Ⅳ期34例。患者术后随访5年,其中失访5例,死亡32例,存活52例。术中留取的LSCC组织与距癌组织边缘0.5cm以上的癌旁正常组织标本立即置于RNA保存液中保存于-80℃冰箱。本研究获宁波大学附属李惠利医院医学伦理委员会批准,患者知情同意并签署知情同意书。
1.2 方法
1.2.1 DNA提取及亚硫酸盐转化和纯化 严格按照QIAamp DNA Mini试剂盒 (Qiagen,Hilden,Germany)说明书提取患者LSCC组织与癌旁正常组织的DNA。严格按照ZYMO EZ DNA Methylation-Gold试剂盒(ZymoRe.Search,Irvine,CA,USA)说明书进行DNA亚硫酸盐转化和纯化。
1.2.2 DNA扩增及焦磷酸测序 检测LSCC组织与癌旁正常组织中ESRRG基因启动子上连续6个CG位点(hg19:chr1:217311596-217311629)的甲基化水平。严格按照聚合酶链式反应(PCR)试剂盒(PyroMark PCR Kit;Qiagen)说明书将亚硫酸盐处理过的DNA进行扩增。ESRRG基因正向引物序列为 5′-TAGAGTTAGAGGGAGATGAATTG-3′,反向引物序列为 5′-Biotin-TCTTTTCAAATCCATCACTAA-3′。PCR反应条件如下:95℃预变性10min后,循环“95℃变性30s,50℃退火 40s,72℃延伸 60s”共 45次。应用 PyroMark Q24(Qiagen)焦磷酸测序仪,按焦磷酸测序试剂盒(EpiTech Bisulfite Kits,Qiagen)说明书对ESRRG基因启动子进行测序,测序序列为 5′-GGGAGATGAATTGGG-3′,直接从测序仪上读得ESRRG基因启动子甲基化水平。以上所有实验步骤均重复3次,取3次结果的平均值。
1.3 观察指标 (1)比较LSCC组织与癌旁正常组织ESRRG基因启动子甲基化水平。(2)分析LSCC组织ESRRG基因启动子甲基化水平与患者临床病理特征的关系,包括年龄、吸烟行为及肿瘤组织学类型、部位、T分期、淋巴结转移及临床分期等。(3)评估ESRRG基因启动子甲基化水平对LSCC的诊断价值。(4)以甲基化水平26.41%为临界值,将患者分为高甲基化组(61例)和低甲基化组(28例),分析 LSCC组织 ESRRG基因启动子甲基化水平与患者预后的关系。
1.4 统计学处理 应用SPSS 18.0统计软件;计量资料以表示,LSCC组织与癌旁正常组织ESRRG基因启动子甲基化水平比较采用配对t检验,不同临床病理特征的LSCC组织ESRRG基因启动子甲基化水平比较采用两独立样本t检验;绘制ROC曲线评估ESRRG基因启动子甲基化水平对LSCC的诊断价值,得出AUC、灵敏度、特异度;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用log-rank检验;P<0.05为差异有统计学意义。
2 结果
2.1 LSCC组织与癌旁正常组织ESRRG基因启动子甲基化水平比较 见表1。

表1 LSCC组织与癌旁正常组织ESRRG基因启动子甲基化水平比较(%)
由表1可见,LSCC组织ESRRG基因启动子每个CG位点的甲基化水平均高于癌旁正常组织(均P<0.05)。6个CG位点甲基化水平的均值可以代表组织的甲基化水平,结果显示LSCC组织ESRRG基因启动子甲基化水平高于癌旁正常组织(P<0.05)。
2.2 LSCC组织ESRRG基因启动子甲基化水平与患者临床病理特征的关系分析 见表2。
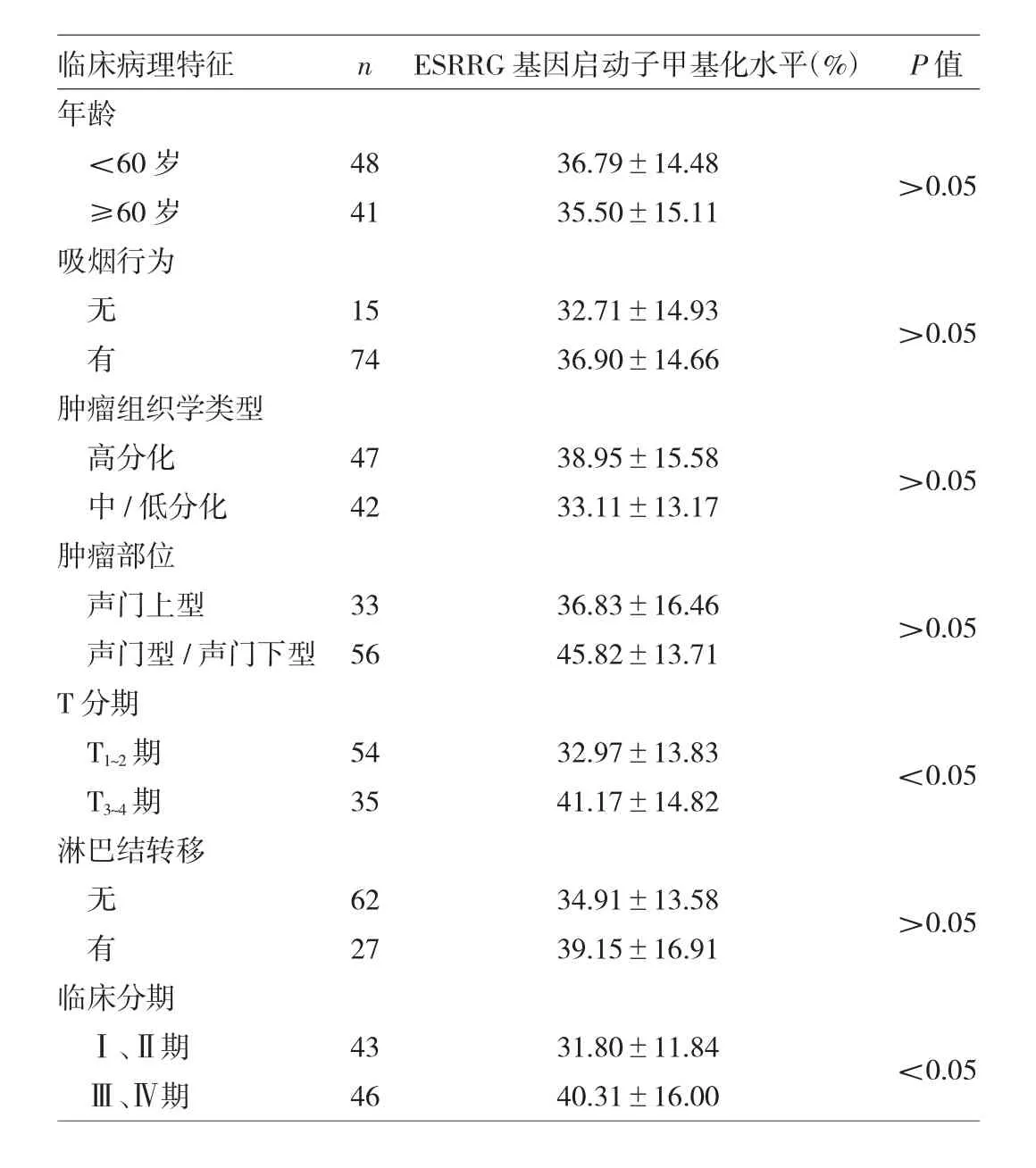
表2 LSCC组织ESRRG基因启动子甲基化水平与患者临床病理特征的关系分析
由表2可见,T3~4期患者LSCC组织ESRRG基因启动子甲基化水平高于 T1~2期患者(P<0.05),Ⅲ、Ⅳ期患者LSCC组织ESRRG基因启动子甲基化水平高于Ⅰ、Ⅱ期患者(P<0.05)。不同年龄、吸烟行为、肿瘤组织学类型、肿瘤部位、淋巴结转移的患者LSCC组织ESRRG基因启动子甲基化水平比较差异均无统计学意义(均 P>0.05)。
2.3 ESRRG基因启动子甲基化水平对LSCC的诊断价值分析 见图1。
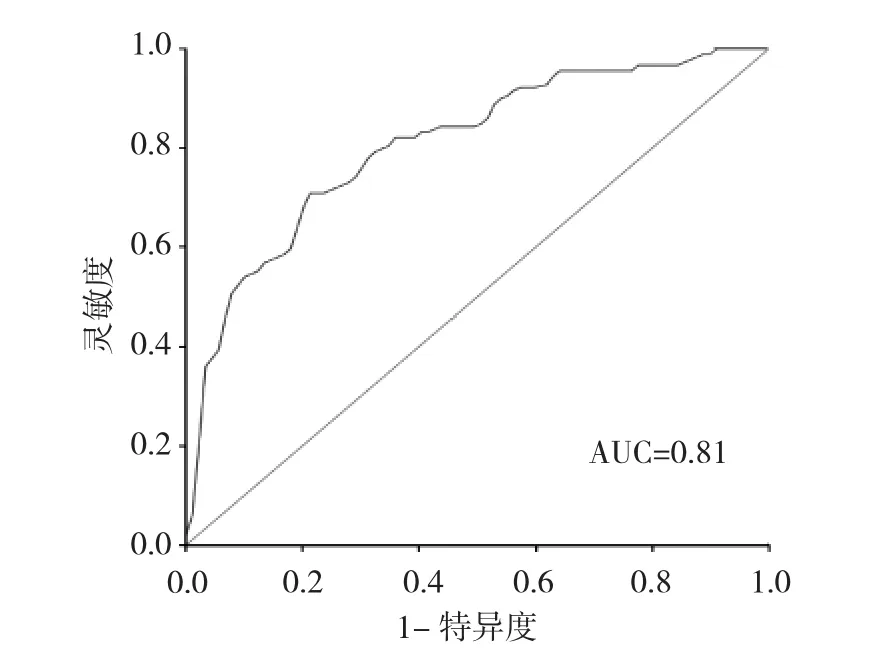
图1 ESRRG基因启动子甲基化水平诊断LSCC的ROC曲线
由图1可见,AUC为0.81,表明检测ESRRG基因启动子甲基化水平对诊断LSCC具有一定的诊断价值。当ESRRG基因启动子甲基化水平为26.41%时,诊断LSCC的灵敏度、特异度分别为0.7079、0.7865。此时,假阳性率和假阴性率分别为0.2135,0.2921,阳性预测值为0.7683,阴性预测值为0.7292,诊断符合率为74.72%。
2.4 LSCC组织ESRRG基因启动子甲基化水平与患者预后的关系分析 在随访中,5例患者失访(均为低甲基化组),低甲基化组患者4例死亡,高甲基化组患者28例死亡,其余存活。生存曲线见图2、3。
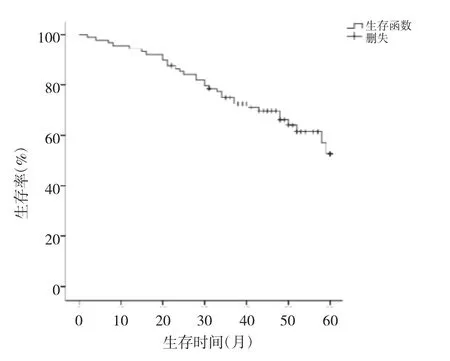
图2 89例LSCC患者生存曲线

图3 高甲基化组与低甲基化组患者生存曲线比较
由图2可见,LSCC患者的5年生存率为52.65%。由图3可见,ESRRG基因启动子低甲基化组患者5年生存率高于高甲基化组患者(69.03%vs 45.12%,P<0.05)。
3 讨论
ESRRG蛋白为孤儿核受体,可在无天然配体的条件下发挥生物学作用。其主要通过结合相关基因启动子序列,转录调控下游靶基因的表达发挥作用,而小分子配体可以加强(PGC-1α[12]、GRIP-1)或抑制(SHP、DAX-1[13]、SMILE[14]、GNL3L)ESRRG 对靶基因的转录作用。采用染色体免疫沉淀技术(CHIP)分析发现,ESRRG基因的靶基因有很多[15],目前研究的靶基因包括代谢相关基因如己糖激酶 2(HK2)、甘油醛脱氢酶(GAPDH)及丙酮酸脱氢酶激酶4(PDK4)[16]等;细胞周期相关基因如p21、p27[8]等;细胞迁移相关基因如E-钙黏附蛋白[17]、S100A4[18]等。因此,ESRRG基因与肿瘤细胞代谢、增殖、转移等有关。ESRRG与雌激素受体的高度同源主要位于ESRRG的DNA结合结构区,因此ESRRG在性别相关肿瘤中研究较多,发现其主要起抑制肿瘤的作用。
目前临床诊断LSCC的方法主要包括影像学技术及内镜或支撑喉镜下病理学活检。影像学技术作为普查项目不实际,往往在晚期肿瘤患者症状明显时考虑此技术,并且作为手术参考的辅助项目进行;内镜或支撑喉镜下病理学活检目前仍是LSCC诊断的金标准,但该方法是有创操作,也不适用于普查。LSCC治疗方法主要以手术为主,放化疗为辅,而晚期LSCC手术大大降低了患者的生活质量,如通气障碍、发声障碍等。故寻求微创、简便、早期诊断LSCC的肿瘤标记物及治疗靶点有着重要意义。大量研究从分子遗传角度对LSCC的发病机制及预后进行研究,而目前仍无巨大的突破,仍未有同甲胎蛋白、癌胚抗原等公认的肿瘤标志物的出现,因此探索LSCC的分子遗传学机制仍在继续。目前所知,LSCC患者中大部分为男性。因此,临床有理由推测男性中存在某种基因表达低于女性,而此基因具有抑制LSCC发生、发展的作用。
已有研究报道DNA高甲基化可导致LSCC抑癌基因表达下调,抑制癌症进展[19]。在LSCC组织中,高甲基化的基因有 CBY[20]、DAPK[21]等,这些基因都被视为LSCC的抑癌基因。本研究主要探讨ESRRG基因启动子在男性LSCC组织中的甲基化状态,分析其与临床病理特征及预后的关系,并评估其对LSCC的诊断价值。结果显示,ESRRG基因启动子甲基化水平在男性LSCC组织中明显高于癌旁正常组织,表明在男性LSCC组织中ESRRG基因的转录可能受到限制,从而减少了ESRRG蛋白的表达,加大了LSCC发生的风险。因此,ESRRG基因在LSCC中可能也发挥着抑癌作用。
在ESRRG基因启动子甲基化水平与LSCC患者临床病理特征的关系分析中发现,ESRRG基因启动子甲基化水平与肿瘤T分期和临床分期呈正相关,而与淋巴结转移无明显关系。临床分期是由TNM分期综合评估的结果,本研究结果发现ESRRG基因启动子甲基化水平对临床分期的影响主要是T分期引起的,因此笔者考虑ESRRG基因启动子甲基化状态可能在LSCC中主要对肿瘤大小起抑制作用,可能具有抑制肿瘤增殖的作用。同时ESRRG基因启动子高甲基化可以预测肿瘤进展情况,可为治疗方案作一参考。此外,临床还可通过降低患者ESRRG基因启动子甲基化状态抑制肿瘤进展。研究报道,DNA甲基化状态与患者的生活习惯有关[22]。在LSCC的研究中,p14、APC基因甲基化与吸烟、饮酒等相关[23]。而本研究中ESRRG基因启动子甲基化水平与男性LSCC患者吸烟行为并无统计学上的意义,这提示ESRRG基因启动子甲基化水平与吸烟因素无相关性,可能存在其他影响ESRRG基因启动子甲基化的危险因素。
肿瘤特异性标志物一直以来是癌症研究中的热点话题,而目前尚无特异的肿瘤标志物可以协助早期诊断LSCC及评估LSCC患者预后。本研究结果显示,ESRRG基因启动子甲基化水平对诊断LSCC具有较高的灵敏度、特异度,分别为0.7079、0.7865。AUC表明ESRRG基因作为肿瘤标志物具有一定的可靠性,具有较高的诊断价值。其可以与其他肿瘤标志物,如上述CMTM3、miR-34a等基因进行联合诊断。有研究报道DNA甲基化状态可纳入癌症的预后指标[21]。据相关数据统计,LSCC患者5年生存率约57%[3]。本研究中LSCC患者的5年生存率约52%,稍低于上述统计情况。将LSCC患者分成高、低甲基化组,对这两组患者的5年生存率进行比较,发现低甲基化组患者的5年生存率明显高于高甲基化组,说明ESRRG基因启动子高甲基化水平是影响LSCC患者预后的不良因素。
综上所述,本研究结果显示ESRRG基因启动子在LSCC组织中呈高甲基化水平,且在T3~4期及Ⅲ、Ⅳ期患者LSCC组织中明显增高。ESRRG基因启动子高甲基化LSCC患者预后较差。检测ESRRG基因启动子甲基化水平可为LSCC的诊断和靶向治疗提供新思路,并为预后判断提供新线索。
