FoxO1在高糖诱导小鼠胰岛β细胞去分化中的作用机制研究
2019-08-28高倩章文俊杨国军潘晔陈乃君朱巍金华伟
高倩 章文俊 杨国军 潘晔 陈乃君 朱巍 金华伟
糖尿病的病因和发病机制极为复杂,至今未完全阐明。胰岛素作为人体内最主要的降糖激素,由胰岛β细胞合成和分泌。目前研究认为,胰岛β细胞去分化在糖尿病的发生、发展中起重要作用,然而其去分化的机制尚不明确。Talchai等[1]研究发现,敲除FoxO1基因的小鼠在代谢压力(多产、高龄)下分化成熟的胰岛β细胞会转化成一种表达神经元素3、八聚体转录因子4(Oct4)的前体细胞,小鼠最终患上糖尿病。刘婵等[2]则发现体外培养的小鼠胰岛β细胞在高糖培养诱导下会发生去分化,并发现磷酸化的FoxO1表达改变。本研究通过观察高糖培养诱导的小鼠胰岛β细胞磷酸化FoxO1(p-FoxO1)、FoxO1 蛋白和 mRNA、前 β 细胞标志物Oct4蛋白以及β细胞标志物胰腺十二指肠同源盒-1(PDX1)蛋白表达水平变化,并于FoxO1磷酸化酶抑制剂渥曼青霉素干预后观察其对β细胞去分化的影响,探讨FoxO1在高糖培养诱导小鼠胰岛β细胞去分化中的作用机制,现报道如下。
1 材料和方法
1.1 材料 小鼠胰岛β细胞MIN-6细胞由中南大学细胞室提供,HTCC编号:9号。渥曼青霉素为中国solarbio公司产品(批号:200706)。DMEM培养液为美国HyClone公司产品,FBS为澳大利亚BOVOGEN公司产品。p-FoxO1(位点:256、319)一抗、FoxO1、Oct4 和PDX1一抗为美国bioworld公司产品,HRP标记二抗为美国jackson公司产品。逆转录试剂盒(RR037A)和SYBR Premix Ex TapTM(RR420)购于日本 TaKaRa公司。Molecular Imager ChemiDocTMXRS+成像系统为美国Bio-Rad公司产品。
1.2 方法
1.2.1 细胞培养和分组 MIN-6细胞常规培养在含10%FBS、葡萄糖浓度25mmol/L的DMEM培养液中,置于37℃、5%CO2的孵箱中培养,2~3d换液1次。细胞分组如下:常规糖浓度组(葡萄糖浓度25mmol/L,RG组)、高张浓度组(葡萄糖浓度25mmol/L+甘露醇35mmol/L,RG+M组)、高糖浓度组(葡萄糖浓度 60mmol/L,HG组)、高糖浓度+渥曼青霉素干预组(葡萄糖浓度60mmol/L+渥曼青霉素 50nmol/L,HG+W组)。
1.2.2 p-FoxO1(256)、p-FoxO1(319)、FoxO1、Oct4、PDX1蛋白表达水平检测 采用Western blot法。MIN-6细胞分组培养后用BCA法测定蛋白浓度,操作按说明书进行。变性后取40μg总蛋白上样,SDS-PAGE胶进行电泳,转膜、封闭后分别加入 p-FoxO1(256)、p-FoxO1(319)、FoxO1、Oct4、PDX1、β-actin 一抗孵育过夜;洗膜后分别加入相应的HRP标记的二抗,再次洗膜后予ECL化学发光显色,Molecular Imager ChemiDocTMXRS+成像系统自动曝光扫描并用Imagelab软件分析结果,以所测得的各条带的吸光度与内参照β-actin吸光度的比值作为蛋白表达的半定量值。实验重复3次。
1.2.3 FoxO1 mRNA表达水平检测 采用qRT-PCR法。用Trizol法提取细胞总RNA,分光光度计检测RNA浓度及纯度,并逆转录为cDNA。用SYBR Green荧光染料定量PCR扩增。引物设计采用Primer Premier 5.0软件包。引物的特异性比对采用NCBI的Primer BLAST。引物由上海桑尼生物科技有限公司合成。实时荧光定量PCR采用20μl体系,SYBR荧光染料 10μl、上下游Primer各 0.5μl、DEPC 水 8μl、cDNA 1μl。以 β-actin 为内参,各引物序列如下:(1)FoxO1上游引物 5′-GAGCGTGCCCTACTTCAA-3′,下游引物 5′-CCATCTCCCAGGTCATCC-3′;(2)β-actin上游引物5′-CTGTCCCTGTATGCCTCTG-3′,下游引物 5′-ATGTCACGCAGATTTCC-3′。用SYBR Green染料荧光定量PCR分析,扩增条件为95℃预变性30s;随后 95℃ 5s,60℃20s,40 个循环。采用相对定量 2-ΔΔCT法计算 mRNA 表达水平。实验重复3次。
1.3 观察指标 观察并比较:(1)不同培养时间(培养0、12、24、48h)HG 组 MIN-6 细胞 p-FoxO1(256)、p-FoxO1(319)、FoxO1 蛋白表达水平;(2)不同培养时间(培养 0、12、24、48、72h)HG 组 MIN-6 细胞 FoxO1 mRNA 表达水平;(3)培养 12h时 RG、RG+M、HG、HG+W组 MIN-6 细胞 p-FoxO1(256)、p-FoxO1(319)、FoxO1蛋白表达水平,及培养72h时4组MIN-6细胞Oct4、PDX1蛋白表达水平。
1.4 统计学处理 应用SPSS 20.0统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同培养时间HG组MIN-6细胞p-FoxO1(256)、p-FoxO1(319)、FoxO1蛋白表达水平比较 见图1、2。
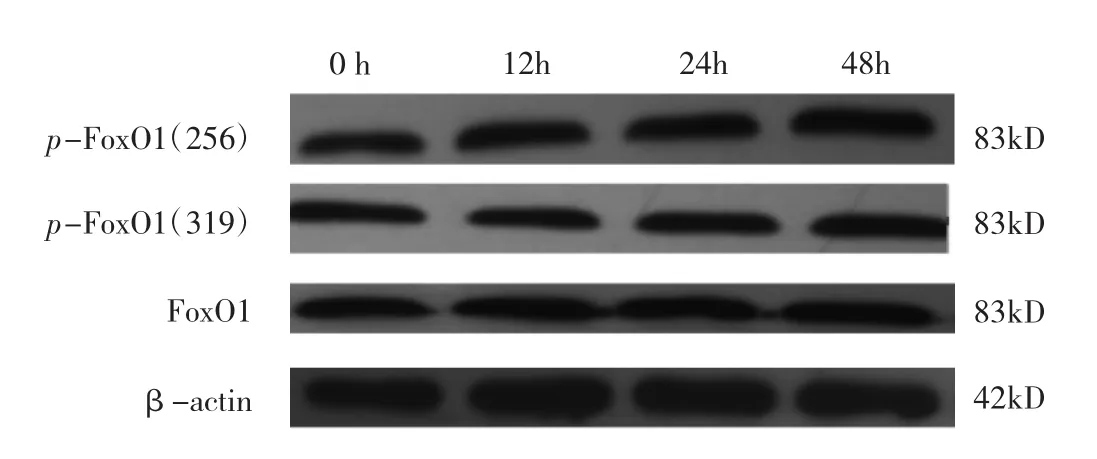
图1 不同培养时间HG组MIN-6细胞p-FoxO1(256)、p-FoxO1(319)、FoxO1蛋白表达电泳图
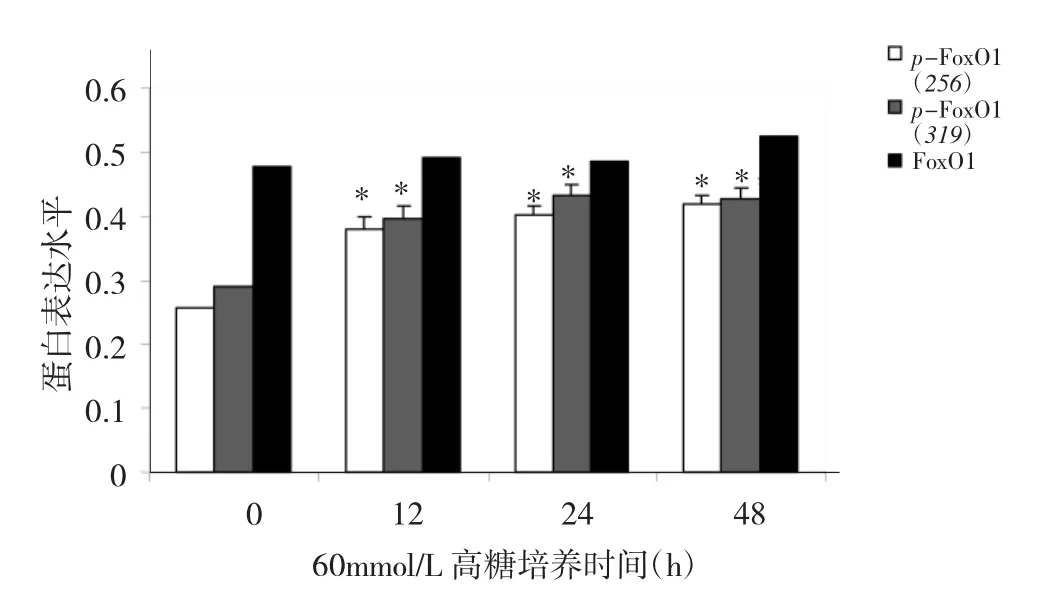
图2 不同培养时间HG组MIN-6细胞p-FoxO1(256)、p-FoxO1(319)、FoxO1蛋白表达水平比较(与0h比较,*P<0.05)
由图1、2可见,HG组MIN-6细胞高糖培养0、12、24、48h 时 p-FoxO1(256)、p-FoxO1(319)表达水平比较差异均有统计学意义(均P<0.05),而FoxO1蛋白表达水平比较无统计学差异(P>0.05)。高糖培养12、24、48h 时 MIN-6 细胞 p-FoxO1(256)、p-FoxO1(319)表达水平均明显高于0h(均P<0.05),提示在一定时间范围内,高糖可以刺激MIN-6细胞FoxO1信号分子256及319位点发生磷酸化。
2.2 不同培养时间HG组MIN-6细胞FoxO1 mRNA表达水平比较 见图3。
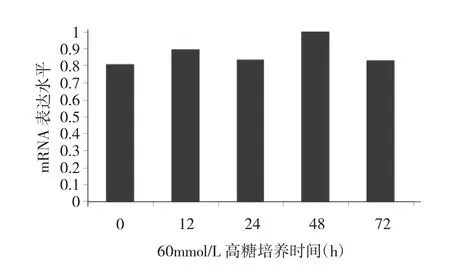
图3 不同培养时间HG组MIN-6细胞FoxO1 mRNA表达水平比较
由图3可见,HG组MIN-6细胞高糖培养0、12、24、48、72h时FoxO1 mRNA表达水平比较差异无统计学意义(P>0.05)。
2.3 培养 12h时 RG、RG+M、HG、HG+W 组 MIN-6细胞 p-FoxO1(256)、p-FoxO1(319)、FoxO1 蛋白表达水平比较 见图4、5。

图4 培养12h时RG、RG+M、HG、HG+W组MIN-6细胞p-FoxO1(256)、p-FoxO1(319)、FoxO1 蛋白表达电泳图
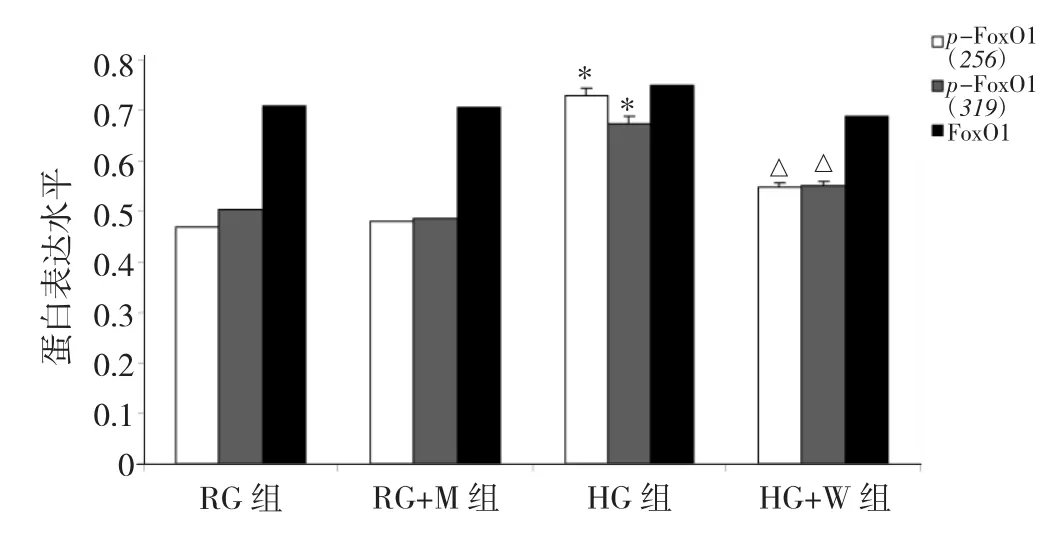
图5 培养12h时RG、RG+M、HG、HG+W组MIN-6细胞p-FoxO1(256)、p-FoxO1(319)、FoxO1蛋白表达水平比较(与RG组比较,*P<0.05;与 HG 组比较,△P<0.05)
由图 4、5可见,培养 12h时 RG、RG+M、HG、HG+W 组 MIN-6 细胞 p-FoxO1(256)、p-FoxO1(319)表达水平比较差异均有统计学意义(均P<0.05),而FoxO1蛋白表达水平比较差异无统计学意义(P>0.05)。与RG 组比较,HG 组 MIN-6 细胞 p-FoxO1(256)、p-Fox-O1(319)蛋白表达水平升高(P<0.01),而 RG+M 组差异无统计学意义(P>0.05)。与HG组比较,RG+M组MIN-6 细胞 p-FoxO1(256)、p-FoxO1(319)蛋白表达水平均明显降低(均P<0.05)。
2.4 培养 72h时 RG、RG+M、HG、HG+W 组 MIN-6细胞Oct4蛋白表达水平比较 见图6、7。
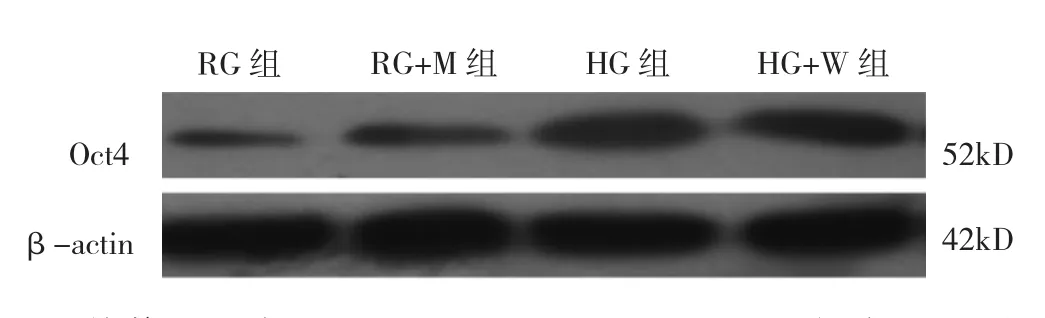
图6 培养72h时RG、RG+M、HG、HG+W组MIN-6细胞 Oct4蛋白表达电泳图
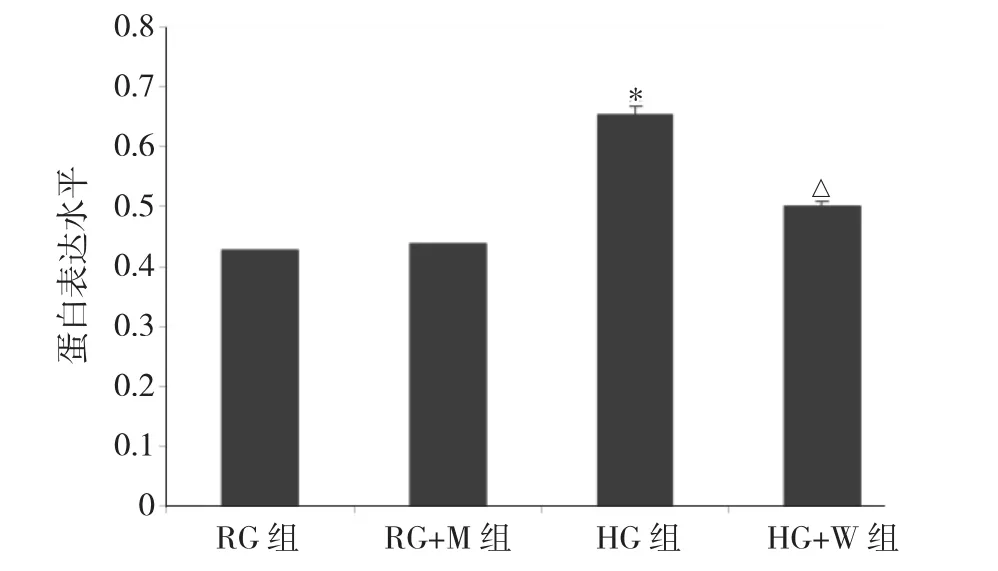
图7 培养72h时RG、RG+M、HG、HG+W 组MIN-6细胞 Oct4蛋白表达水平比较(与RG组比较,*P<0.05;与HG组比较,△P<0.05)
由图 6、7可见,培养 72h时 RG、RG+M、HG、HG+W组MIN-6细胞Oct4蛋白表达水平比较差异有统计学意义(P<0.05)。与RG组比较,HG组MIN-6细胞Oct4蛋白表达水平升高(P<0.05),RG+M组差异无统计学意义(P>0.05)。与HG组比较,RG+M组MIN-6细胞Oct4蛋白表达水平明显降低(P<0.05)。
2.5 培养 72h时 RG、RG+M、HG、HG+W 组 MIN-6细胞PDX1蛋白表达水平比较 见图8、9。
由图 8、9可见,培养 72h时 RG、RG+M、HG、HG+W组MIN-6细胞PDX1蛋白表达水平比较差异有统计学意义(P<0.05)。与RG组比较,HG+W组MIN-6细胞PDX1蛋白表达水平明显降低(P<0.05),RG+M组差异无统计学意义(P>0.05)。与HG组比较,HG+W组MIN-6细胞PDX1蛋白表达水平明显升高(P<0.05)。
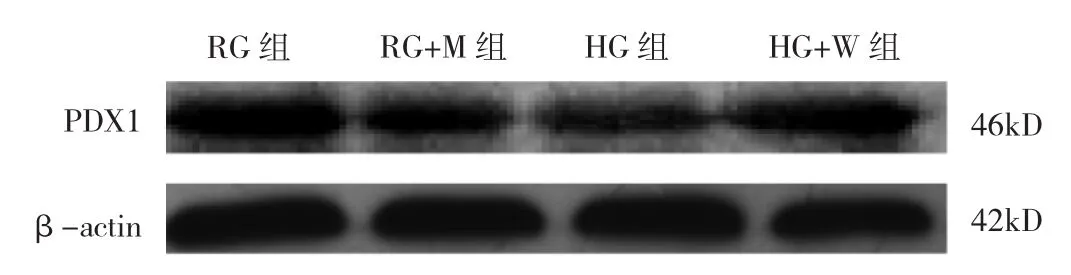
图 8 培养 72h时 RG、RG+M、HG、HG+W 组 MIN-6细胞 PDX1蛋白表达电泳图
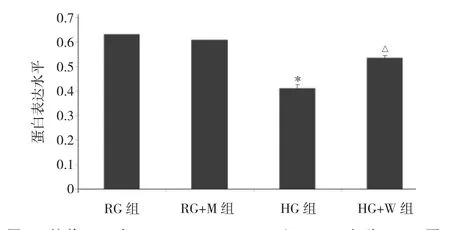
图9 培养72h时RG、RG+M、HG、HG+W组MIN-6细胞PDX1蛋白表达水平比较(与RG组比较,*P<0.05;与HG组比较,△P<0.05)
3 讨论
近30年来,我国糖尿病的发病率逐年上升,已成为继心血管疾病和肿瘤之后的第三大疾病,2007年流行病学调查资料显示,我国20岁以上成年人糖尿病患病率为9.7%,中国成人糖尿病总数达9 240万。2010年中国国家疾病预防控制中心调查显示我国糖尿病患病率为9.7%,再次证实我国可能已成为世界上糖尿病患病人数最多的国家[3]。糖尿病是一组以高血糖为主要特征的临床综合征。高血糖的产生主要是由胰岛β细胞功能缺陷,引起胰岛素相对或绝对不足,以及周围胰岛素敏感组织对胰岛素抵抗引起。过去一直认为胰岛β细胞凋亡是β细胞缺陷的主要形式,但现有研究发现2型糖尿病患者胰岛β细胞去分化比例高达31.9%(非糖尿病患者为8.7%)[4],在2型糖尿病动物模型的胰岛中观察到大量胰岛素表达阴性的细胞,该类细胞能表达嗜铬粒蛋白-A、neurogenin3、Oct4等前β细胞标志物,并观察到了FoxO1的进行性丢失[5]。本研究发现,在高糖培养诱导下,MIN6细胞去分化为表达Oct4的前β细胞,β细胞标志物PDX1表达水平降低。
FoxO1是Forkhead蛋白大家族的一个亚群,主要表达在胰腺β细胞、肝细胞、脂肪细胞,是一种多功能蛋白,参与调节细胞增殖、凋亡、衰老、分化、应激、自噬、代谢。研究发现,FoxO1可抑制胰岛α细胞向β细胞转化、保护β细胞免受氧化应激损伤、维持β细胞终末分化状态以及抑制胰腺祖细胞分化为β细胞[6-9]。FoxO1的活性主要受磷酸化/去磷酸化水平调节[10]。本研究发现,在高糖培养诱导下,MIN6细胞中FoxO1 mRNA、蛋白表达水平无明显变化,但其256及319位点出现磷酸化,通过FoxO1磷酸化酶抑制剂渥曼青霉素抑制FoxO1的磷酸化,去分化的细胞再次分化为表达PDX1的β细胞。这说明FoxO1通过磷酸化与去磷酸化的转换在β细胞去分化中发挥作用。
FoxO1有多个苏氨酸和丝氨酸磷酸化位点,分别为N端的1个苏氨酸和中部的2个丝氨酸位点。无刺激因子时,FoxO1以去磷酸化状态位于细胞核内。当受刺激后,FoxO1发生磷酸化而由核内转运到细胞质中。FoxO1在细胞质和核内穿梭,与14-3-3蛋白密切相关。14-3-3蛋白主要存在细胞核内,可以识别丝氨酸和苏氨酸残基。FoxO1磷酸化后,构象发生改变,与14-3-3蛋白结合,介导了FoxO1的核输出[11-13]。Ser256是核定位关键位点,它的磷酸化与FoxO1的核输出密切相关,Ser319则影响FoxO1的核输出效率[14]。伴随着FoxO1的磷酸化和去磷酸化、与DNA的解离和结合,可以关闭或启动某些基因的表达而产生不同的生理反应。本研究发现FoxO1 256和319位点磷酸化参与了高糖培养诱导的MIN6细胞去分化,但具体机制仍需要进一步探讨。
综上所述,本研究结果显示,高糖可能通过FoxO1 256和319位点磷酸化而参与诱导体外培养小鼠胰岛β细胞发生去分化。
