羟氯喹逆转慢性髓性白血病细胞K562/IMA对伊马替尼耐药的作用机制研究
2019-08-28杨毅李文燕盛泳佳王瑾陈启绪韩晨阳
杨毅 李文燕 盛泳佳 王瑾 陈启绪 韩晨阳
慢性髓性白血病(CML)是造血干细胞异常转化而产生的一种髓系恶性克隆白血病,遗传学特征表现为t(9;22)(q34;q11)易位,产生BCR-ABL融合基因,该融合基因翻译的蛋白属于非受体酪氨酸激酶,其二聚体形式可以导致底物蛋白酪氨酸残基磷酸化,激活多条信息传递途径,干扰细胞的基本活动[1-2]。目前临床治疗CML的方法包括以羟基脲为主要药物的化疗、INF-α以及异基因造血干细胞移植等[3-4]。伊马替尼(IMA)作为选择性的酪氨酸激酶抑制剂,是CML首选靶向治疗药物,对初发慢性期CML患者可达到完全细胞遗传学反应(CCR),1 年无病生存率可达到 100%[5-6]。然而,IMA的耐药现象在临床中也并不鲜见。研究发现,IMA的耐药过程牵涉多种机制,α-1酸性糖蛋白AGP的产生、耐药基因MDR-1的过度表达、BCR-ABL基因扩增或突变是耐药产生的主要原因[7]。因此,如何治疗IMA耐药的CML是当前临床研究的热点。
近年研究发现,细胞自噬性耐药或是耐药产生的一大机制。铂类药物、烷化剂等耐药与细胞自噬的诱导有关,CML化疗常用药物紫杉醇可以通过细胞自噬激活产生耐药[8]。而临床应对此种耐药常常会联合使用自噬抑制剂。研究发现,紫杉醇耐药的CML细胞K562采用羟氯喹预处理,可以显著提高细胞的药物敏感性,机制在于羟氯喹抑制酸性囊泡的产生,间接抑制细胞自噬的发生[9-10]。基于此,本研究将细胞自噬抑制剂羟氯喹联合伊马替尼作用于CML K562/IMA细胞株,观察其对该细胞株耐药的影响,并探讨其作用机制,现报道如下。
1 材料和方法
1.1 材料 CML K562/IMA细胞株(嘉兴市第二医院实验室自备,对10μmol/L的IMA耐药),IMA和羟氯喹标准品(北京中科质检生物技术有限公司,批号7330441、100582),CCK-8检测试剂盒(碧云天生物技术有限公司,批号 C0037),Transwell小室(康宁公司),Annexin V-FITC/PI细胞凋亡双染试剂盒(美国BD公司),单丹磺酰尸胺(MDC)染色试剂盒(北京雷根生物技术有限公司,批号25875),免疫荧光染色试剂盒(碧云天生物技术有限公司,批号 P0179),LC3Ⅰ/Ⅱ、p62、Beclin-1 以及Bax、Bcl-2、Caspase-3、Caspase-9 的单克隆抗体(Cell Signaling Technology公司,批号4108、39749、3495、2772、3498、9662、9502)。电子分析天平(梅特勒-托里多仪器有限公司,型号ME204E),DP11显微镜(日本奥林巴斯公司),PCR仪(型号 BS97MyCycler),Western blot电泳仪(型号1658001),FACS CantoⅡ流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞培养与分组 K562/IMA细胞株复苏后,采用RPMI 1640完全培养基+10%FBS培养,待细胞生长至对数期后,将细胞分为对照组(Con组)、IMA干预组(IMA组)、羟氯喹+IMA干预组(HCQ+IMA组)。Con组为常规培养的细胞,无药物干预;IMA组采用含10μmol/L IMA的培养基培养;HCQ+IMA组采用含10μmol/L羟氯喹的培养基培养(预处理)12h后,再用含10μmol/L IMA的培养基培养。
1.2.2 CCK-8法检测细胞增殖率 将对数生长期的K562/IMA细胞接种到96孔板中,IMA组和HCQ+IMA组采用含10μmol/L IMA的培养基培养。设置时间点为0、6、12、18、24、30、36h,待培养完成后加入 10μl的CCK-8溶液,继续培养4h,用酶标仪在480nm处检测吸光度(A值)。细胞增殖率(%)=[A(加药)-A(空白)] /[A(对照)-A(空白)] ×100%
1.2.3 Annexin V-FITC/PI染色后流式细胞术检测细胞凋亡率 将对数生长期的K562/IMA细胞接种到6孔板中,IMA组和HCQ+IMA组采用浓度为10μmol/L的IMA干预,加药后培养24h,收集细胞后加入Binding Buffer重悬。而后加入Annexin V-FITC液10μl混匀,避光反应10min,再加入10μl的 PI染色避光反应10min,PBS洗去多余染色液后,采用流式细胞仪检测细胞凋亡率。
1.2.4 Transwell小室实验检测细胞侵袭能力 将对数生长期的K562/IMA细胞加入Transwell小室,IMA组和HCQ+IMA组采用含10μmol/L IMA的培养基培养,培养基中不加FBS,而24孔板下室加入完全培养基,培养基含10%的FBS,待培养24h后取出小室,弃去培养基,甲醇固定后用0.1%的结晶紫染色,棉签擦去上层未迁移的细胞后镜下观察。
1.2.5 免疫荧光染色检测细胞自噬激活标志蛋白LC3Ⅰ/Ⅱ表达 将对数生长期的K562/IMA细胞接种到6孔板中,IMA组和HCQ+IMA组采用含10μmol/L IMA的培养基培养,将细胞培养基弃去,用甲醇固定后自然干燥,PBS洗3次,1%的Triton液处理30min,羊血清处理 30min,LC3Ⅰ/Ⅱ一抗(1∶500)稀释后在 4℃下孵育过夜,次日用PBS洗净一抗,二抗标记后晾干封片;使用荧光分光光度计检测荧光强度。
1.2.6 MDC染色检测细胞酸性囊泡 将对数生长期的K562/IMA细胞接种到6孔板中,IMA组和HCQ+IMA组采用含10μmol/L IMA的培养基培养6h后弃去培养基,用去离子水稀释漂洗液 Wash Buffer(1∶1 稀释),细胞用稀释后的Wash Buffer重悬后调整细胞浓度为106/ml,加入MDC染色液染色后室温避光染色30min,染色后用Wash Buffer清洗,滴加细胞液在载玻片上,荧光显微镜下观察,激发波长为355nm,阻断波长为512nm,计染色阳性(黄绿色)细胞数。
1.2.7 Western blot法检测细胞自噬相关蛋白p62、Beclin-1 及凋亡相关蛋白 Bax、Bcl-2、Caspase-3、Caspase-9的表达 将对数生长期的K562/IMA细胞接种到6孔板中,IMA组和HCQ+IMA组采用含10μmol/L IMA的培养基培养24h后收集各组细胞。PBS洗2次后,在冰上加入NP-40裂解液100μl裂解30min,3 000r/min离心后收集上清液;BCA法进行蛋白定量后调整蛋白浓度,根据蛋白分子量分别配置8%~12%的SDS-PAGE凝胶,取蛋白液用5×上样缓冲液Loading Buffer补充体积至20μl,煮沸8min后进行电泳,电压80V,之后转换为120V,将凝胶去除后进行PVDF膜的转膜;采用300mA恒流转膜0.5~2h,PVDF膜使用5%脱脂奶粉封闭2h;TBST稀释一抗,一抗孵育后PVDF膜用TBST洗2次再用辣根过氧化物酶标记的二抗孵育。孵育完成后用化学发光法检测,采用Image Pro-Plus 6.0软件进行光密度分析,以GAPDH为内参,结果以目的蛋白与内参蛋白光密度值比表示。
1.3 统计学处理 应用SPSS 17.0统计软件;计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 3组细胞增殖率比较 见图1。
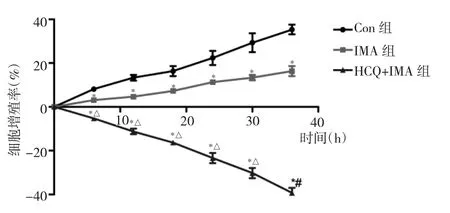
图1 3组细胞增殖率比较(与Con组比较,*P<0.05;与IMA组比较,△P<0.05)
由图 1 可见,培养 6、12、18、24、30、36h 时,3 组细胞增殖率比较差异均有统计学意义(均P<0.05),且HCQ+IMA组<IMA组<Con组(均P<0.05)。Con组细胞0~36h时间段内呈增殖状态,随着时间的延长,细胞增殖率增高;IMA组细胞随着时间的延长,细胞增殖率无明显变化,说明细胞生长受到抑制;HCQ+IMA组细胞随着时间的延长,细胞增殖率出现负增长,且细胞活力逐渐降低。这说明,羟氯喹预处理后,IMA可以明显抑制K562/IMA细胞的增殖。
2.2 3组细胞凋亡率比较 见图2。
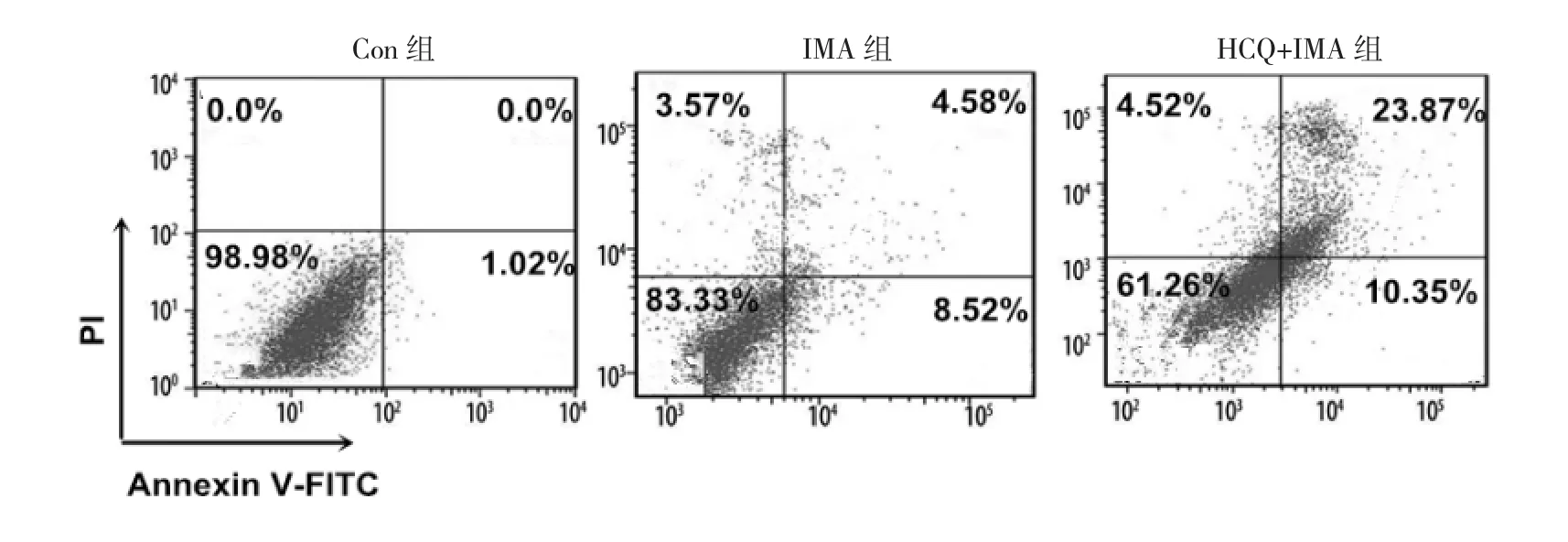
图2 3组细胞流式细胞图比较
由图2可见,Con、IMA、HCQ+IMA组细胞凋亡率分别为(0.98±0.22)%、(15.35±2.14)%、(38.65±5.32)%,3 组细胞凋亡率比较差异有统计学意义(P<0.05),且HCQ+IMA组>IMA组>Con组(均P<0.05)。
2.3 3组细胞侵袭能力比较 见图3。
由图3可见,Con、IMA、HCQ+IMA组细胞迁移数目分别为(59.32±8.32)、(63.22±7.52)、(25.32±5.32)个/视野,3组比较差异有统计学意义(P<0.05);两两比较,HCQ+IMA组<Con组(P<0.05),HCQ+IMA组<IMA组(P<0.05),Con组与IMA组比较差异无统计学意义(P>0.05)。即HCQ+IMA组细胞侵袭能力低于Con、IMA组。
2.4 3组细胞自噬激活标志蛋白LC3Ⅰ/Ⅱ表达情况比较 见图4。
由图4可见,Con组细胞LC3Ⅰ/Ⅱ蛋白为阴性表达,细胞中几乎无LC3Ⅰ/Ⅱ蛋白的表达,说明细胞自噬未激活;IMA组细胞LC3Ⅰ/Ⅱ蛋白荧光强度明显高于Con组;而HCQ/IMA组细胞与IMA组比较,LC3蛋白荧光强度明显降低,说明细胞自噬受到了抑制。
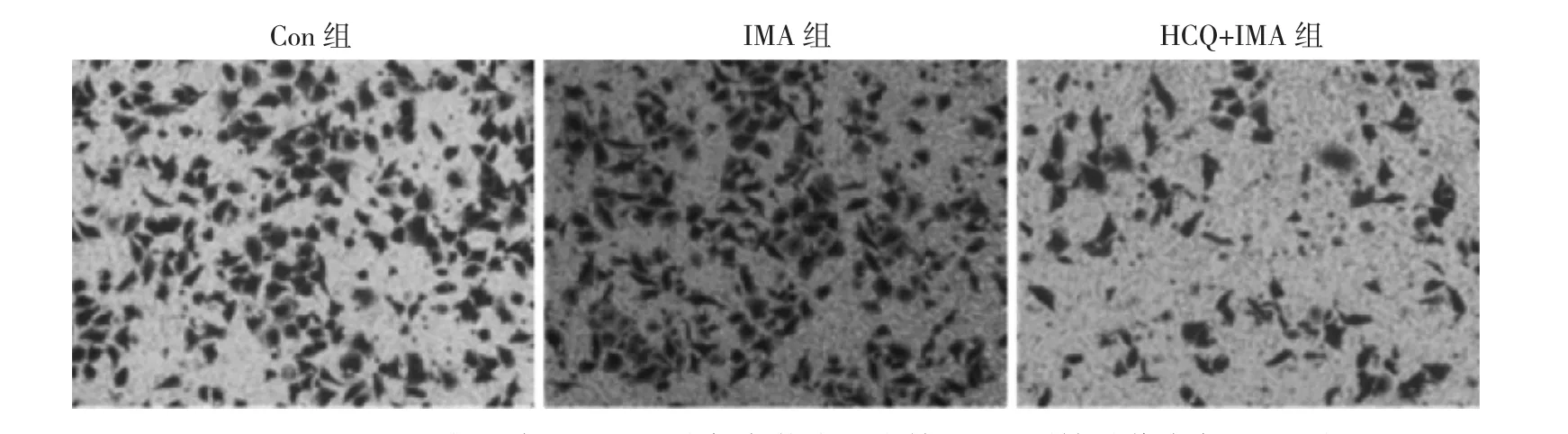
图3 Transwell小室检测3组细胞侵袭能力显微镜下所见(结晶紫染色,×200)
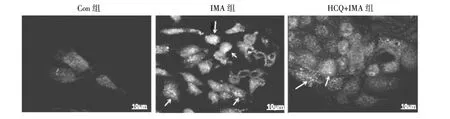
图4 3组细胞自噬激活标志蛋白LC3Ⅰ/Ⅱ表达情况比较(免疫荧光染色,×400)
2.5 3组细胞酸性囊泡染色阳性细胞数比较 见图5。

图5 3组细胞酸性囊泡染色阳性细胞数比较(MDC染色,×200)
由图5可见,Con、IMA、HCQ+IMA组酸性囊泡染色阳性细胞数分别为(16.36±2.56)、(56.35±6.68)、(35.65±3.25)个/视野,3组比较差异有统计学意义(P<0.05),且IMA组>HCQ+IMA组>Con组(均P<0.05)。即羟氯喹干预后可以减少细胞中酸性囊泡的形成。
2.6 3组细胞自噬相关蛋白p62、Beclin-1及凋亡相关蛋白 Bax、Bcl-2、Caspase-3、Caspase-9 表达情况比较见图6-7。
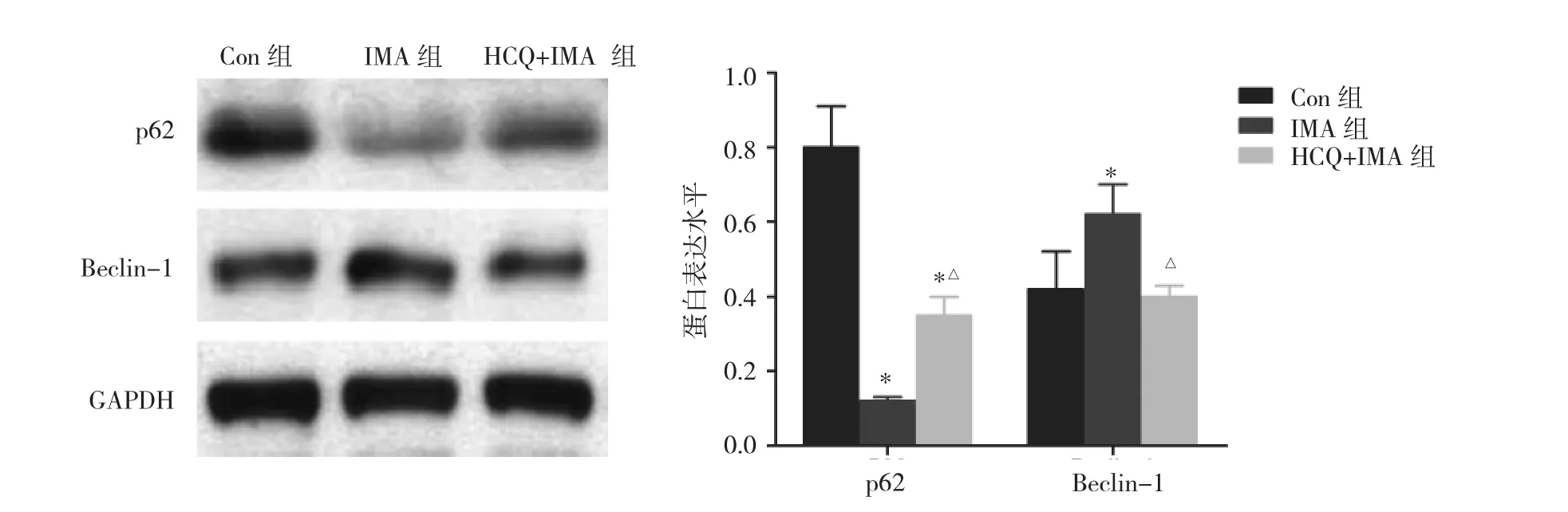
图6 3组细胞自噬相关蛋白p62、Beclin-1表达情况比较(与Con组比较,*P<0.05;与IMA组比较,△P<0.05)

图7 3组细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3、Caspase-9表达情况比较(与Con组比较,*P<0.05;与IMA组比较,△P<0.05)
由图6可见,3组细胞自噬相关蛋白p62、Beclin-1表达水平比较差异均有统计学意义(均P<0.05)。细胞自噬底物蛋白p62表达水平两两比较,Con组(0.80±0.11)>HCQ+IMA 组(0.35±0.05)>IMA 组(0.12±0.11)(均P<0.05);自噬启动调节蛋白Beclin-1表达水平两两比较,IMA 组(0.62±0.08)>Con组(0.42±0.10)、HCQ+IMA 组(0.40±0.03)(均 P<0.05),而 Con 组与HCQ+IMA组比较差异无统计学意义(P>0.05)。由图7可见,3 组细胞凋亡相关蛋白 Bax、Bcl-2、Caspase-3、Caspase-9表达水平比较差异均有统计学意义(均P<0.05)。凋亡蛋白 Bax、Caspase-3、Caspase-9 表达水平两两比较,Con 组(0.32±0.05、0.20±0.03、0.15±0.03)<IMA组(0.52±0.06、0.32±0.05、0.26±0.03)<HCQ+IMA 组(1.15±0.13、0.45±0.06、0.42±0.03)(均 P<0.05);抗凋亡蛋白Bcl-2表达水平两两比较,Con组(0.50±0.05)>IMA 组(0.13±0.02)>HCQ+IMA 组(0.06±0.01)(均 P<0.05)。
3 讨论
20世纪90年代问世的IMA是一种选择性的酪氨酸激酶抑制剂,大量的临床试验已经证明,400mg/d剂量的IMA长期服用可以使得80%以上的初发期CML患者达到CCR,而急性期的患者可以到34%以上,是一种治疗CML的有效药物。但是长期使用IMA,部分患者会出现耐药,这种耐药主要指慢性期患者未出现完全血液学反应或者加速期和急变期患者未有效达到慢性期[11]。对于IMA的耐药,目前临床应对方法十分有限,加大IMA剂量是常用的方法。有研究发现,IMA剂量增加到600mg/d或800mg/d对30%~50%继发性耐药患者有效,但是持续时间较短,且往往还会增加不良反应的发生[12-13],所以该方法的可行性还有待进一步研究。也有研究发现,对于IMA耐药可以采用与信号传导通路的抑制剂联用,比如Ras途径抑制剂、PI3K途径抑制剂等[14],但是该类药物联合使用的作用机制未明,临床推广需要进一步深入的研究。
细胞自噬是细胞适应性生长、分化、凋亡所必须的一种生理现象。在肿瘤组织中,细胞自噬起到双重作用,一方面细胞自噬可以保护正常细胞,抑制肿瘤细胞的生长,另一方面可以抵制外界环境对于肿瘤细胞的损伤,进一步促进肿瘤细胞的生长。近年研究发现,在肿瘤耐药中,细胞自噬起了关键的作用[15-16]。MYC抑制剂预处理人前列腺上皮细胞后,对雷帕霉素不敏感,细胞自噬水平降低[17]。急性淋巴细胞白血病细胞会通过自噬对糖皮质激素产生耐药[18]。而细胞自噬的产生和用药剂量及用药时长有关。有研究发现,小剂量的抗肿瘤药物使用可以使肿瘤细胞迅速启动自噬,细胞通过自噬清除损伤的细胞器等,从而获得更好的抗性[19]。
笔者团队在前期研究中发现,抑制Beclin-1基因的表达可以提高K562/IMA细胞对于IMA的敏感性[20]。这提示,细胞自噬的激活在K562细胞对IMA耐药中起一定的作用。羟氯喹是一种临床常用的类风湿性关节炎治疗药物。本研究结果显示,羟氯喹可以抑制K562/IMA细胞自噬过程中酸性囊泡的产生,抑制自噬流的传递。本研究将羟氯喹联合IMA作用于K562/IMA细胞,结果发现,羟氯喹预处理后可以显著提高细胞对于IMA的敏感性,细胞凋亡率增高,同时增殖率下降,相比单用IMA具有明显差异。IMA处理K562/IMA细胞可以提高LC3Ⅰ/Ⅱ蛋白的表达。LC3Ⅰ/Ⅱ是自噬激活的标志蛋白,用于自噬体的形成,而使用羟氯喹预处理后,LC3Ⅰ/Ⅱ蛋白的表达明显受抑制。p62是自噬底物蛋白,在自噬发生后表达降低,而羟氯喹预处理后可以提高K562/IMA细胞p62表达水平;同时,细胞凋亡相关蛋白表达水平提高。这可以说明,K562/IMA细胞启动了凋亡程序,IMA在耐药株中重新获得了细胞杀伤的能力。
综上所述,本研究结果显示,羟氯喹可以逆转IMA耐药的CML K562细胞对IMA的敏感性,其作用机制或与抑制细胞自噬有关。
