纤维蛋白胶复合脱蛋白小牛骨的成骨效果观察
2019-08-28杨帆陈建萍王林红
杨帆 陈建萍 王林红
各类牙列的缺损和缺失大都同时伴有牙槽骨的缺损以及骨量不足等情况,通常需要进行骨增量手术以获得种植修复足够的骨量。目前,临床上有多种多样的骨替代品、屏障膜以及生长因子制剂等用来促进成骨[1]。自体骨被认为是骨增量的最好材料,但使用自体骨需要增加手术部位、存在潜在并发症、延长手术时间等,大大限制了其临床应用[2]。脱蛋白小牛骨(deproteinized bovine bone mineral,DBBM)是目前临床使用最为广泛的一类人工骨增量材料,且具有良好的引导成骨性能及可靠的临床效果。但DBBM呈颗粒状难以塑形,而骨缺损区域大多形态不规则;且DBBM不具备任何的机械强度,移植后在口腔内受黏膜及口唇肌肉活动、义齿的压迫等容易发生变形、移位、散落在软组织中以及被吸收等。因此,寻找可促使颗粒状骨增量材料任意塑形,有一定机械强度且不阻碍其成骨效果的支架材料,可有效解决骨增量材料的缺陷,显著提高骨增量手术的临床效果。
纤维蛋白胶(fibrin glue,FG)是临床上常用的一种生物粘合剂,具有较强的粘结能力,能够止血、促进组织修复、血管再生,具有极强的可塑性、生物相容性,常作为载体材料携带细胞和生长因子在体内发挥重要的生物学功能[3-4]。临床上可以通过调整纤维蛋白原和凝血酶的浓度来调整FG的凝固时间,配置成可注射型的纤维蛋白液体[5],凝固后可以任意塑形并具有一定的粘弹性,可作为一种支架材料填充任何几何形状的骨缺损间隙[1,6],但是,FG 的降解速度较快、力学性能低,因此往往需要联合使用其他材料来克服这些缺陷。研究发现,FG复合骨髓间充质干细胞及β-磷酸三钙(β-TCP)可促进修复股骨缺损[7];FG作为携带骨形态发生蛋白-2(BMP-2)的载体,可防止BMP-2快速释放同时促进成骨[8];FG与一些骨增量材料联合使用,可发挥理想的骨增量效果[9]。目前临床上较为广泛应用的DBBM类骨增量材料是进口的Bio-oss和国产的海奥骨修复材料。但这类DBBM材料本身只有骨引导作用,而联合应用DBBM能否增强FG骨引导和骨诱导的双重性能目前仍不明确。基于此,本实验拟通过将两种不同的DBBM与FG复合来修复兔颅骨极限骨缺损,通过微计算机断层扫描(Micro-CT)以及硬组织切片染色观察FG复合DBBM的成骨效果,现报道如下。
1 材料和方法
1.1 材料和仪器 骨增量材料:Bio-oss(瑞士Geistlish公司),海奥骨修复材料(山东正海生物公司,HA)。FG(上海护固莱士公司),HKM种植机(德国HKM公司),16∶1 Nurvag种植机手机(瑞士 Nurvag公司),Micro-CT机(瑞士SCANCO公司),1600P型硬组织切片机(德国Leica公司)。
1.2 方法
1.2.1 两种DBBM/FG复合材料构建 FG主要由纤维蛋白原、凝血酶、无菌水和氯化钙4个组分组成,用5ml无菌水溶解200mg纤维蛋白原,置于37℃水浴中孵化15~20min至完全溶解,配比成25~45mg/ml的纤维蛋白原溶液。将凝血酶溶解于40mmol/L氯化钙溶液中,制备成50U/ml的凝血酶溶液。将配比好的纤维蛋白原溶液与凝血酶溶液按1∶1等体积混合好后立即分别与Bio-oss骨粉颗粒及HA骨粉颗粒按粉末/液体质量体积比(g/ml)1∶1[10]在 48 孔板内混合,并搅拌均匀,制备成直径约10mm的Bio-oss/FG复合材料及HA/FG复合材料。
1.2.2 实验分组与动物实验 实验动物为成年健康新西兰兔24只(由浙江中医药大学动物实验室提供),体重2.5~3.0 kg,雌雄不限,按随机数字表法分为6组:Bio-oss组、Bio-oss/FG组、HA组、HA/FG组、FG组和空白组,每组4只。新西兰兔术前4h禁食、禁水,标记后称量体重,采用3%戊巴比妥钠0.5ml/kg耳缘静脉注射联合0.5ml/kg盐酸赛拉嗪注射液肌肉注射麻醉;待麻醉起效后,常规消毒,铺巾,沿兔颅骨矢状缝位置作长约3~4cm纵切口,直达骨面,剥离黏骨膜,用种植机及直径10.5mm的环形钻制备直径约10mm的圆形骨缺损区,每只新西兰兔制备2个骨缺损区。备洞过程中使用4℃的0.9%氯化钠溶液持续冷却,贯穿全层至硬脑膜,并保持硬脑膜的完整性。按照分组植入相应材料,止血后分层对位缝合,待新西兰兔复苏后送回饲养箱,术后即刻、24h、48h分别肌肉注射青霉素8万U预防感染。术后4、8周分批处死新西兰兔,取出骨缺损区及其组织,4%多聚甲醛固定,每个时间点留取每组骨片标本各4份,实验步骤符合动物实验相关的伦理要求进行。
1.3 观察指标
1.3.1 Micro-CT检查 所有骨片标本应用Micro-CT机扫描。扫描条件设置为:电压50kV,电流200μA,使用0.5mm铝制过滤器,360°旋转,空间分辨率为18.26μm。数据用图像分析软件(CT-analyzerTM,Skyscan)选择直径12mm、高度5mm的植入圆柱体作为感兴趣区域(ROI)。利用 Microview 软件(GE Healthcare Bio-Sciences Corp.)对扫描的骨片进行高分辨率重建,显示植入物的新生骨形成情况,计算相对骨体积(BV/TV)。
1.3.2 硬组织切片染色 所有骨片标本在Micro-CT扫描后制备硬组织切片,标本先用梯度乙醇(80%~100%)进行脱水后,渗透,包埋。然后将标本垂直于短轴锯成10~13片100~200μm厚的切片,然后手工磨片,最后完成的切片厚度30~50μm。按照标准程序进行Mc-Neal染色。每张切片随机取5个视野,在显微镜下观察其成骨情况。
1.4 统计学处理 应用SPSS 20.0统计软件;计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;P<0.05为差异有统计意义。
2 结果
2.1 6组新西兰兔骨片标本Micro-CT下新生骨形成情况比较 6组新西兰兔术后4、8周骨片标本Micro-CT横断面三维重建结果见图1。术后4周,空白组中可见少量新生骨形成,且新生骨均出现在缺损周围与颅骨相接处,而FG组中四周新生骨形成较少;术后8周,空白组颅骨缺损并不能完全愈合,而FG组新生骨的面积范围相对于空白组更多。Bio-oss组与Bio-oss/FG组在术后4周及术后8周时新生骨形成情况比较并没有很大的差异,但术后8周的Bio-oss组、Bio-oss/FG组比术后4周时的新生骨密度高;而HA组与HA/FG组结果相反,术后8周时HA/FG组较HA组新生骨密度低。对于FG组和空白组,骨缺损修复开始于缺损周围,而Bio-oss组及其他各组骨修复开始于缺损周围及缺损中间骨植入物充填区。

图1 6组新西兰兔骨片标本Micro-CT横断面三维重建图
对骨缺损区行Micro-CT定量分析,术后4周时,6组新西兰兔骨片标本BV/TV值比较差异有统计学意义(P<0.05),Bio-oss/FG组的BV/TV值高于Bio-oss组,HA/FG组的BV/TV值高于HA组,差异均有统计学意义(均P<0.05),且Bio-oss/FG组、HA/FG组均明显高于FG组和空白组,差异均有统计学差异(均P<0.05)。术后8周时,6组新西兰兔骨片标本BV/TV值比较差异有统计学意义(P<0.05),但Bio-oss/FG组的BV/TV值与Bio-oss组比较差异无统计学意义(P>0.05),HA/FG组的BV/TV值与HA组比较差异亦无统计学意义(P>0.05),见表 1。
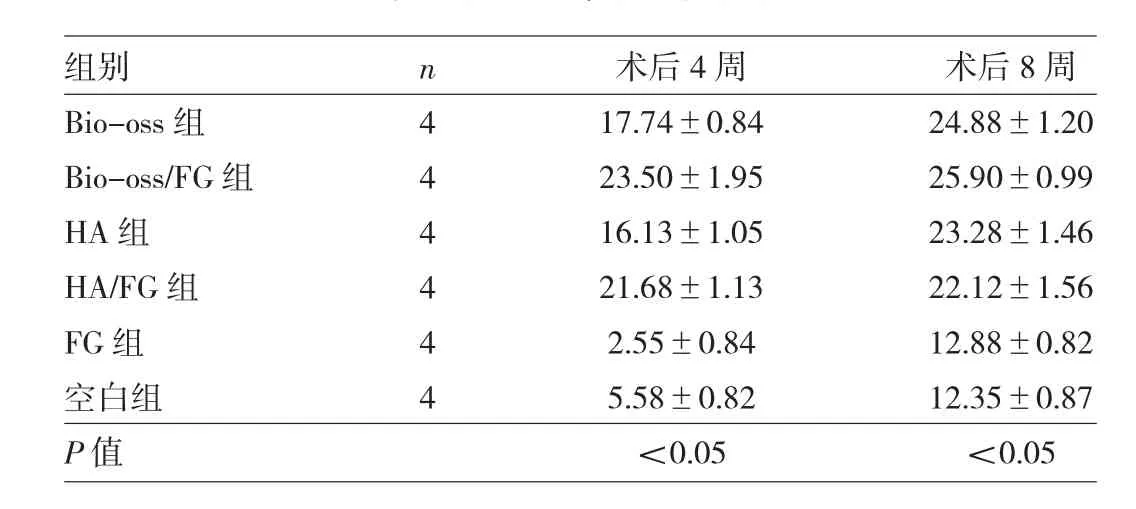
表1 6组新西兰兔骨片标本Micro-CT定量分析结果(BV/TV值)比较(%)
2.2 6组新西兰兔骨片标本硬组织切片染色下新生骨形成情况比较 6组新西兰兔骨片标本术后4、8周时硬组织切片染色结果见图2。Bio-oss组术后4周时,多数骨粉颗粒周围可见少量新生骨,部分骨粉颗粒被纤维结缔组织包绕;术后8周时,骨粉颗粒周围纤维结缔组织数量较少,多数被新生骨围绕,相互联结成网状或片状。Bio-oss/FG组术后4周时,多数骨粉颗粒表面被纤维结缔组织包绕,骨粉表面直接成骨较单纯Bio-oss组数量少,但靠近硬脑膜处可见较多新生骨;术后8周时,骨粉颗粒周围新生骨数量明显增加,骨粉颗粒周围纤维结缔组织数量极少,基本上完全被新生骨围绕,相互联结成网状或片状。HA组术后4周时,骨粉颗粒形状大小各不一,部分颗粒表面可见新生骨形成;术后8周时,新生骨的数量明显大于纤维结缔组织,大多数颗粒上的骨陷窝内充满着骨细胞,有些颗粒边缘不规则,呈锯齿状,并可见到破骨细胞的存在。HA/FG组术后4周时,骨粉颗粒周围及中间均可见较多的新生骨形成;术后8周时HA颗粒形状极为不规则,颗粒大部分被吸收,被新生骨质代替,骨陷窝内充满着成骨细胞及破骨细胞。FG组术后4周时,在骨缺损交界面有少量的反应性新生骨形成,新生骨生成的厚度明显薄于缺损区域原有的骨组织厚度,并且其厚度越往缺损区域中间越薄。空白组与FG组类似,在骨缺损交界处有少量新生骨形成,新生骨厚度明显薄于原有骨组织厚度,并且其厚度越往缺损区域中间越薄。
3 讨论
本实验通过兔颅骨极限骨缺损模型观察两种不同的DBBM与FG复合后的成骨效果,结果发现单纯FG并不能促进成骨,FG与两种不同的DBBM复合后在早期(术后4周)能促进成骨,但在术后8周时效果与单纯应用DBBM类似。另外,FG与颗粒状的DBBM复合后,有较好的塑形作用,可以将骨粉颗粒紧密地连接固定在一起并在骨缺损区域维持一定的形状,防止骨粉颗粒发生移位、散开,有效的提高了骨粉颗粒的力学性能[11]。
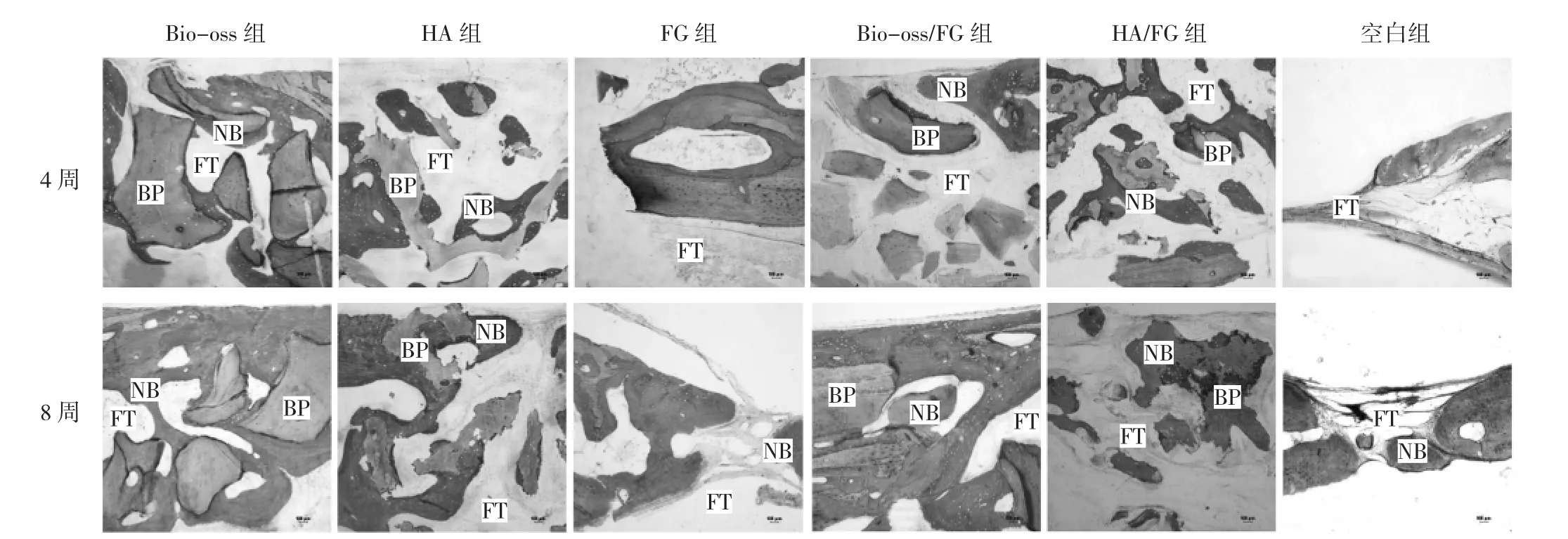
图2 6组新西兰兔骨片标本术后硬组织切片染色情况比较(NB:新生骨;FT:纤维结缔组织;BP:骨粉颗粒;Mc-Neal染色,×40)
本实验结果显示,两组DBBM/FG成骨效果无统计学差异,在术后4周时均有成骨促进作用,但在术后8周时并没有较大的作用。分析原因可能是因为FG的降解速度大约为10~14d左右[12],在这2周内,DBBM颗粒周围黏附的FG发挥了其生物学作用,促进了微血管的生成,微血管的生成同时也可以促进硬脑膜表面的骨膜下成骨[13-14]。另外,FG有骨诱导作用,能诱导周边组织中的骨原细胞、成骨前体细胞,趋化、定性分化为成骨细胞[15];因此,在早期FG有促进成骨的作用。但到了术后8周的时候,FG已经完全降解,不再有生物学作用[12]。DBBM的成骨方式是颗粒表面直接引导成骨,颗粒表面有较多的新生骨生成,而DBBM/FG颗粒表面因为FG的黏附并没有很多的颗粒表面的直接成骨,甚至反而可能阻止了DBBM颗粒表面的直接成骨作用[16]。另一个原因可能是术后8周时骨粉颗粒之间原先被FG占据的空间因为FG的快速吸收而致骨粉颗粒之间的间隙增大,容易被周围的纤维结缔组织长入,不能够维持成骨所必需的空间。因此,两组DBBM/FG并没有表现出比单纯DBBM组更好的成骨作用。
另外,目前临床关于FG是否能促进成骨仍然是一个有争议的话题。不同品牌、不同浓度的纤维蛋白原与凝血酶配比、与成骨材料的不同配比浓度等条件均会影响FG的成骨效果[3]。有研究指出,在Bio-oss颗粒中添加纤维蛋白后会导致骨与生物材料之间的组织接触减少,影响犬下颌骨缺损的修复[17]。Bosch等[18]指出异种纤维蛋白在修复骨愈合过程中会由于局部的免疫反应而影响成骨,而同源纤维蛋白促进毛细血管和结缔组织细胞的生长而加速新骨形成。也有研究认为高浓度纤维蛋白原(35~55mg/ml)会阻止细胞的迁移、浸润并导致骨延迟愈合[19]。
本实验同时也比较了两种不同的DBBM的成骨效果,结果显示Bio-oss/FG和HA/FG复合材料均具有良好的骨修复效果,两组复合材料的成骨效果在术后4、8周时BV/TV值比较均无统计学差异。Bio-oss和HA的主要成分都是羟基磷灰石,主要区别是Bio-oss是完全脱蛋白小牛骨,只保留了无机成分;而HA是部分脱蛋白小牛骨,保留了原骨松质中的Ⅰ型胶原蛋白成分。Bio-oss作为支架材料仅具有骨引导效果,其成骨方式是骨颗粒周边直接引导成骨,颗粒与新生骨组织紧密接触,而Bio-oss颗粒本身似乎很难被替代,最终形成颗粒与新生骨完全融合在一起的新生骨组织。在HA组,因为HA组颗粒里面含有Ⅰ型胶原蛋白及β-TCP,FG的降解同时也伴随着胶原和β-TCP的降解,在硬组织切片上有些区域可见新生的类骨质沉积于新骨表面或HA颗粒表面,大多数HA颗粒上的骨陷窝内充满着骨细胞,有的HA边缘不规则,呈锯齿状的吞蚀现象,并可见到破骨细胞的存在,最后HA颗粒部分被吸收并且与新生骨组织完全融为一体。
综上所述,本实验结果显示FG与颗粒状的DBBM复合,可将骨粉颗粒紧密的连接在一起,有很好的塑形作用,而且在短期内有促进成骨作用,同时不影响其长期的成骨作用,因此临床上可根据具体情况选择性应用FG。
