抗SOX1抗体阳性副肿瘤性小脑变性1例并文献复习
2019-08-28金梦华白树风翟明明程丽妞
金梦华, 白树风, 翟明明, 程丽妞
副肿瘤综合征(paraneoplastic neurologic syndrome,PNS)是指在恶性肿瘤患者体内,由肿瘤细胞产生的抗体或介导的细胞免疫作用于远离肿瘤原发部位或转移部位的器官或组织而导致的一系列神经系统功能障碍的疾病[1,2]。副肿瘤综合征发病率低,仅见于1%~3%的肿瘤患者[3],早期表现不典型,极易造成漏诊和误诊。我们报道1例曾被误诊为视神经脊髓炎,但最终被确诊为副肿瘤性小脑变性的患者。患者以“头晕、视物不清、行走不稳”为主要临床表现,通过血清查出抗SOX1抗体阳性,结合患者病史及血清神经特异性烯醇化酶升高,考虑伴有肺部肿瘤的副肿瘤综合征可能性极大,肺部CT发现肺占位性病灶,并经活检证实为小细胞肺癌,最终确诊为副肿瘤性小脑变性。抗SOX1抗体阳性的副肿瘤性小脑变性临床上较为少见,尚未见中文的个案报道。患者从出现临床症状,到最终诊断为副肿瘤性小脑变性经历了2 m余的时间,所以我们希望通过对该例患者临床资料分析和总结,提高对该类疾病的认识。
1 临床资料
1.1 病例介绍 患者,男,53岁。以“头晕、行走不稳2 m,视物不清1 m,加重15 d余”为主诉入院。入院前2 m患者出现头晕症状,呈间断性,伴行走不稳,能独立行走,不伴视物旋转、恶心、呕吐等症状,至当地县医院给予药物治疗(具体不详),头晕好转。入院前1 m患者晨起后出现视物不清,头晕及行走不稳逐渐加重,行走需搀扶,再次至当地县医院,完善头部核磁共振检查未见明显异常。给予“尼麦角林、醒脑静颗粒”等药物治疗,效果欠佳。转至某三甲医院,行颈椎、胸椎核磁共振示:颈椎退行性变。视觉诱发电位示右侧中枢病损。诊断考虑视神经脊髓炎可能性大,给予甲强龙500 mg/d冲击治疗5 d,头晕、视物不清好转出院。入院前15 d行走不稳症状进行性加重,不能独立行走,伴言语不清、饮水呛咳。遂至我院住院。既往体健,吸烟史30 y余,戒烟1 m,家族史无特殊。神经系统查体:意识清楚,构音障碍,双眼可见水平及垂直眼震,左眼外展欠充分,右眼各方向活动充分,双侧咽反射消失,余颅神经查体无异常。双上肢肌力5级,双下肢肌力5-级,肌张力正常。双侧腱反射(),双侧病理征(-)。双侧指鼻试验、跟-膝-胫试验辨距不良。深浅感觉对症存在。闭目难立征不合作。脑膜刺激征(-)。SARA评分23分。
1.2 辅助检查
1.2.1 化验 血常规、尿常规、血凝、肝肾功能、电解质、血沉、超敏C反应蛋白均基本正常。肿瘤标志物示:CA125、CA199、CEA均正常,入院时神经元特异性烯醇化酶18.74 ng/ml(正常值:0.00~16.30 ng/ml)。腰椎穿刺:脑脊液压力90 mmH2O,脑脊液常规检查:细胞总数 0.0020×109/L、白细胞数 0.000×109/L,脑脊液生化:葡萄糖3.88 mmol/L、氯125.00 mmol/L、脑脊液蛋白562.00 mg/L。外院送检血清抗SOX1抗体阳性,血清及脑脊液抗Hu抗体、抗YO抗体、抗Ri抗体、抗CV2抗体、抗Amphiphysin抗体均为阴性。自免脑相关脑脊液抗体及血清检测均为阴性。视觉诱发电位正常。神经节苷脂抗体阴性。术后1 m复查神经元特异性烯醇化酶11.77ng/ml。
1.2.2 影像学检查 头部核磁共振示:小脑未见明显异常信号(见图1)。胸部CT示:左肺上叶舌段软组织结节,考虑肺癌,建议活检(见图2)。患者肺部结节活检示:小细胞肺癌(见图3)。全身PET/CT示:T5、右侧胸锁关节放射性增高。
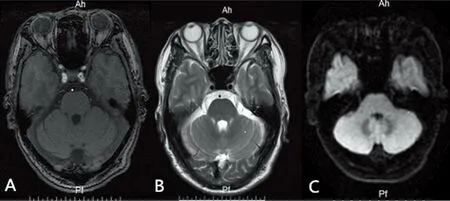
A:T1WI;B:T2WI;C:DWI
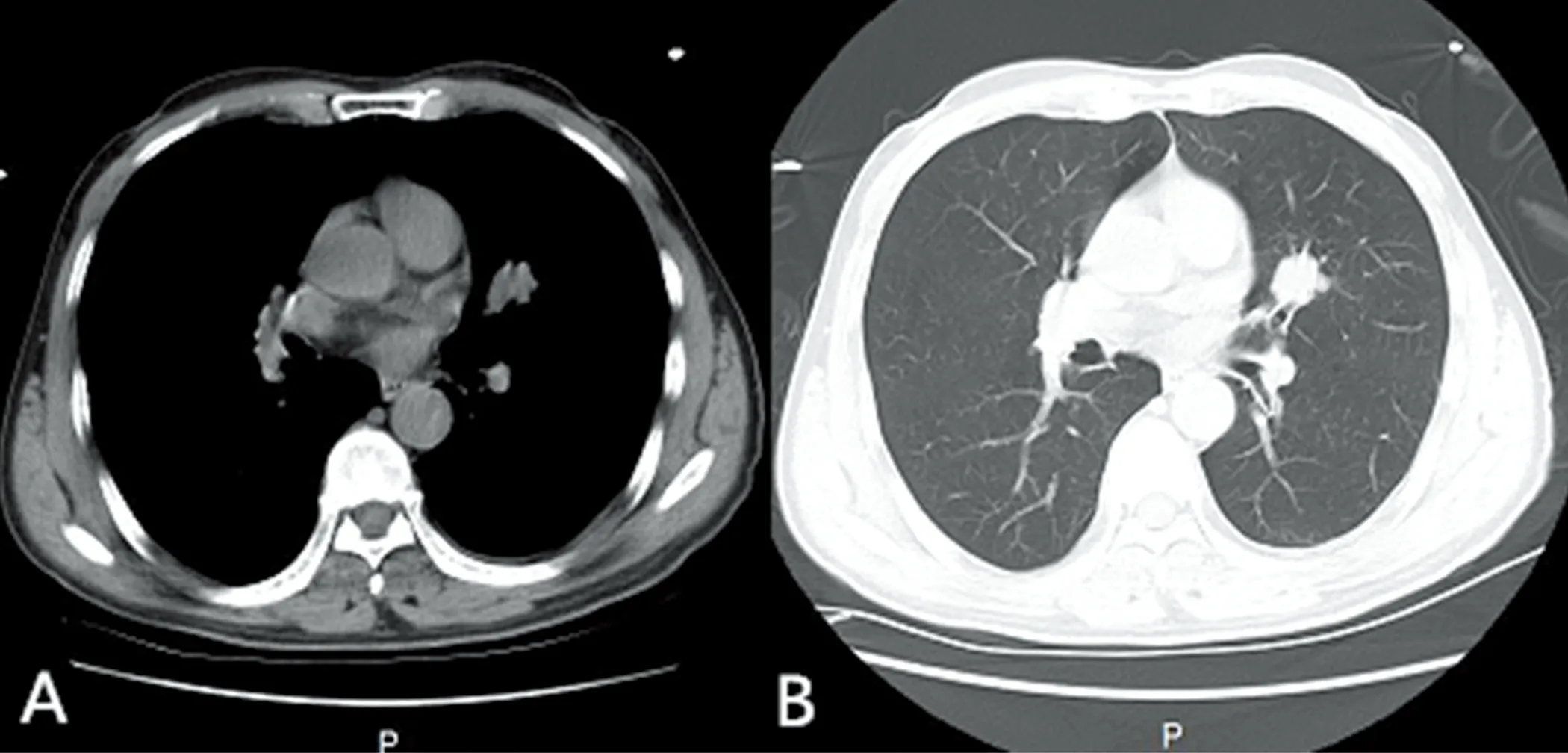
图2 肺CT示左肺上叶舌段占位性病变
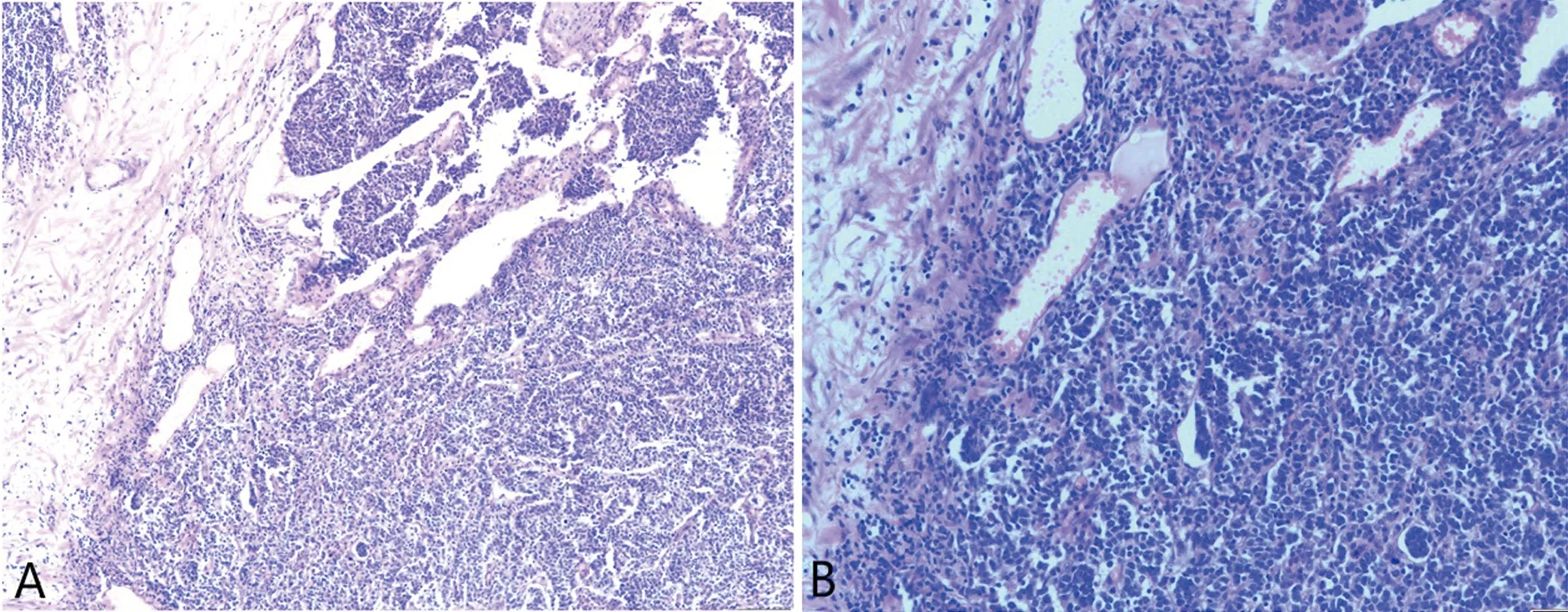
A:HE染色×10;B:HE染色×20
1.3 治疗及转归 患者在我们神经内科给予丙种球蛋白(400 mg·kg·d)静脉点滴5 d,遂转胸外科行胸腔镜肺穿刺活检及左上肺癌根治术,并于术后1 m给予奈达铂(80 mg·m2·d)联合依托泊苷(50 mg·m2·d)共5 d化疗一次,术后3 m随访,言语不清同前,卧床,SARA评分30分,患者由于经济原因未再行化疗。
2 讨 论
副肿瘤病变可累及神经系统的任何部位例如中枢神经、周围神经、神经-肌肉接头和肌肉[4]。副肿瘤性小脑变性(Paraneoplastic cerebellar degeneration,PCD)是副肿瘤综合征的常见亚型之一,以小脑共济失调亚急性发作和进行性加重为主要临床表现的癌性神经系统并发症,是涉及中枢神经系统的危害最大的PNS[5]。PCD最多见于小细胞肺癌,其次是卵巢癌、乳腺癌及霍奇金淋巴瘤[6]。PCD起病多早于肿瘤,60%患者在原发肿瘤被发现前数周或数月出现小脑症状,主要表现为小脑性共济失调、眩晕、构音障碍、眼球震颤[7],小脑性共济失调在数周或数月内进行性加重,最终导致患者卧床不起。早期脑CT、MRI检查多为正常,仅18F-脱氧葡萄糖(18F-FDG)PET显像提示小脑葡萄糖高代谢[8]。晚期MRI可见脑干、小脑萎缩,(18F-FDG)PET检查示小脑低代谢[9,10]。脑脊液压力不高,常规、生化检查正常或蛋白轻度增高。本例报告中的患者即亚急性起病,进展性病程,临床表现为共济失调、眼球震颤、构音障碍、眩晕、视物不清。该例患者临床表现完全符合亚急性小脑变性这个经典综合征的症状。
PNS的相关抗体分为针对细胞内、硬膜上抗原的神经细胞内抗原抗体和针对抗突触受体及其他神经元细胞表面蛋白的神经细胞表面抗体[11]。与PCD相关的抗体有近30余种。经典抗体抗Yo抗体、抗Tr抗体、抗Hu抗体、抗Ma抗体阳性在PCD的诊断中具有重要意义[6,12,13]。2005年Graus等在小细胞肺癌相关的PNS患者血清中发现了一种能特异结合小脑浦肯野细胞层Bergmann星形胶质细胞核的自身抗体,将其命名为抗胶质细胞核抗体(anti-glial nuclear antibody,AGNA)[14],随后研究发现SOX1为AGNA相应的抗原。大约22%~32%的小细胞肺癌患者抗SOX1抗体阳性[15,16],Sabater等研究表明在小细胞肺癌存在的情况下,SOX1抗体的产生是由于对细胞膜离子通道的自身免疫反应增强所致[17]。Titulaer等提出SOX1抗体可作为Lambert-Eaton肌无力综合征(Lambert-Eaton Myasthenic Syndrome,LEMS)合并小细胞肺癌患者的独立预测因素,但该抗体阳性与患者生存率无关[18,19]。本次报道的患者抗SOX1抗体阳性,NSE升高,高度怀疑相关肿瘤为肺癌,最终经肺占位活检证实为小细胞肺癌。在血清或脑脊液中检测相关抗体不仅为寻找潜在肿瘤提供指导,而且也为接下来的检查及治疗指导方向,提高副肿瘤综合征的诊断水平。
目前存在证据支持PCD发病机制与神经系统自身免疫有关[20]。PCD病理学特点为小脑浦肯野细胞大量丢失,胶质细胞增生,深部血管周围淋巴细胞浸润[21]。副肿瘤综合征的诊断标准参考2004年国际神经学家小组制定的PNS诊断标准[22]。确诊标准:(1)一种神经综合征(经典或非经典),具有特征良好的硬脑膜抗体(anti-Yo,Hu,Ri,CV2,Ma2,或两栖动物蛋白)的典型综合征,伴或不伴癌症;(2)一种经典综合征,在诊断出神经症状后5 y内发展为癌症;(3)一种非经典综合征,有单抗体(经典或非经典),在诊断神经疾病后5 y内发展为癌症。本例报道的患者表现为典型的小脑综合征,随着抗SOX1抗体与肺癌的发现,本病例符合PCD的确诊标准。
目前对于PNS的治疗主要包括潜在肿瘤治疗、免疫抑制治疗及对症支持治疗。Ronnyson等认为对细胞内抗体相关的副肿瘤综合征,与细胞表面抗体相关的副肿瘤综合征治疗方面并不完全一致。对细胞内抗体相关的副肿瘤综合征早期发现肿瘤并治疗为最有效的治疗方法[11]。Graus等研究表明肿瘤治疗是病情改善或稳定的独立预测因子[23]。对尚未检测到肿瘤或肿瘤治疗后临床症状未改善患者,大多数临床医生认为进行免疫抑制治疗也是合理的[11]。而细胞表面抗体相关副肿瘤综合征对于免疫抑制剂的反应相对较好。急性期首选一线免疫抑制治疗,(皮质类固醇、静脉注射免疫球蛋白、血浆交换)。一线免疫抑制治疗效果不佳,可选用二线免疫抑制治疗(环磷酰胺、环孢素、利妥昔单抗)。Titulaer等研究表明接受免疫抑制治疗和肿瘤切除的抗NMDAR脑炎患者,24 m后随访时81%患者临床症状出现明显改善[24]。据报道,在PCD早期使用IVIG联合类固醇可能有帮助[25]。
总之,在我们临床工作中当患者出现头晕、视物不清、行走不稳、眼震等症状,辅助检查排除其他疾病(小脑梗死、感染及中毒性小脑病变、小脑转移瘤、遗传性小脑变性等)后,要考虑到副肿瘤小脑变性的可能。怀疑PNS的患者,完善肿瘤标志物检查,NSE升高的患者,尽早完善肺部CT,并尽早完善副肿瘤相关抗体(血清及脑脊液),常见抗Yo抗体、抗Tr抗体阴性时,要考虑到抗SOX1抗体。必要时行FDG-PET检查筛查潜在肿瘤。原发肿瘤可在PNS后数年才出现,对未检测出肿瘤的患者,应密切监测,定期随访。尽早明确诊断,争取更多时间治疗肿瘤,减少对神经功能的损害。
