miRNA-29a- 3 p通过靶向PROM 1在喉癌细胞增殖中的作用研究
2019-08-26张东军吴文斌涂玲丽刘志国杜景云
张东军,吴文斌#,涂玲丽,刘志国,杜景云
宜都市中医医院1耳鼻喉科,2肿瘤科,3病理科,湖北 宜都443300
喉癌是头颈部肿瘤中一种常见的肿瘤,具有较高的发病率和病死率,是恶性程度最高的肿瘤之一[1-2]。喉癌的病死率在医疗系统发达的国家中逐年下降,但在发展中国家仍然较高[3]。此外,喉癌引起的一系列并发症包括呼吸困难、咳嗽、吞咽困难等问题严重影响着患者的生活质量及疾病预后[4],而且分级较高的喉癌患者的诊断和治疗仍存在较多的临床难题[1,5-7]。因此,阐明喉癌的分子发病机制对于寻找新的治疗策略非常重要。微小RNA(microRNA,miRNA)是一类非编码的小分子RNA,长度为20~23个核苷酸[8],通过特异性结合或切割信使RNA(messenger RNA,mRNA)或抑制其翻译发挥基因表达调控的重要作用[9]。针对喉癌基因组的了解有助于找到新的治疗靶点并了解该疾病的分子病理学。在人喉癌研究中,已有报道多种miRNA在疾病进展过程中的异常表达[5,10-12]。有研究表明,miRNA-29a-3p在胃癌中可抑制肿瘤细胞的增殖[13],但其在喉癌中的作用尚不清楚。本研究通过检测喉癌组织和细胞系中miRNA-29a-3p的表达情况及其对喉癌细胞系增殖和凋亡的影响,证实miRNA-29a-3p在喉癌中的作用。另外,在前期工作中,通过数据库筛查发现prominin 1(PROM1)可能是miRNA-29a-3p的潜在靶基因。因此在本研究中将进一步通过生物信息学分析并验证miRNA-29a-3p与PROM1的靶向作用,从而为喉癌的诊断治疗提供新的靶点和理论依据。
1 材料与方法
1.1 细胞培养
正常的鼻咽上皮细胞系NP69以及喉癌细胞系TU212、M4E、M2E和HEP-2均购自中国科学院上海分院细胞库。喉癌细胞系在低糖的DMEM培养基(购自美国Invitrogen公司)中培养,补充含10%胎牛血清(fetal bovine serum,FBS)(购自美国Hy-Clone公司)和1%青霉素/链霉素(购自美国Invitrogen公司);正常鼻咽上皮细胞系NP69在含10%FBS和1%青霉素/链霉素的RPMI1640培养基中培养;所有细胞均在37℃、5%CO2培养箱中培养。
1.2 实时定量聚合酶链反应(polymerasechain reaction,PCR)检测miRNA-29a- 3 p表达情况
使用Trizol试剂(购自美国Invitrogen公司)按照说明书从细胞中提取总RNA。之后,取出2 μg RNA并用DNA酶处理,去除污染的DNA,随后利用逆转录试剂盒(购自美国Promega公司)将其逆转录成cDNA。使用RNASYBR®PCR Kit试剂盒(购自日本Toyobo公司)定量检测miRNA-29a-3p(上游引物:5'-UAAUUUAUGUAUAAGCUAGU-3';下游引物:5'-GUUGAGGUGAUGTUGGU-3');以U6为内参(上游引物:5'-UGACUUCAACAGCGACACCCA-3';下游引物:5'-CACCCUGUUGCUGUAGCCAAA-3')。定量反应条件:95℃预变性5 min;95℃变性15 s、60℃退火延伸30 s、72℃延伸30 s,36个循环。以U6为内参计算2-ΔΔCt值,并将所有数据根据内参对照进行标准化,比较各组miRNA-29a-3p表达差异。
1.3 细胞转染及分组
①空白对照组(mimic-NC组):转染mimic-NC质粒。②miRNA-29a-3p上调组(miRNA-29a-3p mimic组):仅转染miRNA-29a-3p mimic质粒。③miRNA-29a-3p及PROM1的空白对照组(mimic-NC+oe-NC组):同时转染mimic-NC质粒及oe-NC质粒。④仅上调miRNA-29a-3p而不上调PROM1组(miRNA-29a-3p mimic+oe-NC组):同时转染miRNA-29a-3p mimic质粒及oe-NC质粒。⑤同时上调miRNA-29a-3p和PROM1组(miRNA-29a-3p mimic+oe-PROM1组):同时转染miRNA-29a-3p mimic质粒及oe-PROM1质粒。操作方法如下:转染前24 h,将细胞按2×105/孔接种在6孔板中,待细胞融合度达到50%时,参照LipofectamineTM2000转染试剂盒(购自美国Invitrogen公司)说明书,将终浓度为100 nmol/L的相应质粒(均购自广州锐博生物科技有限公司)分别转染细胞,转染后6 h加入20%FBS。
1.4 集落形成实验检测细胞克隆形成率
在6孔板中每孔加入2 ml 0.6%底层琼脂糖(购自美国GIBCO公司),待底层琼脂糖凝固后,将细胞均匀悬浮于37℃、0.3%琼脂糖中,并迅速把2 ml细胞悬液加到6孔板底层琼脂糖上(2000/孔),置于4℃10 min。再在37℃细胞培养箱中继续培养14天,然后在显微镜下对形成的克隆计数(≥50个细胞为1个克隆),计算克隆形成率,克隆形成率=克隆数/接种细胞数×100%。实验设3个平行孔,取平均值。
1.5 噻唑蓝法检测细胞增殖活性
采用噻唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞的增殖情况。将细胞按2×103/孔接种至96孔板中,每组样本6个复孔。分别在24、48、72 h向各孔加入10 μl MTT溶液(5 mg/ml),并置于细胞培养箱中培养4 h。温育后,弃去上清液,向各孔中加入150 μl二甲基亚砜,置于摇床轻微振荡,直至晶体完全溶解。使用多功能酶标仪在450 nm处测量吸光度(optical density,OD)值,比较各时间点细胞增殖能力。实验重复3次,取平均值。
1.6 荧光素酶实验测定miRNA-29a- 3 p与PROM 1的靶向关系
为了检测miRNA-29a-3p对PROM13'-UTR的影响,本研究构建了含有部分PROM13'-UTR的荧光素酶表达载体。PROM1mRNA的野生型片段含有潜在的miRNA-29a-3p结合位点(UGGUGCU),故使用下述引物:5'-CTGAGTTTCTATTTAGACACTACAACA-3'(正向)和5'-ACAATTTGACATGTGGCATTAACG-3'(反向)进行扩增。使用KpnI/XhoI限制性内切核酸酶将PCR片段插入pGL4 Basic Vector。使用突变试剂盒(购自北京天根生化科技有限公司)进行PROM13'-UTR的突变,将UGGUGCU结合位点突变为ACCACGA。萤光素酶活性测定,将细胞用100 ng野生型或突变型PROM1的3'-UTR质粒与100 ng miRNA-29a-3p共转染细胞。转染后48 h,使用荧光素酶测定试剂盒(购自美国Promega公司)测定荧光素酶活性,并以海肾荧光素酶活性作为内参归一处理。
1.7 Westernblot法检测PROM 1及GAPDH蛋白表达情况
细胞处理结束后,弃去培养基并用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,细胞使用RIPA蛋白裂解液进行裂解(添加蛋白酶及磷酸酶抑制剂),收集裂解细胞至1.5 ml EP管中,利用超声破碎仪对细胞进行彻底破碎。冰上放置5 min充分裂解后,13 000 r/min、4℃离心20 min,取上清至新的EP管中,使用BCA蛋白定量试剂盒进行蛋白定量。蛋白样本使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离;使用湿转法转移蛋白至PVDF膜上;5%脱脂牛奶三羟甲基氨基甲烷盐酸盐-吐温20缓冲液(trihydroxymethyl aminomethane hydrochloride buffered solution with Tween 20,TBS-T)溶液封闭1 h;按比例稀释一抗PROM1及内参GAPDH并过夜孵育;PBS-T溶液洗膜并室温下孵育相应的二抗1 h;最后充分洗膜完成后,使用电化学发光(electrochemiluminescence,ECL)液进行曝光成像。实验重复3次,取平均值。
1.8 统计学分析
采用SPSS 19.0统计软件进行数据处理。计量资料以均数±标准差(±s)表示,两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各细胞中miRNA-29a- 3 p相对表达量的比较
正常NP69细胞、TU212细胞、M4E细胞、M2E细胞和HEP-2细胞的miRNA-29a-3p相对表达量分别为(2.38±0.07)、(0.31±0.03)、(1.21±0.06)、(1.13±0.07)、(0.55±0.04),差异有统计学意义(F=577.121,P<0.01);TU212细胞、M4E细胞、M2E细胞和HEP-2细胞的miRNA-29a-3p相对表达量均明显低于正常NP69细胞,差异均有统计学意义(t=7.583、4.672、5.036、6.129,P<0.01)。除正常NP69细胞外,选择相对表达量最低的TU212细胞作为受试细胞进行后续实验。
2.2 上调miRNA-29a- 3 p表达对PROM 1蛋白表达情况的影响
Western blot法检测显示,miRNA-29a-3p mimic组TU212细胞PROM1蛋白相对表达量为(0.448±0.075),明显低于mimic-NC组的(1.135±0.106),差异有统计学意义(t=14.964,P<0.01)。(图1)

图1 Western blot法检测mimic-NC组和miRNA-29a- 3 p mimic组TU212细胞中PROM 1蛋白表达情况
2.3 荧光素酶活性的比较
经荧光素酶系统验证,转染miRNA-29a-3p后,野生型PROM1的荧光素酶活性为(0.627±0.089),明显低于mimic-NC组的(1.000±0.103),差异有统计学意义(t=7.750,P<0.01);而转染miRNA-29a-3p后,突变型PROM1的荧光素酶活性为(0.985±0.107),与mimic-NC组的(1.000±0.112)比较,差异无统计学意义(t=0.274,P>0.05)。
2.4 miRNA-29a- 3 p调控PROM 1对喉癌细胞增殖能力的影响
miRNA-29a-3p mimic+oe-NC组细胞克隆形成率低于mimic-NC+oe-NC组和miRNA-29a-3p mimic+oe-PROM1组,差异均有统计学意义(P<0.05);mimic-NC+oe-NC组与miRNA-29a-3p mimic+oe-PROM1组细胞克隆形成率比较,差异无统计学意义(P>0.05)。(图2、表1)
miRNA-29a-3p mimic+oe-NC组细胞各时间点OD值均低于mimic-NC+oe-NC组和miRNA-29a-3p mimic+oe-PROM1组,差异均有统计学意义(P<0.05);mimic-NC+oe-NC组与miRNA-29a-3p mimic+oe-PROM1组各时间点OD值比较,差异均无统计学意义(P>0.05)。(表1)
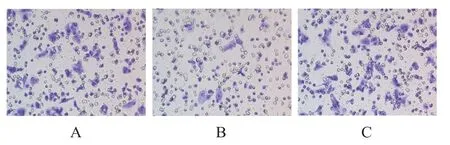
图2 各组喉癌细胞克隆形成实验结果(结晶紫染色,×200)
表1 各组喉癌细胞增殖情况的比较(± s)
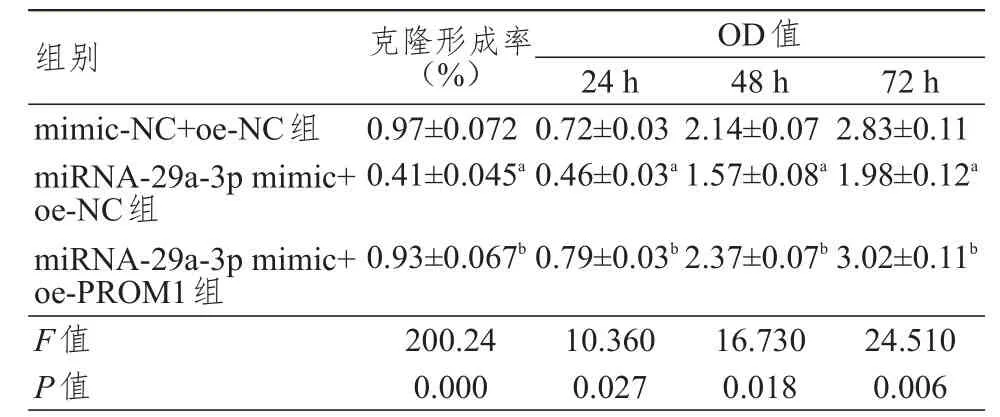
表1 各组喉癌细胞增殖情况的比较(± s)
注:a与mimic-NC+oe-NC组比较,P<0.05;b与miRNA-29a-3p mimic+oe-NC组比较,P<0.05
组别mimic-NC+oe-NC组miRNA-29a-3p mimic+oe-NC组miRNA-29a-3p mimic+oe-PROM1组F值P值克隆形成率(%)0.97±0.072 0.41±0.045a 0.93±0.067b 200.24 0.000 OD值24 h 0.72±0.03 0.46±0.03a 0.79±0.03b 10.360 0.027 48 h 2.14±0.07 1.57±0.08a 2.37±0.07b 16.730 0.018 72 h 2.83±0.11 1.98±0.12a 3.02±0.11b 24.510 0.006
3 讨论
在喉癌中发现了许多miRNA转录后水平可调节基因表达[14-15],然而,仍有未知的miRNA。已有的研究中指出了miRNA-29a-3p在某些类型的肿瘤中是肿瘤抑制性miRNA[16]。本研究发现与正常鼻咽细胞系相比,miRNA-29a-3p在喉癌细胞系中的表达显著下调。在喉癌细胞中上调miRNA-29a-3p表达可显著降低细胞增殖能力及细胞克隆能力。PROM1是一种致癌基因,被证实是喉癌细胞中miRNA-29a-3p的直接靶基因。在本研究亦证实PROM1是miRNA-29a-3p的靶向基因,且在TU212细胞中上调PROM1表达可明显逆转miRNA-29a-3p对喉癌细胞增殖的抑制作用,证明miRNA-29a-3p通过靶向PROM1抑制喉癌细胞增殖,这表明miRNA-29a-3p作为肿瘤抑制性miRNA发挥作用。
大多数先前的研究表明,miRNA-29a-3p在胶质细胞瘤及肝癌中起着抑制肿瘤的作用[10,17]。miRNA-29-3p包括miRNA-29a-3p、miRNA-29b-3p和miRNA-29c-3p。本研究主要集中在miRNA-29a-3p,因为其在喉癌中表达水平较低,而且在喉癌细胞和正常细胞中miRNA-29b-3p和miRNA-29c-3p表达水平没有差异。本研究发现,与正常细胞相比,喉癌细胞中miRNA-29a-3p的表达下调。针对miRNA-29a-3p的细胞功能研究,本研究证实了miRNA-29a-3p能够降低喉癌细胞的细胞增殖能力、克隆形成率。因此,以上数据均表明miRNA-29a-3p在喉癌中发挥着抑制性miRNA的作用。
PROM1在肿瘤的发生和发展中发挥着重要作用[18]。PROM1是干细胞以及多种肿瘤的潜在诊断分子标志物[19-21]。在本研究中,证实了PROM1是miRNA-29a-3p的下游靶点,并且也是喉癌细胞中miRNA-29a-3p的功能介导因子。在PROM1的3'-UTR中存在miRNA-29a-3p的互补序列,本研究通过荧光素酶实验证实正常的PROM13'-UTR会使荧光素酶的活性受到抑制,但miRNA-29a-3p对突变体PROM13'-UTR没有影响。这表明miRNA-29a-3p可能与PROM13'-UTR结合,然后促进PROM1mRNA的降解并抑制PROM1的翻译。
综上所述,miRNA-29a-3p是一种喉癌抑制性的miRNA。miRNA-29a-3p通过调节PROM1影响人喉癌的发生和发展,可能是治疗喉癌的潜在靶点,其在喉癌发生中的关键作用可能有助于患者的诊断和预后。本研究结果为更好地了解喉癌的发病机制及其可能的治疗策略提供了理论基础。
