卵清蛋白联合卡泊三醇诱导构建特应性皮炎小鼠模型
2019-08-25张宇韩悦徐蓓蕾凌诗琪罗阳刘笑纯姚煦
张宇 韩悦 徐蓓蕾 凌诗琪 罗阳 刘笑纯 姚煦
中国医学科学院 北京协和医学院 皮肤病医院过敏与风湿免疫科,南京 210042
目前认为特应性皮炎(AD)发病是在一定遗传背景下皮肤屏障功能异常和机体免疫应答异常的结果[1]。临床上AD的各种治疗方案难以达到长期缓解和预防复发的效果,严重影响患者的身心健康并增加家庭就医负担。快速、有效地建立AD 小鼠模型对深入阐明AD的发病机制和开发新药等具有重要意义。目前研究用的AD小鼠模型主要有自发突变的小鼠模型、转基因小鼠模型和药物/过敏原诱导产生的小鼠模型。其中,外涂药物/过敏原诱导的AD小鼠模型较为常用,但该模型造模周期长,且操作复杂,不利于在短期内建立[2]。近期有学者应用卡泊三醇外涂诱导AD,其最突出优点是可快速便捷地诱发AD样皮炎表现[3],但引起AD系统病理表现并不显著,并且缺乏过敏原特异性IgE。我们尝试用卵清蛋白(OVA)经皮致敏联合卡泊三醇外涂造模以缩短造模周期,并诱导建立系统致敏的理想AD模型。
材料与方法
一、材料
OVA(美国Sigma 公司)用无菌磷酸盐缓冲液(PBS)配成20 g/L,保存于-20 ℃。卡泊三醇搽剂为丹麦利奥制药有限公司产品,批号A52859A。IgE检测试剂盒(美国BD 公司),OVA 特异性IgE 检测试剂盒(美国BioLegend 公司,货号439807)。兔抗鼠胸腺基质淋巴细胞生成素(TSLP)、白细胞介素13(IL-13)、干扰素γ单克隆抗体均来自英国Abcam公司。
二、方法
1.小鼠分组及致敏方案:15只SPF级健康纯系雌性C57BL/6 小鼠[动物质量合格证编号SYXK(苏)2016-0011,动物使用许可证号SCXK(沪)2016-0004],8 周龄,体重20 g 左右,来自北京维通利华公司,在南京医科大学模式动物所饲养并进行实验,随机分为3 组:①卡泊三醇 +OVA 组(6 只),每天先在两侧耳部涂抹1 nmol/L卡泊三醇14.3 μl,风干后涂抹 20 g/L OVA 25 μl 每日 1 次;②卡泊三醇组(6 只),两侧耳部涂抹1 nmol/L 卡泊三醇14.3 μl;③对照组(3 只),两侧耳部涂抹75%乙醇14.3 μl,均连续涂抹12 d。分别在造模前和第14天时拍摄小鼠耳部照片并测量记录小鼠耳厚度,取小鼠尾静脉血,检测血清总IgE 和OVA 特异性IgE 水平,在第14天取小鼠耳廓皮肤制做切片并行HE和免疫组化染色。
2.耳厚度测定和组织病理学检查:用耳厚度测量仪在涂抹前和第14 天测量小鼠耳廓厚度。于第14 天测量完毕后脱颈处死小鼠,剪下小鼠耳朵,浸泡于4%甲醛12 h 后,石蜡包埋,切片,1 张用于HE 染色,每张切片取10 个独立高倍视野(HPF,× 100),计数嗜酸性粒细胞,取均值(Eo/HPF);1张切片做甲苯胺蓝染色,观察肥大细胞,照相记录。
3.免疫组化染色检测炎症因子表达水平:取小鼠耳部皮肤组织石蜡切片,按步骤加入兔抗鼠TSLP(1∶20稀释)、IL-13(1∶10稀释)、干扰素γ(1∶5稀释)抗体室温孵育2 h,山羊血清封闭,加驴抗兔二抗及显色剂染色,脱水,晾干,封片,照相记录,阳性结果为表皮和真皮内出现棕褐色颗粒或棕褐色染色。应用IPP 软件计算平均吸光度(IOD),分析细胞因子表达量。
4.ELISA 检测小鼠血清总IgE 和OVA 特异性IgE水平:用兔抗小鼠IgE抗体2 mg/L 包被酶标板,每孔100 μl,4 ℃过夜,按照试剂盒说明书操作染色并终止反应,检测血清总IgE水平。将1 mg/L OVA包被于ELISA 板过夜,参照BioLegend Mouse OVA specific IgE试剂盒说明书操作,检测小鼠血清OVA特异性IgE水平。
5.统计学分析:采用SPSS 20.0 和Graphpad Prism 6软件进行统计、绘图。数据用表示。造模前后耳厚度、总IgE浓度比较采用配对t检验;多组间均数比较采用单因素方差分析(ANOVA 检验),组间两两比较采用Tukey-kramer 法。P<0.05为差异有统计学意义。
结 果
一、小鼠皮肤表现
1.耳部皮损:第14天时,卡泊三醇+OVA组和卡泊三醇组小鼠耳部皮肤均干燥、脱屑,有明显毛细血管扩张,且卡泊三醇+OVA组较卡泊三醇组脱屑更明显。对照组小鼠皮肤无明显异常。见图1。
2.模型小鼠耳厚度比较:造模前,3 组间耳厚度差异无统计学意义(P=0.075)。造模后,卡泊三醇+OVA 组和卡泊三醇组小鼠耳厚度均显著高于造模前(t值分别为20.503、9.968,均P< 0.001),亦显著高于对照组(q值分别为 4.608、4.924,P≤0.001),而卡泊三醇+OVA组与卡泊三醇组间差异无统计学意义(q=0.674,P=0.231)。见表1。
二、小鼠皮肤组织病理表现
1.HE染色:与对照组相比,卡泊三醇+OVA组和卡泊三醇组皮损表皮厚度增加,炎症反应增强,真皮炎症细胞浸润,呈亚急性皮炎样改变(图2)。
2.甲苯胺蓝染色:卡泊三醇+ OVA 组与卡泊三醇组、对照组比较,肥大细胞增多,见图2。单因素方差分析显示,3组间每高倍视野(×400)下嗜酸性粒细胞均数差异有统计学意义(F= 21.96,P=0.001)。与对照组(0.3 ± 0.58)嗜酸性粒细胞数相比,卡泊三醇 + OVA 组显著增多(4.5 ± 1.29,q=6.092,P= 0.001),而卡泊三醇组没有显著变化(1.25± 0.5,q=1.340,P=0.342);卡泊三醇 +OVA组显著高于卡泊三醇组(q=5.134,P=0.001)。
3.免疫组化染色:见表1、图3。免疫组化示,TSLP 在小鼠表皮基底层、棘层和真皮小血管上皮细胞表达,IL-13、干扰素γ主要在真皮内表达。3组间TSLP、干扰素γ 表达水平差异无统计学意义(均P>0.05),但IL-13 表达水平差异有统计学意义(F=5.159,P=0.032)。其中,卡泊三醇 +OVA 组IL-13 表达显著高于对照组(q=3.170,P=0.021),但卡泊三醇组与对照组间(q=1.139,P=0.447)及卡泊三醇+OVA组与卡泊三醇组间(q=2.031,P=0.073)差异均无统计学意义。
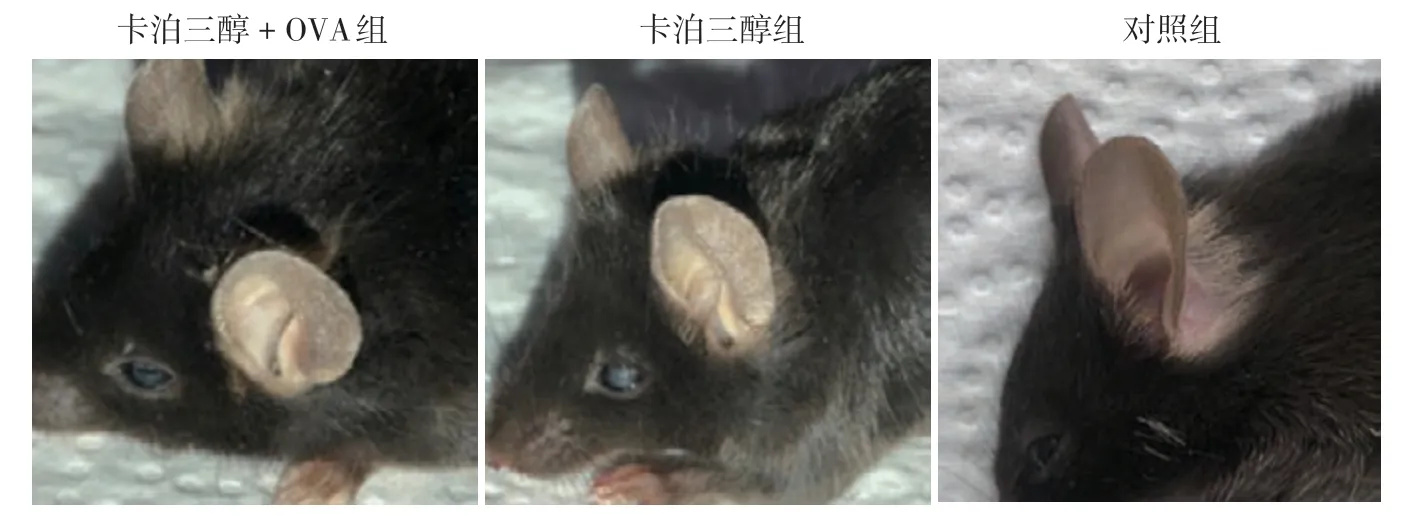
图1 卡泊三醇单独或联合卵清蛋白(OVA)诱导的小鼠皮损表现 外涂药物致敏12 d后,第14 天观察结果,卡泊三醇+OVA 组和卡泊三醇组小鼠耳部皮肤均干燥、脱屑,卡泊三醇+OVA组更明显,对照组小鼠耳部皮肤无明显异常
表1 卡泊三醇单独或联合卵清蛋白(OVA)诱导的小鼠耳厚度及造模后皮肤中胸腺基质淋巴细胞生成素(TSLP)、白细胞介素13(IL-13)和干扰素γ表达水平比较()
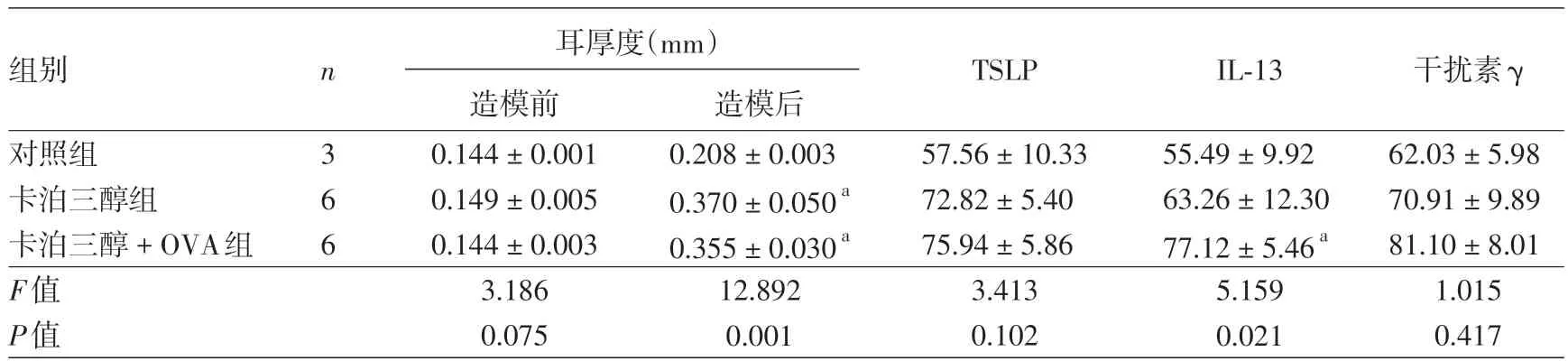
表1 卡泊三醇单独或联合卵清蛋白(OVA)诱导的小鼠耳厚度及造模后皮肤中胸腺基质淋巴细胞生成素(TSLP)、白细胞介素13(IL-13)和干扰素γ表达水平比较()
注:a 与对照组比,P < 0.01
组别TSLP 干扰素γ对照组卡泊三醇组卡泊三醇+OVA组F值P值n 3 6 6耳厚度(mm)造模前0.144±0.001 0.149±0.005 0.144±0.003 3.186 0.075造模后0.208±0.003 0.370±0.050a 0.355±0.030a 12.892 0.001 57.56±10.33 72.82±5.40 75.94±5.86 3.413 0.102 IL-13 55.49±9.92 63.26±12.30 77.12±5.46a 5.159 0.021 62.03±5.98 70.91±9.89 81.10±8.01 1.015 0.417

图2 卡泊三醇单独或联合卵清蛋白诱导的小鼠皮损HE 染色(×40)及甲苯胺蓝染色(×100)结果 表皮增厚、肥大细胞浸润程度由重到轻依次为卡泊三醇+卵清蛋白组、卡泊三醇组和对照组
三、小鼠血清IgE水平
1.血清总 IgE 浓度:卡泊三醇+OVA组第14天时总IgE浓度(8 278.56 ± 3 297.68)μg/L,较致敏前(892.64 ± 82.83)μg/L 明显升高,差异有统计学意义(t=4.132,P= 0.026)。卡泊三醇组造模前后总IgE 浓度差异无统计学意义[(947.25 ± 206.83)比(4 330.95 ± 1 223.26)μg/L,t=3.262,P= 0.052)。造模后,卡泊三醇 + OVA 组与卡泊三醇组(4 330.95± 1 223.26)μg/L 比较,差异无统计学意义(t=1.561,P=0.194)。对照组在造模前(175.333 ± 11.941)μg/L 与造模后(215.638 ± 23.186)μg/L 血清总IgE 水平均较低(t= 3.162,P=0.471)。
2.OVA 特异性 IgE 浓度:造模后卡泊三醇+ OVA 组OVA 特异 性 IgE 水 平 为(192.846 ±15.391)μg/L,显著高于卡泊三醇组[(8.492 ±3.879)μg/L,q= 22.476,P< 0.001]和对照组[(9.384 ± 6.579)μg/L,q=22.476,P< 0.001]。
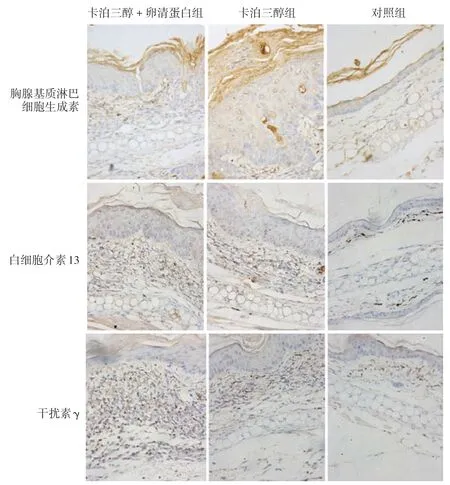
图3 免疫组化检查卡泊三醇单独或联合卵清蛋白诱导的小鼠皮肤胸腺基质淋巴细胞生成素(TSLP)、白细胞介素13和干扰素γ的表达(×200) 各组间TSLP、干扰素γ表达无明显差异,但卡泊三醇+卵清蛋白组IL-13表达显著高于对照组
讨 论
目前认为AD发病是在一定遗传背景下皮肤屏障功能异常、环境过敏原刺激和机体异常免疫应答的结果,目前确切的作用机制尚不明确。大量的研究证据显示,在皮肤屏障功能异常的基础上,过敏原经皮致敏和皮肤表面微生物菌群的组成异常引发了AD 患者的异常免疫应答[4]。研究发现,60%~70%的AD 患者OVA 和尘螨等常见特应性抗原斑贴试验阳性,斑贴部位接触变应原后,皮肤内炎性树突状表皮细胞(inflammatory dendritic epidermal cells)数量增加[5-6]。在小鼠实验中也发现了同样的现象,经不完整表皮涂布花生或牛奶抗原会引发以Th2 为主的过敏反应[7]。本研究中我们在通过局部外用卡泊三醇引起表皮角质形成细胞局部炎症反应并导致皮肤屏障功能异常前提下,联合致敏模型常见的模式过敏原OVA 外涂小鼠耳部皮肤诱导AD小鼠模型。与单独使用OVA造模比较,本文方案明显缩短了造模所需时间,且实验操作简便可实施性强,提高了OVA 经皮致敏的效率。因本研究旨在阐明卡泊三醇与OVA+卡泊三醇两组方案在致特应性皮炎模型中的差异,故未单独使用OVA造模作为对照是本文的不足。
本实验应用的卡泊三醇是维生素D3 类似物,在临床上常用于银屑病的治疗,可抑制角质形成细胞增殖,促进细胞分化,并可选择性抑制IL-1 对T细胞的刺激功能,有免疫抑制作用,外用卡泊三醇的不良反应主要为皮肤刺激,表现为用药部位烧灼、红斑、脱屑。2006年,Li等[8]首次应用卡泊三醇外涂小鼠耳部引起小鼠角质形成细胞TSLP表达升高,从而导致AD 样症状。小鼠局部皮肤涂抹卡泊三醇可引起表皮增生,真皮炎症细胞浸润,包括嗜酸性粒细胞和CD3+、CD4+、CD11C+、GR-1+细胞及肥大细胞等,同时皮肤炎症因子以Th1 和Th2 型为主,包括TSLP、IL-4、IL-5、IL-13、IL-31、IL-10、IL-8、干扰素γ 和肿瘤坏死因子β 等[3],而且局部外涂卡泊三醇也可引起血清总IgE 升高,但升高并不显著。此模型已经应用于许多AD 的实验室研究中。但此模型在引起表皮屏障功能异常中的作用还没有被阐明。
因OVA 单独构建经皮致敏模型时,需要破坏小鼠皮肤屏障,传统做法为剃除小鼠背部毛发,用胶带反复粘贴造成表皮缺失,再外涂OVA 抗原诱发AD 样皮炎,该方法费时费力,对操作要求较高,且可能引发真皮缺失或继发感染影响实验结果。本文中我们通过局部外用卡泊三醇引起表皮角质形成细胞局部炎症反应[3],导致皮肤屏障功能异常,同时联合过敏原OVA 外涂小鼠耳部皮肤诱导AD小鼠模型。与单独使用OVA造模比较,本文方案明显降低了造模所需时间,实验操作简便,可实施性强,而且提高了OVA 经皮致敏的效率。卡泊三醇联合OVA的临床表现为AD样皮炎,与单独使用卡泊三醇造模比较,表皮增生和炎症细胞浸润更加明显,血清总IgE 和OVA 特异性IgE 不同程度升高。
总之,我们成功建立过敏原引起的外源性AD小鼠模型,为今后AD的研究,尤其为过敏原引起的外源性AD的研究奠定了一定的基础。
利益冲突所有作者均声明不存在利益冲突
