北京31例20~25岁健康在校女大学生面部主观皮肤类型与皮肤微生物的关系
2019-08-25郑玉梅吴文海宋丽雅何聪芬
郑玉梅 吴文海 宋丽雅 何聪芬
北京工商大学理学院 北京市植物资源研究开发重点实验室 100048
皮肤作为人体与外界环境接触的主要屏障,寄居着大量的细菌、真菌和病毒[1],这些微生物主要通过与宿主先天免疫系统相互作用来维持自身平衡[2-3],并参与皮肤屏障功能构建[1]。微生物种类和群落组成在皮肤表面呈现多样化,会受皮肤生理特征的影响,具有很大的个体差异性和时间稳定性[4-10]。常见皮肤分型系统有 Fitzpatrick 分型[11]、Baumann皮肤分型[12]和主观皮肤分型[13],其中主观皮肤分型是指针对自身皮肤特点的主观判断,一般分为干性、混合性、油性和中性皮肤,与皮肤水分含量、油脂分泌量等客观生理指标有一定的对应关系,尤其是年龄<25 岁的人群[14]。本研究采用高通量测序技术研究20 ~25岁健康女性面部皮肤的细菌和真菌多样性,探究不同主观皮肤类型的皮肤细菌与真菌组成差异,为“精准护肤”和护肤用品的开发提供理论支撑。
对象与方法
一、试剂与仪器
吐温20(国药集团化学试剂北京有限公司),溶菌酶(北京百灵威科技有限公司),DNeasy 组织/血液DNA 提取试剂盒(德国QIAGEN 公司),Corneometer CM825 皮肤水分含量测试仪、Tewameter TM300 水分经皮丢失测试仪、Sebumeter SM815皮肤油脂测试仪、Skin-pH-Meter PH905皮肤酸碱度测试仪(德国Courage+Khazaka公司),医用红外体温计FR830(深圳家康科技有限公司),GeneAmp®9700 型 PCR 仪(美国ABI公司),AxyPrep 凝胶回收试剂盒(美国Axygen Biosciences公司),QuantiFluor™-ST 微型荧光计(美国Promega公司),Illumina MiSeq 测序系统(美国Illumina 公司)。
二、研究对象
招募31 例志愿者,均为北京工商大学在校女学生,生活环境较一致,年龄20 ~25 岁,面部皮肤健康。按照受试者对面部皮肤油腻及干燥程度的主观感受将皮肤自评为干性(6例)、中性(8例)、混合性(9 例)、油性(8 例)4 组。取样时间为2017 年12月24日;取样前1个月内,受试者皮肤表面不能涂抹任何含抗生素或糖皮质激素类产品,且1个月内未口服过任何抗生素或抗菌类药品;取样前8 h不能进行面部清洁和涂抹任何化妆品。本研究符合2013年修订的《赫尔辛基宣言》(www.wma.net/en/30publications/10policies/b3/index.html)的要求,所有受试者了解整个实验目的和过程,并签署知情同意书。
三、方法
1.皮肤生理指标的检测:使用Corneometer CM825 皮肤水分含量测试仪、Tewameter TM300 水分经皮丢失测试仪、Sebumeter SM815 皮肤油脂测试仪和Skin-pH-Meter PH905皮肤酸碱度测试仪分别检测受试者左右两侧面颊颧骨下方2 cm×2 cm区域皮肤水分含量、经皮水分丢失、油脂含量和pH值,用医用红外体温计FR830 检测受试者额部体温,比较不同自评皮肤类型间皮肤生理指标的差异。
2.取样方法:取2 支无菌棉拭子蘸取润湿液(生理氯化钠溶液-0.1%吐温20),分别在受试者面颊皮肤左右对称部位4 cm × 2 cm 区域各擦拭25 次,期间注意擦拭时转动棉拭子,持续时间约15 s,然后将棉拭子放入收集管内。采集过后,样品放于干冰中保存,随后转入-80 ℃保存,并尽快提取DNA。
3.样品DNA 的抽提及PCR 扩增:采用DNeasy血液/组织DNA 提取试剂盒提取皮肤表面细菌总DNA。参照试剂盒说明书操作,部分优化,即重复最后一步中洗脱缓冲液AE 加至滤柱膜中央洗提DNA,室温(15 ~25 ℃)下孵育1 min,≥ 6000×g离心1 min。DNA 浓度和纯度采用NanoDrop2000 超微量分光光度计进行检测,利用1%琼脂糖凝胶电泳检测DNA 提取质量;用上游引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和下游引物338R(5′-TGCTGCCTCCCGTAGGAGT-3′)对细菌 16S rRNA V1-V2 可变区进行PCR 扩增,用上游引物内源转录间隔区(ITS)1F(5′-CTTGGTCATTTAGAGG AAGTAA - 3′ )和下游引物 ITS2R(5′ -GCTGCGTTCTT CATCGATGC-3′)对真菌 ITS 进行 PCR 扩增。细菌扩增体系为20 μl,包括5 × FastPfu DNA 聚合酶缓冲液4 μl,2.5 mmol/L dNTPs 2 μl,5 μmol/L 上游和下游引物各 0.8 μl,FastPfu 聚合酶 0.4 μl,10 ng DNA模板,牛血清白蛋白0.2 μl,补ddH2O至20 μl。真菌扩增体系为 20 μl,包括 10 × 缓冲液 2 μl,2.5 mmol/L dNTPs 2 μl,5 μmol/L 上游引物和下游引物各 0.8 μl,rTaq 聚合酶 0.2 μl,10 ng DNA 模板,牛血清白蛋白0.2 μl,补ddH2O至20 μl。扩增程序为:95 ℃预变性3 min;95℃变性30 s,55 ℃(细菌)或53 ℃(真菌)退火30 s,72 ℃延伸45 s,共27(细菌)或37(真菌)个循环;最后72 ℃延伸10 min。
4.Miseq 测序系统对面部皮肤细菌16S rRNA V1-V2区和真菌ITS1-ITS2区进行测序:用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA凝胶回收试剂盒进行纯化,Tris-HCl 洗脱,2%琼脂糖凝胶电泳检测。采用QuantiFluor™-ST 微型荧光计定量检测PCR产物。根据Illumina MiSeq系统标准操作规程将纯化后的扩增片段构建PE300 的测序策略。测序过程均由上海美吉生物医药科技有限公司完成。
5.测序数据处理:原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接:①设置50 bp 的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp 的序列;②DNA 条形码需精确匹配,引物允许2 个碱基的错配,去除模糊碱基;③根据重叠碱基的重叠部分将两端序列进行拼接,其中重叠部分需>10 bp。去除无法拼接的序列。
使用 UPARSE 软件(version 7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行OTU(operational taxonomic units)聚类;使用UCHIME 软件剔除嵌合体。利用RDP 分类器(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对数据库为细菌Silva(Release128 http://www.arb-silva.de)和真菌 Unite(Release 6.0 http://unite.ut.ee/index.php)数据库,设置比对阈值为70%。
6.不同主观皮肤类型面颊皮肤微生物多样性结构差异分析:①Alpha多样性:通过单样本的多样性分析反映微生物群落的丰度和多样性,用Chao指数来评估物种总数,值越大,群落丰富度越高;Shannon 指数常用来衡量菌群多样性;②Beta 多样性:对 4 组样本进行 PCoA 分析,PCoA 是一种非约束性的数据降维分析方法,本研究采用加权的UniFrac,可以更完全地反映样本之间的距离;③群落组成比较:分析4 组皮肤细菌、真菌在门、属、种水平上的优势菌。
7.统计学分析:采用SPSS17.0软件进行统计分析。皮肤理化指标检测结果采用表示,4 种皮肤类型间皮肤理化指标的比较采用单因素方差分析,两两间多重比较采用LSD-t检验,P<0.05认为差异有统计学意义。
结 果
一、不同主观皮肤类型皮肤理化指标差异
见图1。皮肤水分和油脂含量随干性、中性、混合性、油性皮肤分型逐渐上升,且4 种主观皮肤类型间皮肤油脂含量(F=11.685,P< 0.001)和温度(F=3.017,P=0.047)差异有统计学意义;4种主观皮肤类型间皮肤水分含量、经皮水分丢失和pH值差异均无统计学意义(F值分别为0.258、1.977、1.287,均P>0.05)。两两多重比较显示,油性组皮肤表面油脂含量显著高于干性、中性、混合性组(LSD-t值分别为5.15、4.86、4.06,均P< 0.001),其余各组间皮肤油脂含量差异无统计学意义。干性组皮肤温度显著低于中性组和油性组(LSD-t值分别为2.16、2.67,均P< 0.05),其余各组间差异无统计学意义。
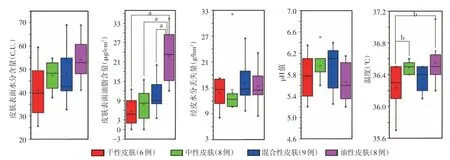
图1 31例健康年轻女性4种主观皮肤类型面部理化指标比较 皮肤水分和油脂含量平均值按干性、中性、混合性、油性皮肤类型逐渐上升,油性组皮肤油脂含量和温度都明显高于干性组,且油性组皮肤油脂含量也明显高于其他两组;4种主观皮肤类型间皮肤水分含量、经皮水分丢失和pH值差异无统计学意义。a:P < 0.001;b:P < 0.05
二、受试者面颊皮肤微生物组成
1.细菌群落组成:测序后共得到1 132 581 条细菌16S rRNA V1-V2 区序列,在97%的相似水平下,对31 个样本进行聚类和注释,共得到2 434 个OTU,归属于28个菌门,776个菌属,1 590个菌种。丰度>1%的物种为面颊皮肤主要物种,本实验组31个样本1 132 581个细菌门水平上主要由放线菌门(575 896,50.85%)、厚 壁 菌 门(363 200,32.07%)、变性菌门(139 835,12.35%)、拟杆菌门(30 718,2.71%)和其他含量较小的菌门(22 932,2.02%)组成;属水平上主要由丙酸杆菌(444 329,39.23%)、葡萄球菌(220 322,19.45%)、链球菌(93 136,8.22%)、红球菌(35 821,3.16%)、棒状杆菌(29 505,2.61%)、假单胞菌(20 916,1.85%)、微球菌(19 445,1.72%)、奈瑟氏菌(15 699,1.39%)和其他含量较小的菌属(253 408,22.37%)组成。种水平上检测到表皮葡萄球菌PM221 占14.53%(164 580),庆笙红球菌(Rhodococcus qingshengii)占2.52%(28 551),人葡萄球菌占1.76%(19 909),马胃葡萄球菌(Staphylococcus equorum)占1.74%(19 741)。
2.真菌群落组成:测序后共得到2 100 986 条真菌ITS1-ITS2 区序列,在97%的相似水平下,对31 个样本进行聚类和注释,共得到806 个OTU,归属于 4 个菌门,284 个菌属,471 个菌种。共检测到4 个门类,主要为子囊菌门(1 795 030,85.44%)和担子菌门(289 872,13.80%)。共检测到15 个属水平上平均丰度>1%的菌群,其中9个有分类命名,依次为曲霉属(429 787,20.46%)、链格孢属(299 579,14.26%)、隐球酵母属(130 189,6.20%)、青霉菌属(52 810,2.51%)、马拉色菌属(48 453,2.31%)、赤霉菌属(42 992,2.05%)、枝孢属(40 912,1.95%)、支顶孢属(38 399,1.83%)、镰刀菌属(26 394,1.26%)。
进一步对属水平丰度>1%的物种进行种水平分析,详见表1。曲霉属检测到17 个种,其中丰度>0.1%的可鉴定种有6个,占18.72%;链格孢属检测到4 个种,无丰度>0.1%的可命名种;隐球酵母属检测到17个种,其中丰度>0.1%的种有6个,占5.85%;青霉菌属检测到17 个种,其中丰度>0.1%的可命名种有4 个,占1.12%;马拉色菌属共检测到7 个种,其中丰度>0.1%的种有2个,为限制性马拉色菌(2.06%,43 382)和球形马拉色菌(0.12%,2 481);赤霉菌属共检测到3个种,其中丰度>0.1%的种仅错综赤霉(1.98%,41 547);枝孢属检测到7 个种,其中丰度>0.1%的可鉴定种有3 个,占1.25%;支顶孢属检测到14 个种,丰度>0.1%的种有3 个,其中有分类名种占1.24%,未命名种占0.18%;镰刀菌属检测到14 个种,无丰度>0.1%的可命名种。
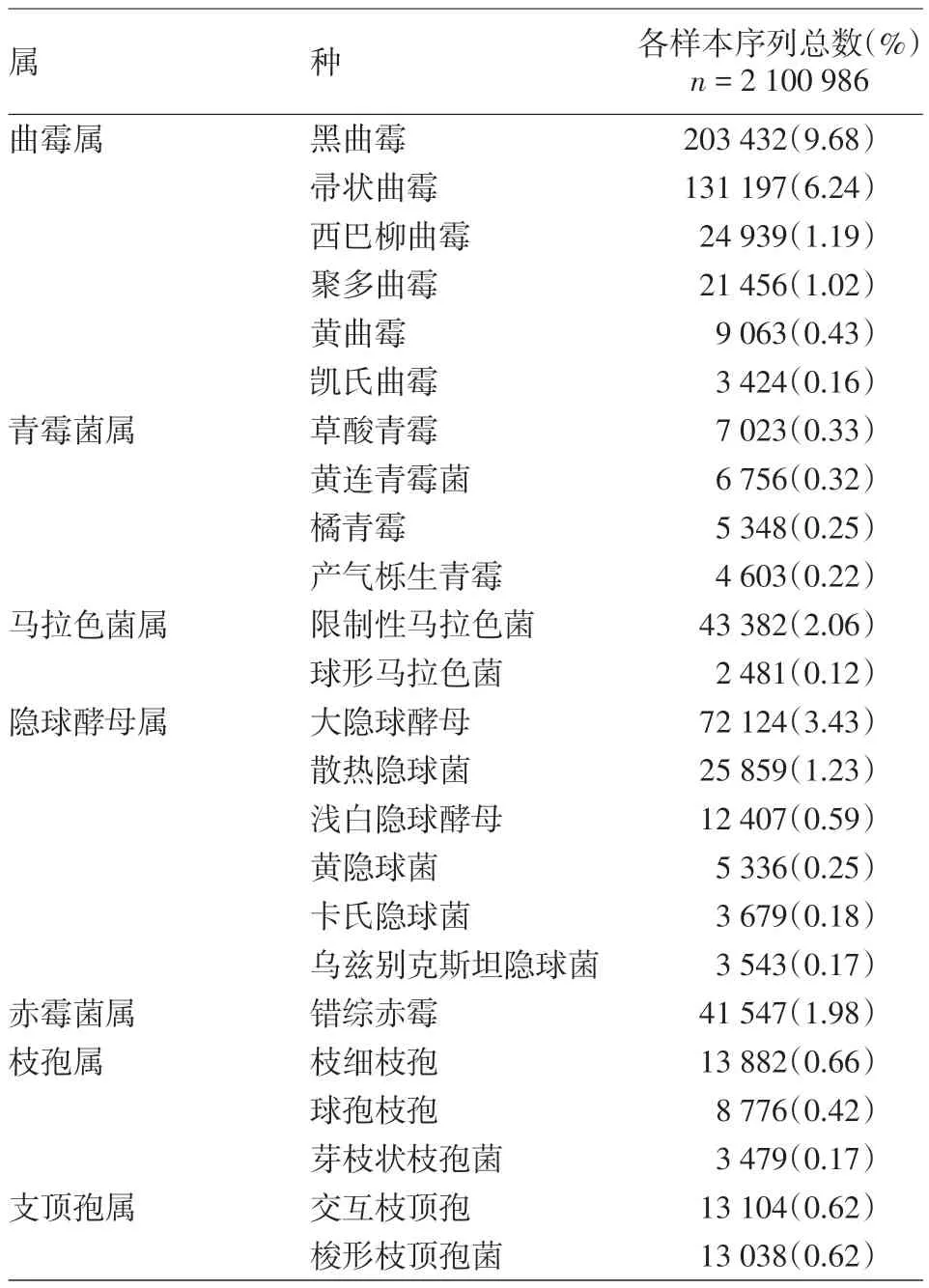
表1 健康年轻女性受试者面颊皮肤种水平上丰度>0.1%的真菌物种
三、细菌多样性差异分析
1.Alpha 多样性:不同主观皮肤类型细菌物种丰富度(图2A)差异无统计学意义(F= 0.437,P=0.728)。而细菌物种多样性(图2B)随干性、中性、混合性、油性皮肤类型逐渐降低,4 组间差异有统计学意义(F=5.634,P=0.004),其中干性皮肤细菌物种多样性显著高于油性皮肤和混合性皮肤(LSD-t=3.85、2.06,P=0.001、0.049),中性皮肤显著高于油性皮肤(LSD-t=3.03,P=0.005),中性皮肤与干性皮肤和混合性皮肤间、混合性皮肤与油性皮肤间差异均无统计学意义(P>0.05)。
2.Beta多样性:见图2C。PCoA分析显示,干性组和油性组样本完全无交叉,而中性组和混合性组交叉在两组之间,说明干性皮肤和油性皮肤细菌组成结构和丰度差异较大。
3.细菌群落组成比较:4 组皮肤细菌均以放线菌门最具优势(图3A),但组间放线菌门相对丰度差异有统计学意义(F=5.045,P=0.007),其中油性组放线菌门相对丰度最高(74.05% ± 11.32%),干性组最低(39.51%±9.98%),两两多重比较结果显示,干性组、中性组、混合性组均显著低于油性组(LSD-t值分别为3.27、2.96、3.18,均P< 0.01),其余各组间差异无统计学意义(均P>0.05)。厚壁菌门为各组第二优势菌,组间比较相对丰度差异无统计学意义(F=2.364,P=0.093)。此外,变形菌门(干性:18.03% ±12.43%、中性:15.44%±11.32%、混合性:11.46%±9.64%、油性:5.69% ±3.18%)、拟杆菌门(干性:4.71% ±4.53%、中性:3.99% ±3.93%、混合性:2.23% ±3.44%、油性:0.92% ±0.85%)、梭杆菌门(干性:2.37%±2.97%、中性:0.87%±0.86%,混合性:0.44%±0.65%、油性:0.14%±0.15%)按干性、中性、混合性、油性皮肤类型顺序逐渐下降,且梭杆菌门相对丰度在各组间差异有统计学意义(F=3.304,P=0.035),变形菌门和拟杆菌门相对丰度在各组间差异无统计学意义(均P>0.05)。两两多重比较显示,干性组梭杆菌门相对丰度显著高于油性组(LSD-t= 2.95,P= 0.006)和混合性组(LSD-t=2.61,P=0.014),其余各组间差异无统计学意义(均P> 0.05)。
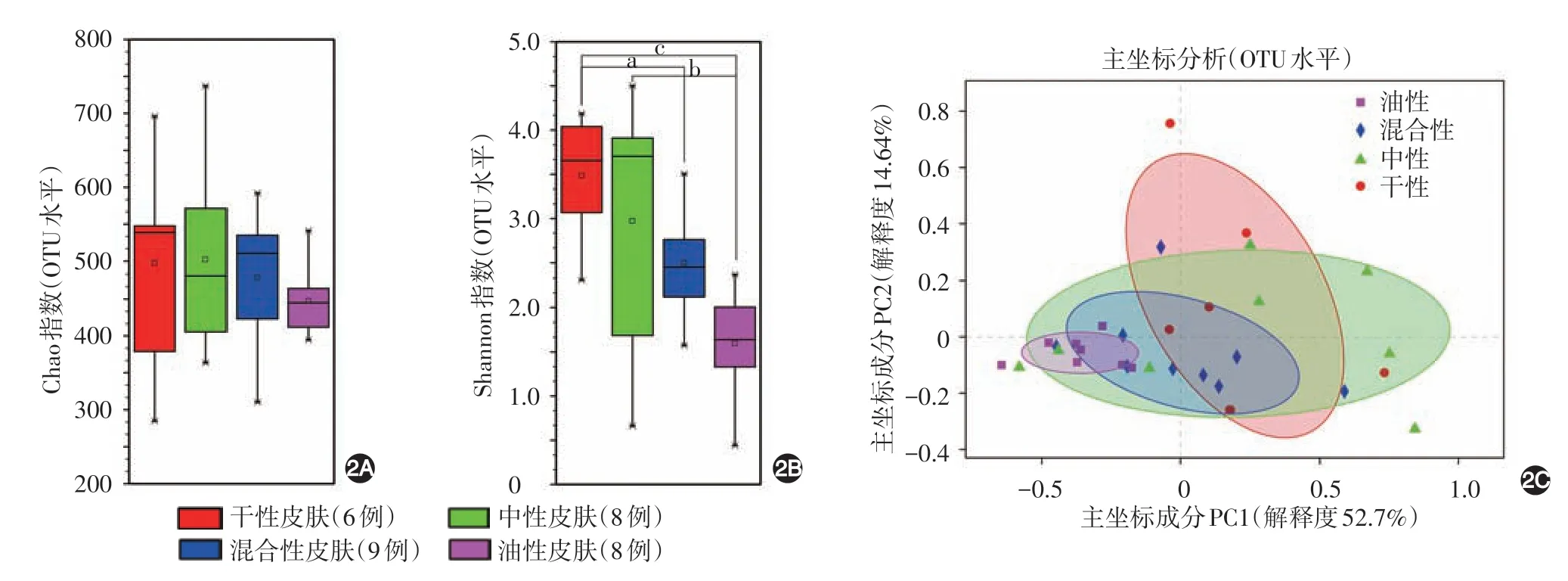
图2 31 例健康年轻女性不同主观皮肤类型细菌物种多样性分析 2A:不同主观皮肤类型细菌物种Chao 指数差异无统计学意义(P >0.05);2B:不同主观皮肤类型细菌物种Shannon指数差异有统计学意义(F=5.634,P=0.004)。a:P < 0.05,b:P=0.005,c:P=0.001;2C:主坐标分析PCoA(principal co-ordinates analysis)图。PCoA是一种研究数据相似性或差异性的可视化方法,通过一系列的特征值和特征向量进行排序后,选择主要排在前几位的特征值,通过PCoA可以观察个体或群体间的差异。本研究使用的距离算法为Weighted-UniFrac(考虑物种间进化关系和物种丰度)。PC1(principal co-ordinates 1)和PC2(principal co-ordinates 2)是两个主坐标成分,PC1 表示尽可能最大解释数据变化的主坐标成分,PC2 为解释余下的变化度中占比最大的主坐标成分。在主坐标成分PC1维度上(解释度52.7%)干性皮肤组样本和油性皮肤组样本可以完全分离开说明干性皮肤和油性皮肤的皮肤细菌组成和丰度差异最大
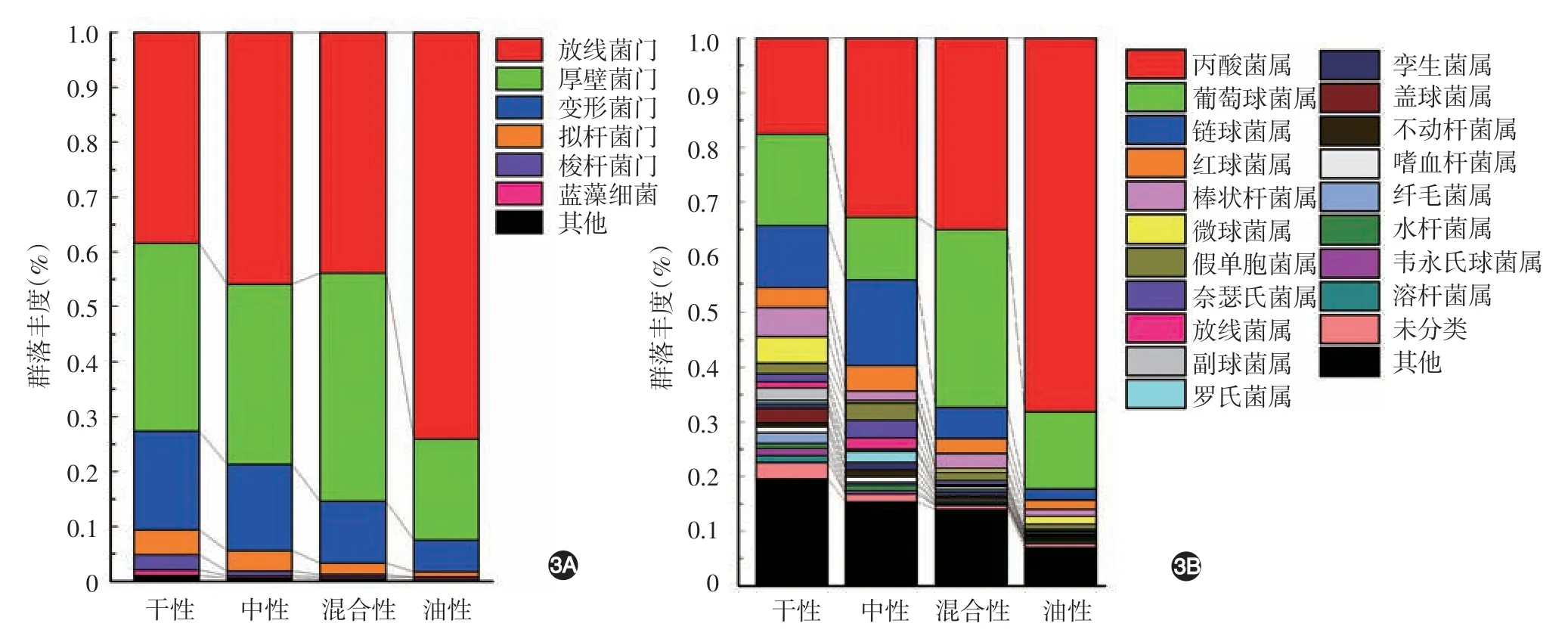
图3 31例健康年轻女性不同主观类型皮肤细菌物种组成柱状图 3A:门水平上至少在一组中丰度大于1%的细菌物种组成,根据丰度大小依次为放线菌门、厚壁菌门、变形菌门、拟杆菌门、梭杆菌门和蓝藻细菌,其中变形菌门、拟杆菌门、梭杆菌门丰度随干性、中性、混合性、油性皮肤类型逐渐下降;3B:属水平上至少在一组中丰度大于0.5%的细菌物种组成,按物种丰度从高到低排列
属水平上(图3B),4 组皮肤细菌均以丙酸杆菌、葡萄球菌和链球菌为优势菌,且丙酸杆菌-葡萄球菌-链球菌(放线菌-厚壁菌微生物群)的联合相对丰度随干性、中性、混合性、油性皮肤类型逐渐上升(F=5.063,P=0.007),其中丙酸杆菌-葡萄球菌的联合相对丰度及丙酸杆菌的相对丰度也逐渐上升,差异有统计学意义(F= 5.533、5.535,均P=0.004)。两两多重比较显示,油性组丙酸杆菌丰度(68.24% ± 14.78%)显著高于干性组(18.83% ±14.49%,LSD-t=3.77,P< 0.001)、中性组(32.18% ±36.29%,LSD-t= 2.97,P= 0.006)和混合性组(35.22% ± 22.58%,LSD-t=2.80,P=0.009),其余各组间差异无统计学意义(均P>0.05)。葡萄球菌相对丰度在混合性组(31.61% ± 24.01%)最高,且显著高于中性组(11.30% ± 7.95%,LSD-t= 2.70,P=0.012)和油性组(14.23% ± 10.09%,LSD-t=2.31,P=0.029),其余各组间差异无统计学意义(均P>0.05)。链球菌在中性组丰度最高(16.00% ±17.06%),且显著高于油性组(2.14%±2.29%,LSD-t=2.50,P=0.019),其余各组间差异无统计学意义(均P> 0.05)。
除优势菌外,对丰度>1%的菌属进行差异性检验,结果显示,微球菌(F=3.514,P=0.029)、放线菌(F=5.507,P=0.007)、罗氏菌(F=4.394,P=0.012)、副球菌(F= 3.189,P= 0.040)相对丰度在4组间差异有统计学意义。两两多重比较显示,干性组微球菌和副球菌相对丰度显著高于中性组(LSD-t= 2.94、2.65,P= 0.007、0.013)、混合性组(LSD-t= 3.05、0.29,P= 0.009、0.021)和油性组(LSD-t=2.53、0.08,P=0.027、0.011),中性组放线菌相对丰度高于混合性组(LSD-t=3.34,P=0.002)和油性组(LSD-t=3.42,P=0.002),中性组罗氏菌丰度高于干性组(LSD-t=2.41,P=0.023)、混合性组(LSD-t= 2.77,P= 0.006)和油性组(LSD-t=2.99,P= 0.003),其余各组差异无统计学意义(均P>0.05)。其余菌属,如红球菌、棒状杆菌、假单胞菌等相对丰度在4 组间差异无统计学意义(均P>0.05)。
四、真菌多样性差异分析
4 组皮肤真菌多样性(Shannon 指数)和丰富度(Chao 指数)差异无统计学意义(F= 0.304、0.296,P=0.822、0.828)。进一步分析显示,4组真菌门水平上主要由子囊菌门和担子菌门组成,且4组间比较相对丰度差异无统计学意义(F= 0.419、0.740,P=0.465、0.709)。4组属水平上丰度>1%的皮肤真菌组成见表2,单因素方差分析显示,4 组间丰度>1%的相对丰度真菌属差异均无统计学意义(均P> 0.05)。
讨 论
干性皮肤者普遍存在屏障功能缺陷,皮肤干燥易引起皮肤敏感,甚至发展成为炎症性皮肤病[15-16],油性皮肤容易发生痤疮和脂溢性皮炎[17-18],了解不同皮肤类型微生物组成,从微生态的角度深刻分析不同皮肤类型皮肤状态,对皮肤疾病的预防和治疗有重要意义。人们通常根据主观皮肤分型选择相应的皮肤护理方法,因此了解不同主观皮肤类型的特点非常重要。由于20 ~25岁年龄段女性主观皮肤类型与客观皮肤无创性检测结果的吻合度比较高[14,19],本研究选择受试者为 20 ~ 25 岁女性,按自评皮肤类型将31 例受试者分为干性、中性、混合性、油性4 组。比较4 组面部理化指标显示,皮肤水分和油脂含量按干性、中性、混合性、油性皮肤类型顺序逐渐上升,且4组间油脂含量差异有统计学意义,说明自评皮肤类型与皮肤油脂含量基本相符。中性皮肤经皮水分散失量最低,代表皮肤屏障最好,但4组间差异无统计学意义。
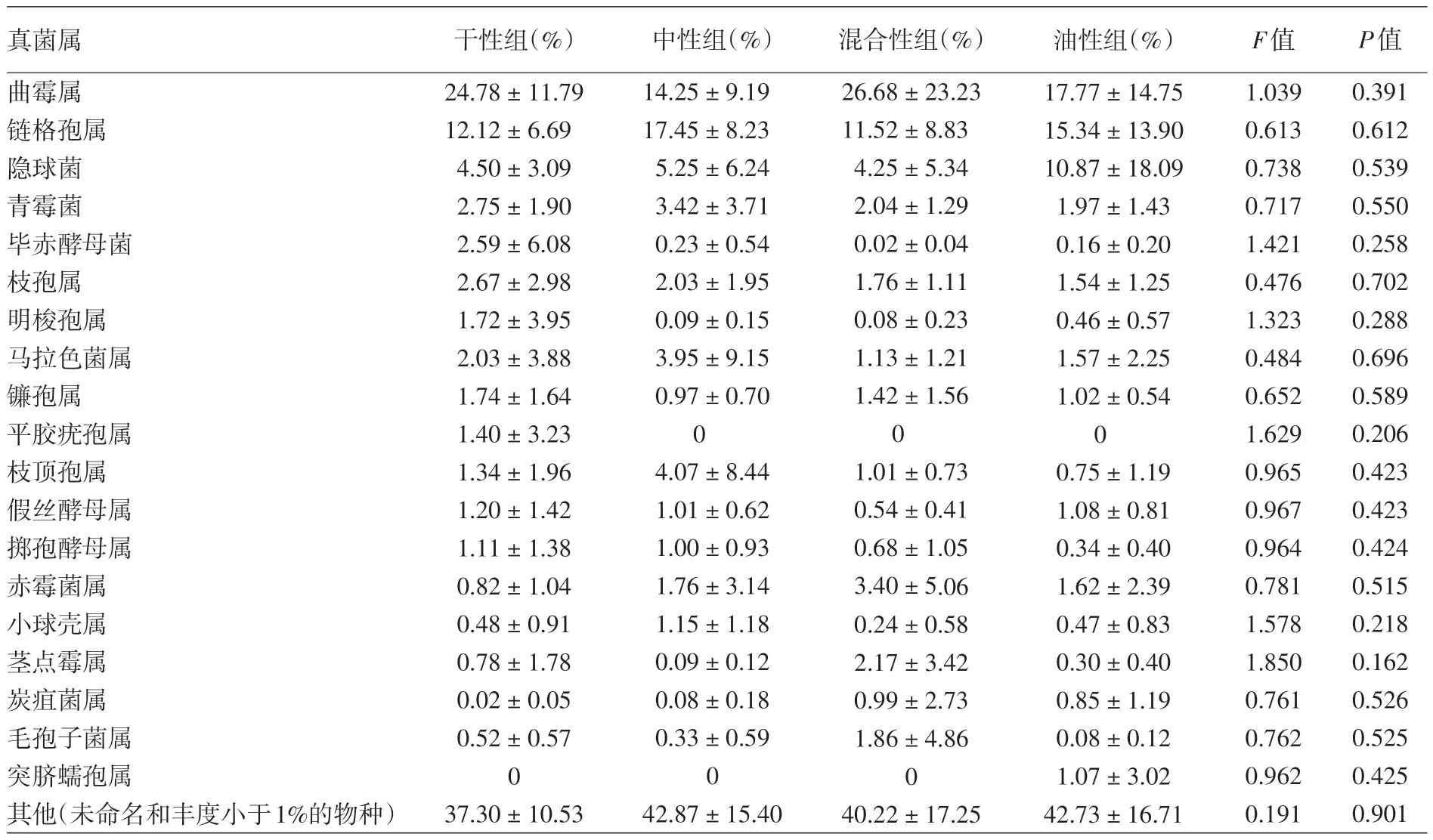
表2 健康年轻女性受试者不同主观类型皮肤真菌属(至少在一组中平均丰度大于1%)丰度的差异
本研究测序分析显示,成年健康女性皮肤细菌群落门水平上以放线菌门等4个菌门丰度较高;属水平上丙酸杆菌属占主要优势,其次为葡萄球菌属、链球菌属、红球菌属等,与已有研究结果相似[10,20];种水平上检测到表皮葡萄球菌 PM221 等4 个菌种丰度较高。真菌群落主要为子囊菌门和担子菌门,与以往研究中马拉色菌为主要皮肤真菌的结论不同[21],本研究中曲霉属和链格孢属在青年女性面部皮肤中丰度较高,而马拉色菌丰度不占主要优势。推测造成差异的原因可能与测试部位、人群、地域或实验方法相关。而且,真菌稳定性较细菌差。迟亮等[21]检测的是上海4例男性和4例女性额部真菌,与面颊相比,额部油脂分泌量更高,更有利于马拉色菌等亲脂性真菌的生长。且本研究采用的方法为棉拭子法,主要采集皮肤浅表微生物,对于毛孔等更深处微生物的采集存在一定缺陷。
不同皮肤类型细菌物种丰富度差异无统计学意义,但细菌物种多样性按干性、中性、混合性、油性皮肤类型顺序逐渐降低,干性皮肤多样性最高,油性皮肤多样性最低,与同一个体不同部位之间细菌组成的差异(干性部位多样性高,油性部位多样性低)类似[8]。细菌多样性与面部油脂含量整体变化趋势相反,说明面部皮肤油脂对皮肤细菌定植可能有选择性,与文献报道相符[10]。微生物组成结构比较发现,油性皮肤丙酸杆菌丰度极高,高油脂的环境为亲油性的丙酸杆菌提供了良好的生长条件,而丙酸杆菌的高丰度可能引起菌群之间的拮抗,从而导致油性皮肤多样性降低。中性皮肤是最理想的皮肤类型,皮脂分泌量和含水量基本保持平衡,皮肤屏障相对完整,属水平上链球菌、罗氏菌和放线菌相对丰度高于其他3组。干性皮肤丙酸杆菌-葡萄球菌-链球菌三种主要菌群的联合相对丰度较低,但微球菌和副球菌等非优势菌群相对丰度较高,且溶杆菌只存在于干性皮肤组。溶杆菌属大多数细菌对许多病菌有高效的拮抗作用,在植物病害预防中起重要作用,而干性皮肤的屏障功能有一定程度受损,容易继发病原菌的入侵和皮肤微生态失衡,溶杆菌属可能在其中扮演拮抗病原菌的角色[22]。不同皮肤类型真菌多样性和丰富度差异无统计学意义,可能由于皮肤类型间的差异对真菌定植的影响较小,或者由于本研究样本量较少,皮肤真菌丰度较细菌低,未发现其在不同类型皮肤间的差异。
综上所述,不同主观皮肤类型面颊皮肤生理指标和细菌多样性存在一定差异,皮肤细菌定植依赖主观皮肤类型,而真菌的定植则可能不依赖皮肤类型。本研究为“精准护肤”和皮肤疾病的预防提供理论支撑,但不同皮肤类型与微生物的关系还需要加大样本量进一步研究。
利益冲突所有作者均声明不存在利益冲突
