冻融周期卵裂期胚胎不同移植时机的临床结局对比
2019-08-24饶媚羊海涛黄柳静李春苑丘映通讯作者
饶媚 羊海涛 黄柳静 李春苑 丘映(通讯作者)
(广西医科大学第三附属医院生殖中心 广西 南宁 530021)
冻融胚胎移植是辅助生殖的常用手段之一。而FET成功妊娠的关键在于选择合适的胚胎移植时机[1]。一般认为自然周期排卵后第3天或人工周期行黄体酮转化内膜后第4天是卵裂期冻融胚胎的移植最佳时间。已经有研究多选择在自然周期排卵后第4天或人工周期行黄体酮转化内膜后第5天对卵裂期冻融胚胎进行移植。但是,还没有出现关于卵裂期冻融周期推迟胚胎移植时间对妊娠率产生影响的报道[2-3]。本文通过病例分析,探索冻融周期卵裂期胚胎移植的最佳时机,为冻融胚胎移植提供参考数据。
1.资料与方法
1.1 一般资料
收集南宁市第二人民医院生殖医疗中心在2015年8月—2016年4月期间共326个移植周期内施行卵裂期冻融胚胎移植的患者。原发不孕156例,继发不孕170例;各种不孕因素中盆腔输卵管因素为199例,排卵障碍患者14例,男性因素74例;不明原因不孕症患者39例。年龄、平均不孕年限等基本信息见表1。
纳入标准:(1)年龄不超过45岁;(2)到最近的IVF或ICSI超排卵治疗不少于3个月;(3)之前在本中心经IVF或ICSI助孕后有卵裂期胚胎冻存的患者。
排除标准:(1)合并未得到有效控制的内分泌疾病;(2)B超提示子宫内膜存在回声不均匀或宫腔内异常回声;(3)宫腔结核或粘连、子宫内膜出现息肉或粘膜下肌瘤、子宫有畸形以及子宫内膜异位症(Ⅲ-Ⅳ期)的患者。
1.2 分组
患者分为观察组(153例)和对照组(173例),分组依据为排卵后移植时间或黄体酮行内膜转化的时间。根据内膜准备方式不同将观察组分为自然周期组(冻融胚胎移植在排卵后第4天进行,A1)和人工周期组(冻融胚胎移植在黄体酮行内膜转化第5天进行,A2)。同样方式将对照组分为自然周期组(冻融胚胎移植在排卵后第3天进行,B1)和人工周期组(冻融胚胎移植在黄体酮行内膜转化第4天进行,B2)。根据冻融胚胎复苏经过夜培养后有无卵裂球增长,将两组均分为有卵裂球增长组和无卵裂球增长组(有卵裂球增长为:有1个或以上的卵裂球增长)。
1.3 胚胎评分及冻融
依据Edwards胚胎评分标准,依据卵裂球大小和数量等分为Ⅰ级、Ⅱ级、Ⅲ级和Ⅳ级胚胎。具体分级标准为Ⅰ级:卵裂球透亮,大小均等,细胞质均匀,无碎片;Ⅱ级:碎片少于10%;Ⅲ级:碎片10%~50%;Ⅳ级:碎片多于50%。其中Ⅱ级~Ⅳ级卵裂球大小不均。冷冻保存卵裂期胚胎标准:可以正常受精,在Ⅰ~Ⅱ级评分且有6~10个卵裂球细胞的胚胎。采用玻璃化法进行冷冻。
胚胎复苏在移植前一天下午进行,选择卵裂球复苏超过一半的胚胎在次日上午观察没有出现退化和凋亡现象的进行移植。
1.4 移植前子宫内膜准备工作
(1)自然周期组,阴道B超检查月经第10~11天卵泡大小及子宫内膜厚度。在优势卵泡直径超过14mm时,每天行B超监测卵泡发育,并结合患者当日血清LH、E2、P水平监测排卵时间,LH峰值日定义为D0,排卵当天为D1,排卵当日进行孕激素行子宫内膜转化。对照组和观察组的卵裂期冻融胚胎移植时间分别为排卵后第3天和第4天。
(2)人工周期组,在月经周期的第3~4天开始口服戊酸雌二醇(补佳乐,拜耳医药保健公司)每天2次,2mg/d,共5天;然后改为3mg/d,共5天。总计服补10天后检测血清LH、E2、P水平并监测B超子宫内膜厚度,根据血清E2水平和子宫内膜厚度调整补佳乐的用量,每日剂量不超过8mg,血清E2水平持续较低患者(E2<200pg/ml)或子宫内膜较薄患者(EM<7mm)给予0.5~1mg/d雌二醇片阴道用药。子宫内膜厚度超过8mm且E2超过0.2ng/ml时,进行孕激素行子宫内膜转化。对照组和观察组分别于内膜转化第4天和第5天进行卵裂期冻融胚胎移植。
1.5 黄体支持方法
自然周期的患者,于排卵后每日2次给予地屈孕酮每次10~20mg,加每天2次黄体酮软胶囊(安琪坦,法国法杏制药厂,200mg)阴道用药,或每日一支雪诺酮阴道缓释凝胶90mg。
人工周期的患者,具体方法(选择其中一种方式):每天1次黄体酮注射液肌内注射,每次60mg;每日2次地屈孕酮片,每次10mg;每日一支90mg雪诺同阴道缓释凝胶,每日2次地屈孕酮,每次10mg。患者在用药14天后检测血β-HCG,对于妊娠患者,黄体支持要到妊娠的10~12周。
1.6 胚胎移植与妊娠判断
移植数量依照《卫生部人类辅助生殖技术规范》标准同时结合患者实际情况确定,本次纳入研究的移植周期均为移植2个胚胎。移植超过一个月后B超检查发现胎心搏动或存在孕囊确认为临床妊娠。如B超发现胎心或孕囊而妊娠终止视为临床妊娠流产。妊娠在28周以上终止,胎儿有呼吸、心跳、随意肌收缩、脐带搏动至少其中一项生命体征则为活产。
1.7 统计学分析
2.结果
2.1 患者一般情况比较
两组患者的一般资料无统计学差异,见表1
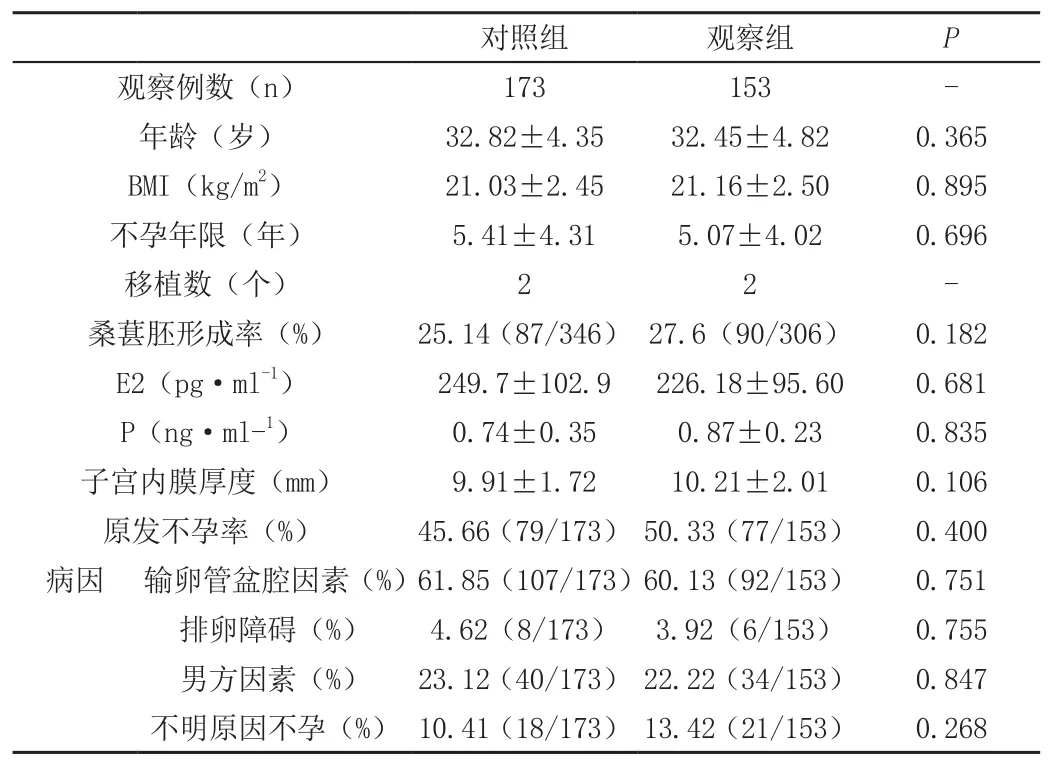
表1 两组患者的一般情况
2.2 临床结局比较
观察组临床结局各项指标均高于对照组(P<0.05);但两组流产率无统计学差异,见表2。
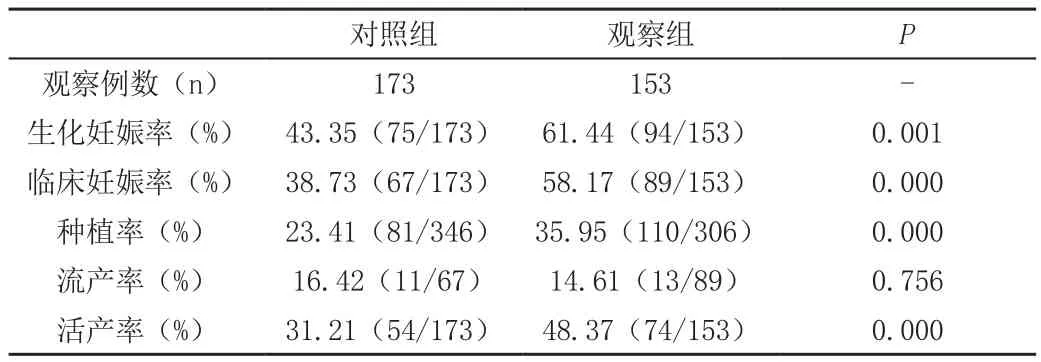
表2 两组临床结局比较
2.3 两组不同内膜准备方案妊娠结局对比
自然周期内膜准备方案中,A1组的生化妊娠率、临床妊娠率和活产率高于B1组,但两组之间差异无统计学意义;胚胎种植率A1组高于B1组(P<0.05),见表3。
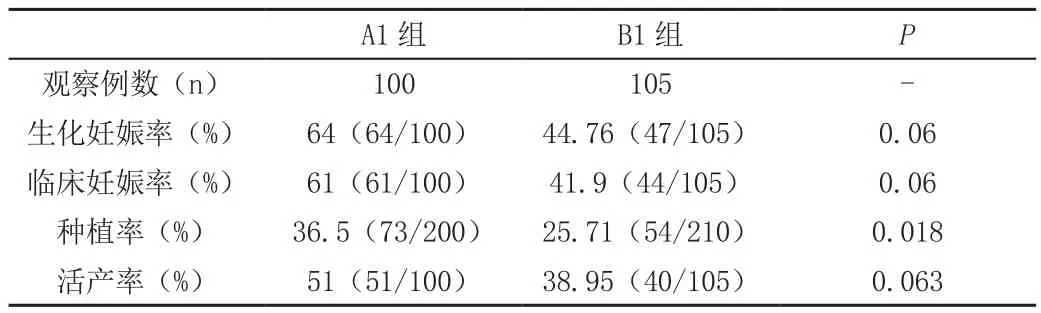
表3 A1组和B1组患者的比较
A2组的生化妊娠率似乎高于B2组的生化妊娠率,但P>0.05;A2组的胚胎种植率、临床妊娠率、活产率均高于B2组,差异均有统计学意义(P<0.05),见表4。
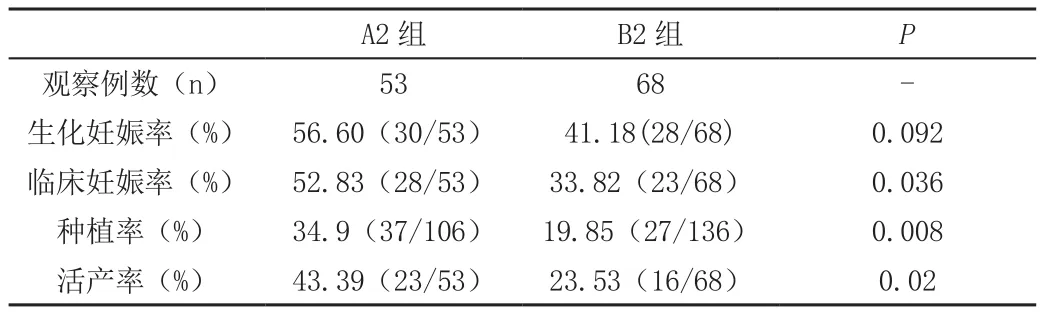
表4 A2组和B2组患者的比较
2.4 观察组中不同内膜准备方案妊娠结局对比
A1组种植率、生化妊娠率、临床妊娠率、活产率和A2组相比均无统计学差异,见表5。
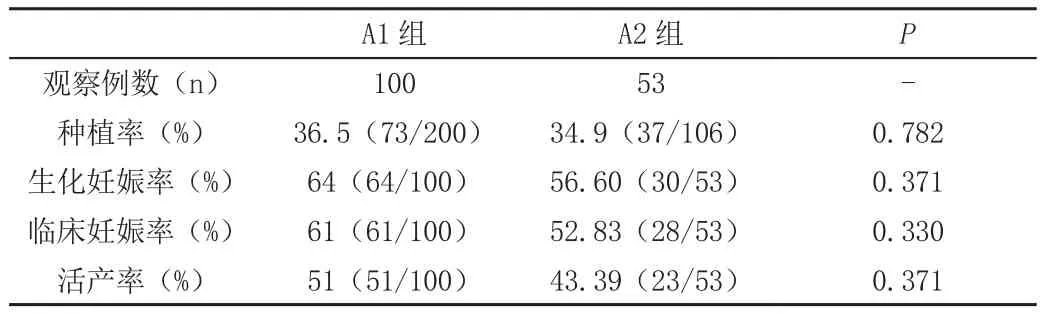
表5 A1和A2两组临床结局对比
2.5 两组复苏情况和妊娠结局对比
观察组有卵裂球增长组的生化妊娠率、临床妊娠率、种植率、活产率均高于对照组,差异均有统计学意义(P<0.05),见表6。
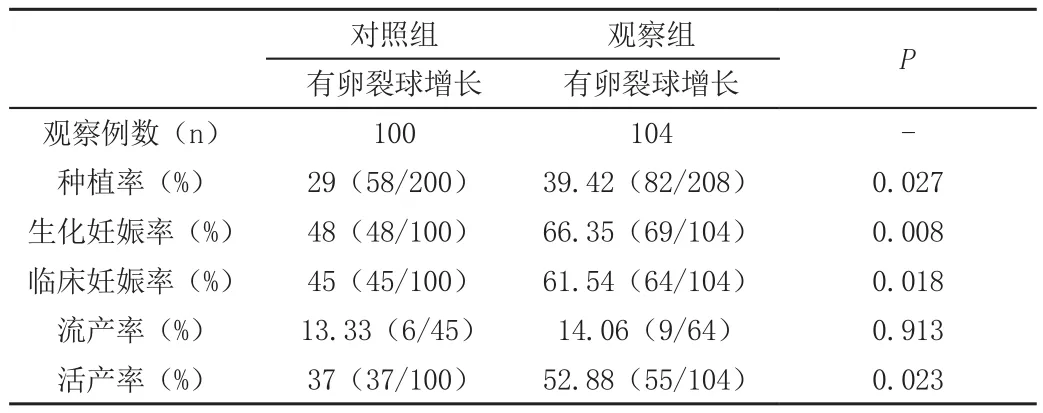
表6 两组卵裂球增长组妊娠结局对比
观察组中无卵裂球增长组的临床妊娠率、种植率均高于对照组,差异均有统计学意义(P<0.05);观察组中无卵裂球增长组的生化妊娠率、活产率高于对照组,但差异均无统计学意义(P>0.05),见表7。
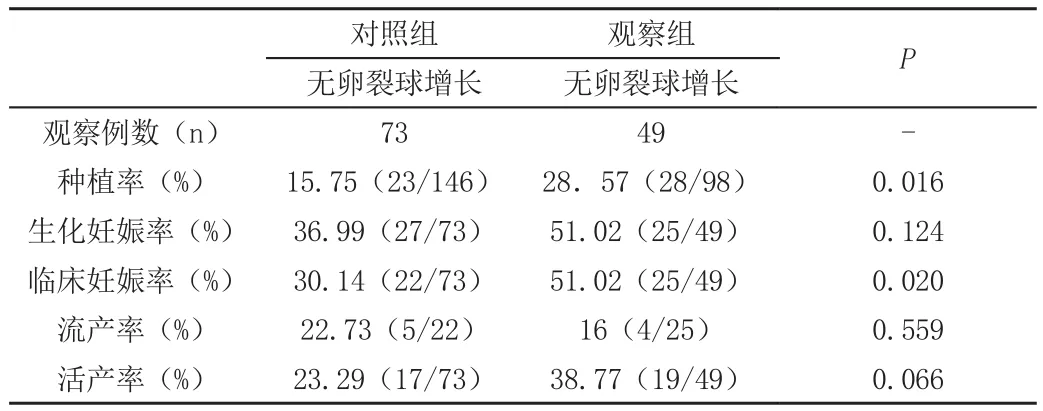
表7 两组无卵裂球增长组妊娠结局对比
两组经过夜培养后无论有无卵裂球增长,流产率相比均无统计学差异(P>0.05)。
3.讨论
由于辅助生育技术的发展和进步,超促排卵方案的改进,卵母细胞质量的提高、体外胚胎培养系统的不断完善,使得患者每一个采卵周相比较以前可以获得更多的胚胎,将患者新鲜周期移植后剩余的胚胎或者对因各种因素未能行鲜胚移植的患者的胚胎进行冷冻保存,以备在以后的冻融周期进行再次移植,已经常规应用于人类辅助生育技术中[3-4]。对胚胎进行冷冻保存,可以给患者提供更多的胚胎移植还有妊娠的机会;可以依据病人的情况灵活选定大概手术移植时间;能有效减少严重OHSS的发生[5];进而可减轻多次促排卵治疗对病人产生的经济压力[7-8]等等,然而在实际应用中,仍然有很多患者存在反复种植失败的的情况,导致临床的妊娠率下降,如何提高胚胎质量及改善子宫内膜容受性,是生殖研究的两大热点问题。
子宫内膜的发育和胚胎的发育是冻融周期中着床的重要条件[9]。所以,提高胚胎种植率和改善临床妊娠的关键是胚胎的发育同子宫内膜成熟的同步[10]。时间和空间对子宫内膜的容受性影响很大,月经周期的第20~24天一般是胚胎的着床窗,即LH高峰后的第7~11天[11]。在FET周期中适量的延迟胚胎移植的时间,能得到更高的妊娠比率。本次所纳入326个卵裂期冻融胚胎移植周期中,各组一般资料无统计学差异(P>0.05),避免了其它影响FET临床结局的因素。结果显示,与对照组相比,观察组生化妊娠率、种植率、临床妊娠率、活产率均高;在人工周期和自然周期的分组下观察组总的活产率高于对照组,说明在自然周期的排卵后第4天或人工周期第5天进行胚胎移植相对第4天有更高的胚胎种植率和临床妊娠率,说明延长一定程度的转化子宫内膜时间、相对减少子宫收缩,增加子宫内膜的容受性,缩短胚胎植入子宫腔后的发育和着床的间隔,可促使子宫内膜和胚胎发育的同步,进而增加临床妊娠率,在临床工作中也对工作安排提供便利[12-13]。
有报道,由于其解冻后存活胚胎数多于移植胚胎数,其认为过夜培养后可能挑选出更具发育潜能的胚胎,同时提出复苏后胚胎体外培养时间的延长有助于提高移植妊娠率,但其结论更多的倾向是体现胚胎质量和妊娠结局的关系[14-15]。本次所解冻的胚胎均为2枚,不能进一步选择胚胎,在排除了各种可能影响妊娠结局的因素的前提下,采用的解冻时间较常规解冻时间提前1天解冻,胚胎移植选择自然周期排卵的第4天和人工周期的第5天,可以获得较高的成功率。其原因在于解冻后的胚胎具有分裂发育能力,解冻体外培养一直到移植,大部分胚胎细胞数会增加,而在此时推迟1天进行移植可使胚胎的发育和子宫内膜成熟度一致度提高,这种胚胎和子宫内膜同步性导致了妊娠率的提高[16]。
综上所述,一定程度的推迟卵裂期冻融胚胎移植时间,能够获得较理想的胚胎种植率、临床妊娠率及活产率,改善临床结局。
