华卟啉钠光动力疗法对人舌鳞癌SCC-15细胞的作用
2019-08-22马垚张磊黄宇思刘鑫
马垚 张磊 黄宇思 刘鑫
口腔鳞状细胞癌(oral squamous cell carcinomas,OSCC)占口腔恶性肿瘤的90%以上[1],且发病率高、死亡率高、存活率低[2],目前临床以手术、化疗、放疗的综合序列治疗为主要治疗手段[3]。光动力治疗(photodynamic therapy,PDT)的原理是肿瘤组织选择性摄取并储存光敏剂,在特定波长的激光照射下,在有氧环境内发生一系列光动力反应产生大量活性氧,导致肿瘤细胞的坏死、凋亡和自噬[4]。华卟啉钠(sinoporphyrin sodium,DVDMS)是方起程教授研制的一种新型卟啉类光敏剂,它是由已应用于临床的第一代光敏剂Photofrin提纯的抗癌光敏活性部分,相同的抗癌光敏活性,仅为Photofrin用量的1/10,具有对肿瘤组织靶向性强,单态氧产率高,暗毒性低等特点,迄今全世界已有数万例患者接受Photofrin治疗,涉及的癌症多达数十种[5]。研究证明Photofrin光动力治疗舌癌,能够取得不错的临床疗效[6]。DVDMS作为一种新型卟啉类光敏剂,和其他卟啉类光敏剂一样,相比于正常细胞,能够更多的被肿瘤细胞所吸收[7-9]。本研究探讨DVDMS-PDT治疗对口腔舌鳞癌细胞增殖、凋亡和迁移能力的影响,期望为口腔癌的治疗提供新途径。
1 材料与方法
1.1 主要试剂、仪器及设备
华卟啉钠(哈工大声光动力实验室提供),635 nm激光器(哈工大声光动力实验室提供)(波长635 nm,连续输出方式,光功率密度15 mW/cm2),倒置显微镜(Nikon,日本);多功能酶标仪(MD SpectraMax M3,美国);流式细胞仪(BD,美国)。FBS(Gibco,Thermo Fisher公司,美国);胰蛋白酶、AnnexinV-PI双染试剂盒(碧云天公司);DMEM细胞培养基(HyClone公司,美国);CCK-8(同仁公司,日本)。SCC-15细胞由哈医大二院赠予。
1.2 试验方法
1.2.1 细胞培养 口腔鳞状细胞癌SCC-15用含1%青链霉素混合液、10%胎牛血清的DMEM高糖培养基,在37 ℃、5%CO2的孵箱中培养。SCC-15细胞2~3 d以1∶3传代1 次,传代3代后用于正式实验。
1.2.2 DVDMS的配制 在避光条件下,将DVDMS粉末溶于双蒸水中配制成8 mg/ml,后续实验所需的DVDMS均由无血清DMEM稀释而成。
1.2.3 CCK-8法检测DVDMS细胞毒性 SCC-15细胞以细胞密度为1×104个/孔接种到96孔板,药物浓度为0(空白对照组)、0.1、0.5、1、2、4、6、8 μg/ml共8 组,24 h后加入CCK-8试剂10 μl/孔,避光培养2 h,用酶标仪检测450 nm波长处吸光度(A)值。按公式计算细胞存活率(%)=(实验组平均A值-本底组平均A值)/(对照组平均A值-本底组平均A值)×100%,重复3 次实验。
1.2.4 DVDMS的细胞孵育时间 种板同上,加入药物浓度为2 μg/ml的DVDMS 100 μl,避光孵育0(对照组)、1、2、3、4、5、6,、7、8、9 h共10 组,使用含有底度功能的酶标仪M3检测吸光度(A)值。其荧光强度用实验组A值与对照组A值的差值来表示。以细胞密度为1×106个/皿将SCC-15细胞接种到小皿内,加入药物浓度为2 μg/ml的DVDMS 2 ml,避光孵育0、2、6、8 h共4 组,荧光显微镜下观察其荧光强度。
1.2.5 CCK-8法检测DVDMS-PDT处理后细胞存活率 种板同上,将细胞随机分成对照组(Control),单药组(DVDMS alone),单光组(Light alone)和DVDMS-PDT组,单药组和DVDMS-PDT组避光加入100 μl DVDMS浓度分别为0.5、1、2 μg/ml,对照组和单光组加入等量的无血清培养基,避光孵育6 h后单光组和DVDMS-PDT组的光照剂量为0.9、1.8、3.6、5.4 J/cm2。光照处理后,继续孵育24 h,计算细胞存活率。
1.2.6 Annexin V-PI检测细胞凋亡 以细胞密度为1×106个/孔将SCC-15细胞接种到6孔板内,分组同上,单药组和DVDMS-PDT组避光加入2 μg/ml的DVDMS 3 ml,对照组和单光组加入等量的无血清培养基,避光孵育6 h后单光组和DVDMS-PDT组光照剂量为3.6 J/cm2。处理24 h后,Annexin V-PI染色处理,用流式细胞仪检测。
1.2.7 划痕实验分析细胞迁移能力 细胞分组及处理同1.2.6。在孔中央纵轴方向用10 μl的枪头划出一条划痕,分别于0、48 h取样,倒置显微镜下观察划痕处细胞迁移状态,计算划痕愈合百分比=(最初划痕面积-48 h时划痕面积)/最初划痕面积。
1.3 统计学处理
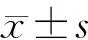
2 结 果
2.1 DVDMS对SCC-15的细胞毒性
4、6、8 μg/ml组细胞存活率分别为(89.10±2.35)%、(86.94±2.54)%、(83.96±2.22)%,低于对照组的(100±3.17)%(P<0.05)。2 μg/ml组的细胞存活率为(93.72±2.24)%。实验结果表明DVDMS浓度≤2 μg/ml对SCC-15细胞的细胞存活率没有明显影响,当达到一定浓度(≥4 μg/ml)后,随着DVDMS浓度的升高SCC-15细胞的细胞存活率逐渐下降(图 1)。
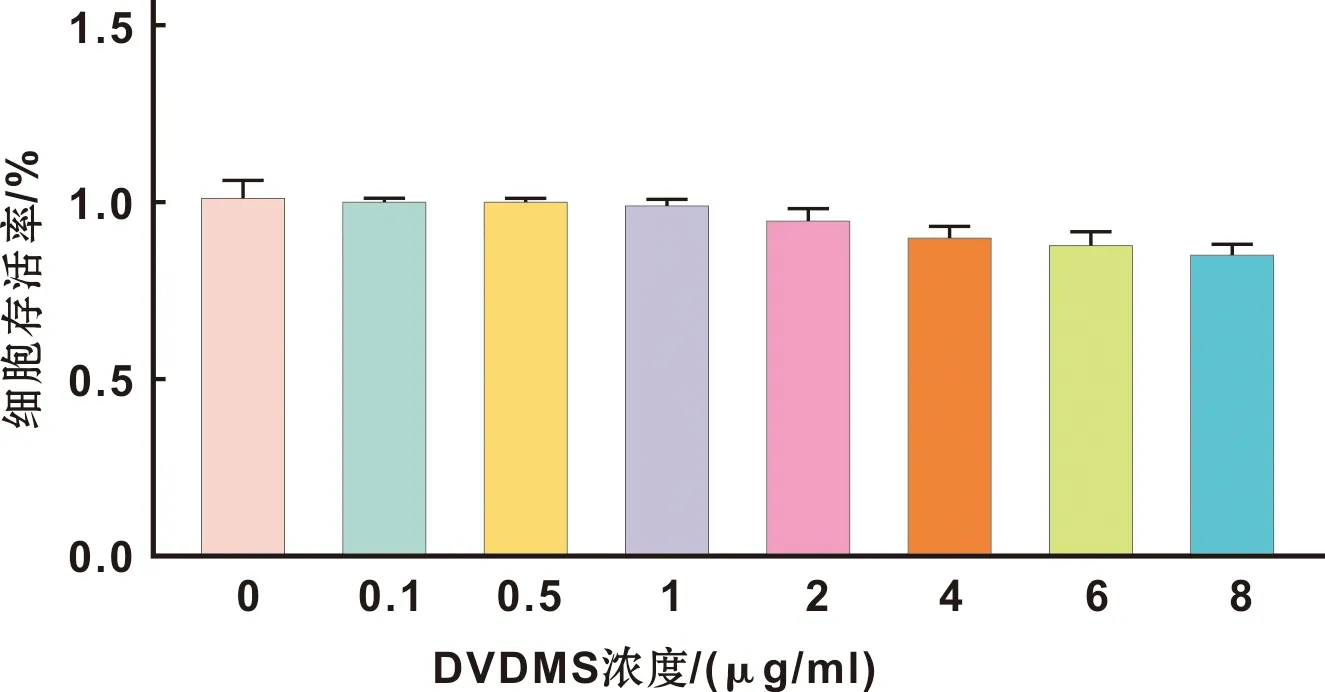
图 1 CCK-8检测DVDMS毒性
2.2 DVDMS的细胞孵育时间
在0~6 h之间,随着孵育时间的增长,细胞荧光强度也相应增强,6 h时达到顶峰,随后随着孵育时间的增加细胞荧光强度没有明显变化(图 2)。荧光显微镜下观察细胞荧光强度,发现孵育6 h和8 h的细胞荧光强度明显强于孵育2 h的,而6 h和8 h的荧光强度没有显著的差异(图 2),从而进一步验证了DVDMS在SCC-15细胞内孵育6 h为最佳。
图 2 DVDMS的荧光强度与细胞孵育时间 (×200)
Fig 2 The fluorescence intensity of DVDMS incubation time with the SCC-15 cells (×200)
2.3 DVDMS-PDT处理后SCC-15细胞存活率
光敏剂的剂量和光照强度决定了光动力疗法不同的细胞毒效应。CCK-8法检测不同DVDMS浓度结合不同光剂量对SCC-15细胞的毒效应(图 3),单药组和单光组的细胞存活率与空白对照组相比没有显著性差异,说明单纯的低浓度DVDMS或单纯的低剂量光照对SCC-15细胞无明显的抑制作用。当DVDMS浓度为2 μg/ml,光照剂量为0.9、1.8、3.6、5.4 J/cm2,其细胞存活率分别为(83.90±2.86)%、(73.10±3.55)%、(58.43±4.95)%、(33.51±3.50)%,当光照剂量为3.6 J/cm2,DVDMS的浓度分别为0.5、1、2 μg/ml时,其细胞存活率为(88.52±2.13)%、(71.74±2.69)%、(58.43±4.95)%,表明DVDMS-PDT对SCC-15细胞毒效应呈现出药物剂量和光照强度依赖性。
2.4 流式细胞仪检测细胞凋亡
利用流式细胞仪检测单纯对照组、单光组、单药组、DVDMS-PDT组的细胞凋亡率分别为(10.19±1.17)%、(11.99±1.13)%、(11.98±0.69)%、(42.79±3.03)%(图 4)。DVDMS-PDT组与单纯对照组、单光组、单药组相比,P<0.001。而单光组和单药组与单纯对照组相比P>0.05。

与对照组相比,*P<0.05 ,**P<0.01 ,***P<0.001
图 3 DVDMS-PDT处理后细胞存活率
*P<0.05,**P<0.01,***P<0.001vscontrol group
Fig 3 Cell viability after DVDMS-PDT treatment
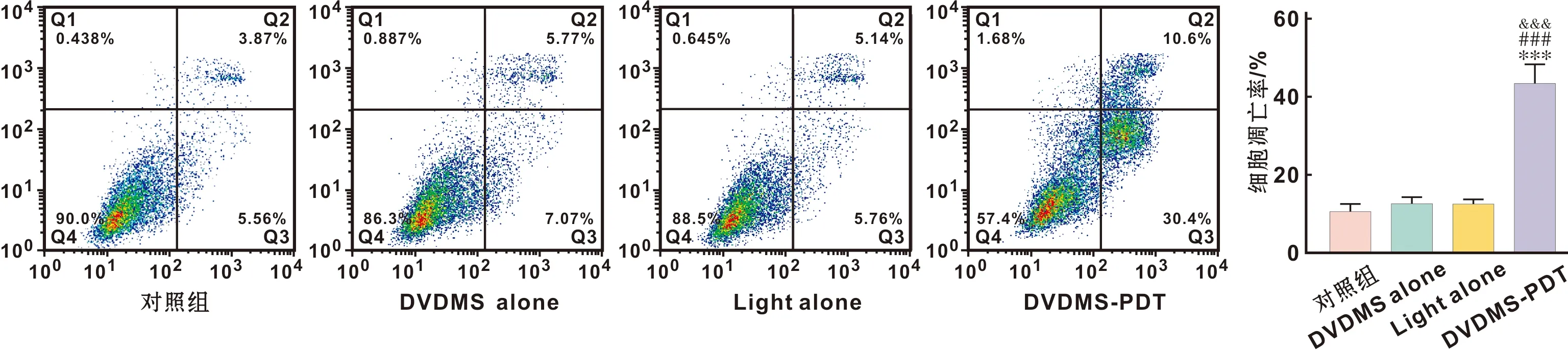
图 4 流式检测SCC-15细胞凋亡
2.5 划痕实验检测细胞迁移能力
单纯对照组、单药组、单光组较多细胞迁移到划痕区域,而DVDMS-PDT组细胞迁移相较其他3 组较少(图 5)。单纯对照组、单药组、单光组、DVDMS-PDT组的划痕愈合百分比分别为(81.60±5.14)%、(74.31±10.85)%、(77.62±6.54)%、(18.68±10.04)%。DVDMS-PDT组与单纯对照组、单光组、单药组相比P<0.05。单光组和单药组与单纯对照组相比P>0.05。

图 5 划痕实验检测SCC-15细胞的迁移能力 (×100)
Fig 5 Migration ability of the SCC-15 cell detected by a scrath assay (×100)
3 讨 论
舌鳞癌是最常见的口腔癌,常发生早期颈淋巴结转移,且转移率较高。据报道,目前临床上应用PDT治疗头颈部肿瘤均取得不错的疗效[10-11],尤其以浅表性肿瘤(如口腔舌鳞癌)效果更佳[12-13]。有研究表明,已应用于临床的卟啉类光敏剂5-ALA对于恶性胶质瘤患者而言,会选择性的聚集在肿瘤组织内,而在正常脑组织内聚集相对较少[14]。5-ALA、Photofrin对皮肤癌、肺癌、宫颈癌等均取得了一定的疗效[15-17]。而本实验所应用的光敏剂DVDMS目前虽尚未在临床上应用,但其抗癌作用在动物实验上也取得了不错的成果[7,18],并且正常治疗剂量的华卟啉钠并无明显的不良反应[19]。事实上,光动力对口腔疾病的作用并不仅限于口腔癌的治疗,它还有明显的防龋作用[20]。本实验在既往研究的基础上,主要研究DVDMS-PDT对口腔舌鳞癌的杀伤作用。
PDT的疗效受光敏剂种类和浓度、光能量密度和组织氧浓度等因素的影响。光敏剂的孵育时间能够影响细胞内光敏剂的量,因而也是影响PDT疗效的重要因素,本实验研究证明光敏剂DVDMS在SCC-15细胞内孵育6 h达到饱和。
为进一步研究DVDMS-PDT对SCC-15细胞的杀伤作用,本实验采用不同光敏剂浓度及不同光照剂量处理SCC-15细胞。CCK-8结果表明:DVDMS-PDT治疗能有效抑制SCC-15细胞增殖,且有明显的剂量-效应关系,即随着药物浓度的升高和光照剂量的增大,细胞的杀伤作用越明显。DVDMS-PDT能够杀伤肿瘤细胞的主要机制为DVDMS能够选择性积聚在肿瘤组织,经光照激发产生级联反应,在这种光动力反应过程中产生大量活性氧物质,这些活性氧物质是DVDMS-PDT杀伤作用的关键[18]。活性氧的产生能够引起细胞凋亡、F-actin微丝解聚[21]和蛋白质的氧化损伤[22],最终起到杀伤肿瘤组织的作用。
流式细胞仪检测结果显示,与对照组相比,单纯的DVDVMS及单纯的光照治疗的凋亡率无明显差异(P>0.05),而DVDMS-PDT处理后SCC-15细胞凋亡率显著高于对照组(P<0.001),这一结果说明了DVDMS介导的PDT治疗能够诱导人口腔舌鳞状细胞癌SCC-15细胞发生凋亡。关于DVDMS-PDT诱导细胞凋亡可能有以下途径:①线粒体介导的凋亡途径(内源性途径):受Bcl-2家族蛋白的调控,线粒体膜通透性改变,使细胞色素C释放进入胞质,与凋亡相关因子Apaf-1结合,活化的Apaf-1激活Caspase-9,通过Caspase-9激活下游的Caspase-3,诱导细胞凋亡。②死亡受体介导的凋亡途径(外源性途径):死亡受体Fas与配体FasL结合后,活化的Fas的死亡结构域(death domain,DD)相互积聚并与接头蛋白分子(FADD)相互结合。FADD的死亡效应结构域(death effector domain,DED)与Caspase-8的DED结合,激活Caspase-8,形成有Fas、FasL、FADD、Caspase-8组成的复合物。激活Caspase-3,引发细胞凋亡的级联反应,诱导细胞凋亡。已有研究证实[13],DVDMS-PDT治疗可以造成线粒体膜电位的改变。
细胞划痕结果显示DVDMS-PDT组的伤口愈合百分比明显低于对照组,差异具有统计学意义(P<0.01),而单光组和单药组与对照组之间的伤口愈合百分比无明显差异(P>0.05),由此可见DVDMS-PDT治疗显著抑制了SCC-15细胞的迁移能力。金属基质蛋白酶(metrix metalloproteinases,MMPs)能降解位于肿瘤细胞表面及周围的细胞外基质和基底膜,破坏阻碍细胞侵袭转移的天然屏障,在恶性肿瘤细胞的浸润和转移中发挥作用[23]。DVDMS-PDT能够抑制肿瘤细胞的迁移能力可能与MMPs表达受到抑制有关。
本实验主要进行了DVDMS-PDT对口腔舌鳞癌杀伤作用的体外实验,其具体的杀伤机制及在动物体内的杀伤作用有待继续研究。
