VEGF过表达的骨髓间充质干细胞对大鼠牙槽骨缺损修复的影响
2019-08-22周芳朱勇唐成芳王丹杨李雪黄硕
周芳 朱勇 唐成芳 王丹杨 李雪 黄硕
骨髓间充质干细胞(BMMSCs)具有多向分化潜能,为近期组织工程中骨骼损伤修复的研究热点[1]。研究报道BMMSCs被应用于口腔牙周损伤的修复[2]。血管内皮生长因子(VEGF)是具有促进血管内皮生长及生成的糖蛋白,其参与骨愈合相关过程。研究表明,VEGF作为旁分泌因子促进骨折的修复、重塑过程,为骨形成或修复的正性调节因子[3-4]。本研究拟将二者优势结合,通过转染BMMSCs使其VEGF过表达并筛选稳定表达的细胞株,制作诱导成骨膜片,观察VEGF过表达的膜片对大鼠牙槽骨损伤修复的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD雄性大鼠40 只,体重(200±20) g ,由常州卡文斯实验动物有限公司提供,动物质量合格证号(201722172)。
1.1.2 试剂 α-MEM培养基(Sigma公司,美国);胎牛血清(FBS)(GIBCO公司,美国);胰蛋白酶(Hyclone公司,美国);VEGF过表达载体转染试剂盒(上海吉玛公司);VEGF抗体、GAPDH抗体及羊抗小鼠IgG-HRP 抗体(CST公司,美国);维生素C、茜素红、油红O、多聚甲醛、无水乙醇及其他分析纯(国药集团化学试剂有限公司)。
1.1.3 主要仪器 PIPETMAN L微量可调加样器(Gilson公司,法国);Allegra 64R Centrifuge台式高速冷冻离心机(Beckman Coulter公司,美国);CKX41倒置显微镜(Olympus公司,日本);Thermo 311二氧化碳培养箱(Thermo scientific公司,美国);BCM-1300A超净工作台(苏净安泰公司)。
1.2 方法
1.2.1 BMMSCs提取、分离培养及鉴定 取4 只SD大鼠脱臼处死,按文献[1]方法提取分离BMMSCs,细胞以10% FBS 的α-MEM培养基培养在37 ℃、 5% CO2及饱和湿度条件的培养箱中,经48 h培养贴壁的细胞即为BMMSCs。按文献[5]方法进行鉴定。
1.2.2 BMMSCs VEGF过表达转染、筛选及验证 细胞汇合度达70% 时开始转染,参考文献[6]以说明书方法将带有表达绿色荧光的空载载体病毒液和VEGF过表达载体病毒液加入BMMSCs中,分别命名为对照组和过表达组,放入培养箱培养16 h,弃去上清并用PBS洗3 遍,加入全培养基继续培养,稳定传代1 周后用嘌呤霉素筛选稳定表达的细胞株,荧光显微镜和Western blot实验验证转染效率。
1.2.3 成骨膜片的制作及验证 将筛选的稳定转染的过表达组和对照组BMMSCs胰蛋白酶消化5 min, 1 000 r/min离心10 min后以含10%FBS的α-MEM培养基重悬计数。按每孔3×105个/孔接种于6 孔板。放入培养箱培养,24 h时以10%FBS、50 mg/L维生素和α-MEM培养基配备膜诱导液,更换培养基为成膜诱导液,后间隔2 d换液1 次,16 d完成膜片制备,获得的2 组膜片部分用来Vonkossa染色,显微镜下观察膜片的组织结构。
1.2.4 建立牙槽骨损伤模型并植入细胞膜片 取36 只SD大鼠,以40 mg/L的2%的戊巴比妥钠麻醉,手术暴露大鼠上颌骨并用牙科钻在上颌骨两侧第一磨牙近中舌侧牙槽骨造3 mm×3 mm×1 mm长方体骨缺损区域。大鼠上颌牙槽骨缺损处植入过表达组和对照组细胞膜片。同时以不植入细胞膜片设立空白组,每组12 只大鼠。而后缝合黏膜,术后注射抗生素3 d。
1.2.5 Micro-CT扫描 分别在术后第2、4、 6、 8周脱颈处死大鼠3 只, 取上颌骨置于4%的多聚甲醛固定, Micro-CT扫描并观察牙槽骨缺损处成骨情况。
1.2.6 用Western blot法检测VEGF蛋白表达 细胞培养汇合至70%,按实验要求处理细胞后,按文献[7]的方法进行蛋白提取、SDS-PAGE电泳、转膜,及封闭。按需求加入VEGF抗体(1∶1 000)或GAPDH抗体(1∶1 000)4 ℃温育过夜。次日,TBST洗膜3 次, 加入相应的辣根过氧化物酶标记二抗(1∶2 000),室温杂交1 h,PVDF膜以化学发光试剂盒进行显色,用Syngene Imaging System进行成像,用Image J对蛋白印迹条带进行处理和分析。
1.3 统计学处理
2 结 果
2.1 BMMSCs及过表达VEGF的BMMSCs的形态及鉴定
分离传代后的BMMSCs形态多为菱形,生长状态良好。过表达组和对照组BMMSCs在荧光显微镜下可见明显绿色荧光。Western blot实验发现与对照组相比,过表达组BMMSCs中VEGF表达提高(83.1±4.8)%(P<0.05)(图 1)。

图 1 各组BMMSCs形态、转染后荧光和蛋白表达情况
2.2 细胞膜片制备后鉴定
过表达组和对照组膜片进行Vonkossa 染色,发现2 组膜片矿化结节染色阳性,如图 2黑色箭头所示,可见细胞外局部有黑色钙结节。
2.3 牙槽骨损伤修复效果
与空白组相比,随时间延长对照组牙槽骨修复效果较好,在第4和8 周结果具有统计学意义;与对照组相比,随时间延长过表达组牙槽骨修复效果较好,在4、6和8 周结果具有统计学意义,数据见表 1。
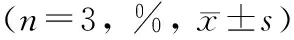

Tab 1 Changes in bone volume fraction in the 3 groups (n=3, %,
注: 与空白对照组比较, ①P<0.05; 与对照组比较, ②P<0.05

图 2 2 组BMMSCs膜片Vonkossa 染色结果
3 讨 论
拔牙、牙齿长期缺失或增龄性变化等原因,都会导致牙槽骨缺损,而牙槽骨缺损为后续牙齿修复带来了很多困难。研究发现,前倾及水平阻生的下颌第三磨牙拔除后会造成下颌第二磨牙远中牙槽骨的缺损[8]。传统骨损伤的修复为自体或同种异体移植术,因存在供区并发症和免疫反应,所以急需新的骨损伤修复方法。组织工程学的兴起为骨损伤修复提供了新的解决方案。BMMSCs为组织工程学成骨转化和修复骨缺损的工具细胞[9]。多方研究报道BMMSCs在软骨损伤修复中具有明显优势[9-11]。然而,单纯以BMMSCs为工具的骨修复还不能达到理想目的。研究发现VEGF可通过细胞外信号调节激酶途径促进BMMSCs的增殖[12]。而另有文献报道,VEGF作为旁分泌因子促进骨折的修复、重塑过程,为骨形成或修复的正性调节因子[3-4]。这些都提示,VEGF在骨修复中可能发挥重要作用。
本研究提取分离BMMSCs,并通过转染BMMSCs使其VEGF过表达,进一步实验制作诱导成骨膜片,建立牙槽骨损伤模型并植入膜片,观察VEGF过表达的膜片对大鼠牙槽骨损伤修复的影响。定期进行Micro-CT检测发现,与空载转染组相比,VEGF过表达的BMMSCs成骨诱导膜片明显增强大鼠损伤牙槽骨的修复。提示VEGF可能通过促进BMMSCs功能的发挥或自身的分泌增强大鼠损伤牙槽骨的修复,然而具体机制还有待于进一步研究。本实验还在动物实验阶段,需要临床进行验证。总之,本研究发现VEGF过表达的骨髓间充质干细胞能增强大鼠牙槽骨损伤的修复。
