细胞与生物信息学鉴定3种circRNA参与调节人类膀胱癌侵袭能力的研究
2019-08-21康业李沪徐冉张磊赵晓昆王荫槐朱煊
康业 李沪 徐冉 张磊 赵晓昆 王荫槐 朱煊
膀胱癌是泌尿生殖系统恶性肿瘤之一,男性的发病率约为女性的4倍[1]。膀胱癌一直是治疗难度较大的恶性肿瘤之一[2],尽管在了解其分子发病机制方面取得了很大进展,但关于膀胱癌发生、发展和转移的详细机制仍有待阐明。早期研究表明,膀胱癌的基因突变主要集中在染色质重塑和调节细胞周期途径的基因上[3],如TP53[4]、HRAS[5]、FGFR3[6]等。随着研究的不断深入,许多长链非编码RNA(long non-coding RNA, lncRNA)和环状RNA(circular RNA, circRNA)被发现参与了肿瘤的发生和发展,是调节肿瘤发生和转移的重要因素之一[7-9]。
CircRNAs是一类内源性调节非编码RNA,通过从许多真核基因的前体mRNA反向环化产生[10]。此类RNA通常以低水平转录,但它们的转录在各种细胞和组织中广泛存在[11-13]。本研究中,我们将重点鉴定膀胱癌中差异表达的circRNA。膀胱癌可因侵袭程度的不同分为肌层浸润与非肌层浸润两种,其中肌层浸润性膀胱癌约占膀胱肿瘤的30%[1-2],其术后复发率和死亡率要远高于非肌层浸润性膀胱癌。针对这一分类进行研究,将有助于了解膀胱癌侵袭能力变化的机制。
材料与方法
一、材料
1.标本来源:选取2018年1月至2019年1月在中南大学湘雅二医院就诊确诊为膀胱癌,并行手术治疗的患者。依据研究目标设定入选标准:初发的膀胱癌;术前未行新辅助化疗;随访资料完整。排除标准:术后病检为非尿路上皮癌;复发性膀胱癌;术后随访时间不连续,随访资料不完整。在circRNA测序阶段,3组癌旁、非肌层浸润癌组织及肌层浸润癌组织分别来自3例不同的患者。3组标本的获取流程:选取因膀胱多发肿瘤行膀胱全切的患者,每处肿瘤均取材2份,1份于-80 ℃保存,1份于10%甲醛固定,常规石蜡包埋切片,行HE染色后,病理阅片,筛选出同时具有非肌层浸润和肌层浸润的病例3组,连同相应癌旁标本,进入测序实验阶段。验证阶段,10例非肌层浸润癌组织及10例肌层浸润癌组织分别来自于不同的20例膀胱癌患者,样本清洁处理后储存于-80 ℃冰箱。本研究中,共收集23例膀胱尿路上皮癌患者组织及相应的临床、病理数据。本研究获得中南大学湘雅二医院医学伦理委员会批准,收集患者组织前均充分告知患者,并与患者签署知情同意书。
2.实验试剂:检测引物合成自生工生物工程(上海)股份有限公司;RNA-seq测序委托上海若谷生物科技有限公司(BIOAIDE)进行;Trizol购自美国Invitrogen公司;qPCR试剂、逆转录试剂盒购自美国Thermo公司;细胞培养液、胎牛血清购自美国 Gibco公司;人膀胱上皮永生化细胞SV-HUC-1和4种膀胱癌细胞系(T24、J82、5637、SW780)购自中国典型培养物保藏中心,并经STR鉴定正确;Transwell孔板小室购自美国Corning公司;基质胶购自美国BD公司。
二、病理组织学检查
整理收集到的膀胱癌组织,截取部分组织使用10%的甲醛固定,进行常规石蜡包埋与切片。对组织切片进行HE染色后封片烤干,在光学显微镜下观察,确定肿瘤的病理分期和分级,并进行记录与分类。所有标本病理诊断均由中南大学湘雅二医院病理科完成。
三、转录组测序与数据分析
根据测序公司方案,选取9例临床组织(癌旁组织、非肌层浸润癌组织、肌层浸润癌组织各3例)进行转录组测序。使用Trizol分离临床样本的总RNA。用NanoDrop定量提取的RNA,确定RNA质量合格。干冰保存运输送交上海若谷生物科技有限公司(BIOAIDE)进行转录组测序。
对原始RNA-seq数据进行分析质控。去除低质量数据和有偏差的数据,进行数据过滤和质控;然后将RNA-seq数据比对到参考基因组序列;将测序得到的reads比对到参考基因组序列上进行统计计算,进而得到基因的表达量结果。使用ACFS2软件进行circRNA的检测、鉴定以及定量circRNA丰度。
根据样本类型对表达量数据进行差异分析,由此提取差异显著的circRNA。本次差异筛选算法以及标准化方式如下:显著差异基因的算法:DESeq2-Counts(Needs Rep);筛选标准:log2FC>0,P>0.01。分析比较组:肌层浸润癌组织vs非肌层浸润癌组织;非肌层浸润癌组织vs癌旁组织;肌层浸润癌组织vs癌旁组织。
统计符合差异标准的基因,进行分类筛选与统计。重点分析肌层浸润癌组织vs非肌层浸润癌组织的显著差异circRNA,结合已有研究内容,筛选与膀胱癌侵袭相关性高的circRNA。
四、qPCR检测circRNA在临床组织样本中的表达差异
为了进一步证实转录组circRNA测序中差异表达的circRNA结果,采用Trizol法提取20例样本组织(10例非肌层浸润膀胱癌组织、10例肌层浸润膀胱癌组织)的总RNA,经检测RNA浓度与纯度均达标,进行RNA逆转录成cDNA。通过SYBR Green在20 μl含有2 μl cDNA、0.5 μmol/L正向引物和0.5 μmol/L反向引物的反应中进行定量RT-PCR。PCR设定在95 ℃下10 min预变性,40个循环 (95 ℃ 10 s和60 ℃ 60 s)。PCR检测一式3份同时进行。以GAPDH作为内参,通过2-ΔΔCt法计算circRNA的相对表达水平。
设计3种circRNA(circST6GALNAC6、circPRUNE2、circMYH11)、内参基因GAPDH的qPCR检测引物。引物信息见表1。

表1 circRNA qPCR检测引物信息
五、细胞培养与本底circRNA表达水平检测
细胞培养环境均为37 ℃、5% CO2。人膀胱上皮永生化细胞SV-HUC-1使用F12K培养液(10%胎牛血清)培养,人膀胱癌细胞T24使用DMEM培养液(10%胎牛血清)培养,J82使用MEM培养液(10%胎牛血清)培养,5637与SW780在RPMI-1640培养液(10%胎牛血清)中培养。
将上述细胞于6孔板中进行培养,定期查看培养状况与密度。选取生长状况良好、60%~70%密度的培养孔收集细胞。Trizol法提取细胞总RNA,质检合格后逆转录为cDNA,参照膀胱癌组织qPCR检测体系与条件(方法四),检测细胞中circRNA的相对表达水平。
六、Transwell侵袭实验检测膀胱癌细胞侵袭能力
准备好基质胶、无血清培养液与完全培养液。基质胶和无血清培养液的比例按1∶5稀释后取60 μl均匀铺在24孔板Transwell上室。将4种膀胱癌细胞用胰酶消化后,加入无血清培养液重悬,在单孔Transwell上室中加入200 μl悬液,下室加入600 μl完全培养液,每种细胞设3孔重复。培养48 h后,取出小室,清洗固定后进行结晶紫溶液染色。光学显微镜观察,3个视野/孔,计数侵袭细胞数。
七、统计学方法
使用Graphpad Prism软件进行统计学分析,统计数据以均数±标准差展示,两组样本间比较采用t检验,P<0.05为差异具有统计学意义。
结 果
一、病理组织检查结果
通过组织学观察确定病理组织情况,HE染色观察癌旁组织、非肌层浸润癌组织和肌层浸润癌组织,见图1。
二、转录组测序数据分析
针对不同的转录组测序分析比较组别,统计整体显著性差异基因,详见表2。
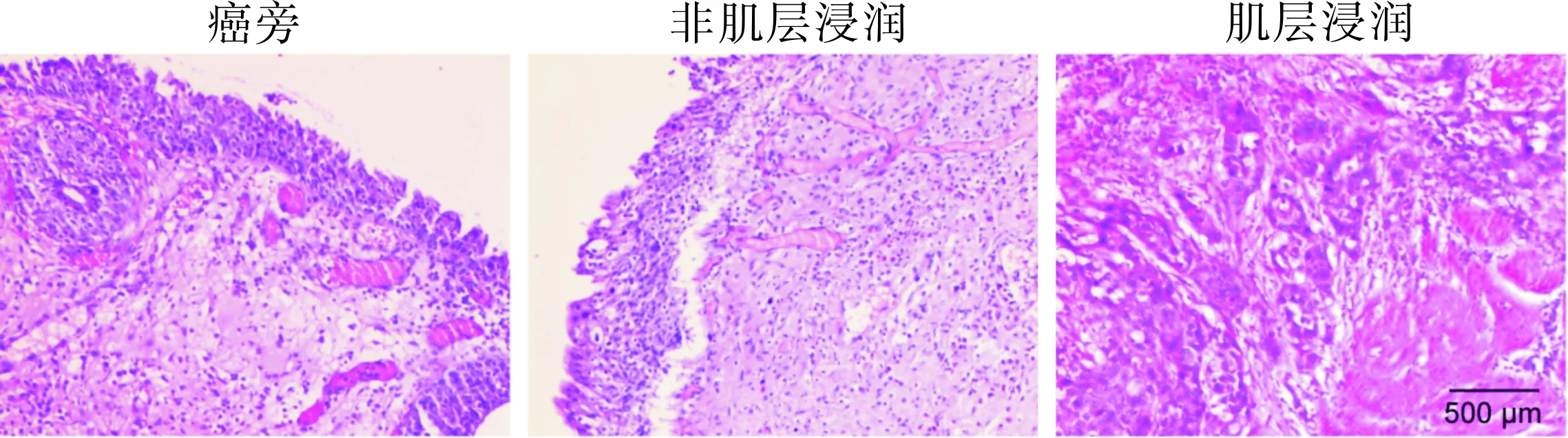
图1 3种膀胱癌组织病理切片(HE染色,×100)

比较组所有差异基因数目显著性上调基因数目显著性下调基因数目肌层浸润癌组织vs非肌层浸润癌组织40 68821095非肌层浸润癌组织vs癌旁组织38 971300581肌层浸润癌组织vs癌旁组织37 9579978
注:差异基因数目为所有可统计的差异circRNA基因数目;显著性上、下调数目为经筛选标准(log2FC>0,P>0.01)筛选后的差异基因数目
肌层浸润与非肌层浸润膀胱癌组织的circRNA测序结果相比,有305个具显著性差异的circRNA,210个circRNA显著性上调,而95个circRNA在肌层浸润膀胱癌组织中显著下调。综合分析表明,失调的circRNA可能参与膀胱癌的发生和发展。为了解影响膀胱癌侵袭能力的关键circRNA,发现膀胱癌的新生物标志物,分析肌层浸润膀胱癌组织与非肌层浸润膀胱癌组织的测序数据,结合已有文献,挑选出3种候选circRNA,见表3。

表3 肌层浸润癌组织vs非肌层浸润癌组织差异候选circRNA
注:Log2FC:肌层浸润癌组织与非肌层浸润癌组织信号值差异倍数以2为底取对数;P值:差异显著性水平,P值越小表示基因差异越显著
候选circRNA中,ST6GALNAC6属于唾液酸转移酶家族,其通过修饰细胞表面的蛋白质和神经酰胺来改变细胞与细胞之间或细胞与胞外基质相互作用,与上皮细胞-间充质转化相关。这一生理过程是上皮细胞类恶性肿瘤细胞获得迁移和侵袭能力的关键;MYH11基因编码的蛋白质是平滑肌肌球蛋白,在癌症中与侵袭能力相关;PRUNE2基因编码的蛋白质在许多细胞过程中起作用,包括凋亡、细胞转化和突触功能。
三、qPCR验证circRNA表达水平差异
统计分析10例非肌层浸润癌组织样本和10例肌层浸润癌组织样本中3种候选circRNA的表达差异。结果显示,circST6GALNAC6与circMYH11在肌层浸润癌组织中的表达水平显著高于非肌层浸润癌组织(P<0.01);circPRUNE2表达差异无统计学意义(P>0.05),推测为样本数据间方差过大所致,见图2。
四、临床数据分析
统计各临床参数下的3种候选circRNA表达水平,记录样本数目,结果见表4。

图2 qPCR检测不同膀胱癌组织之间3种circRNA的表达差异(*P<0.05,**P<0.01,ns-差异无统计学意义)
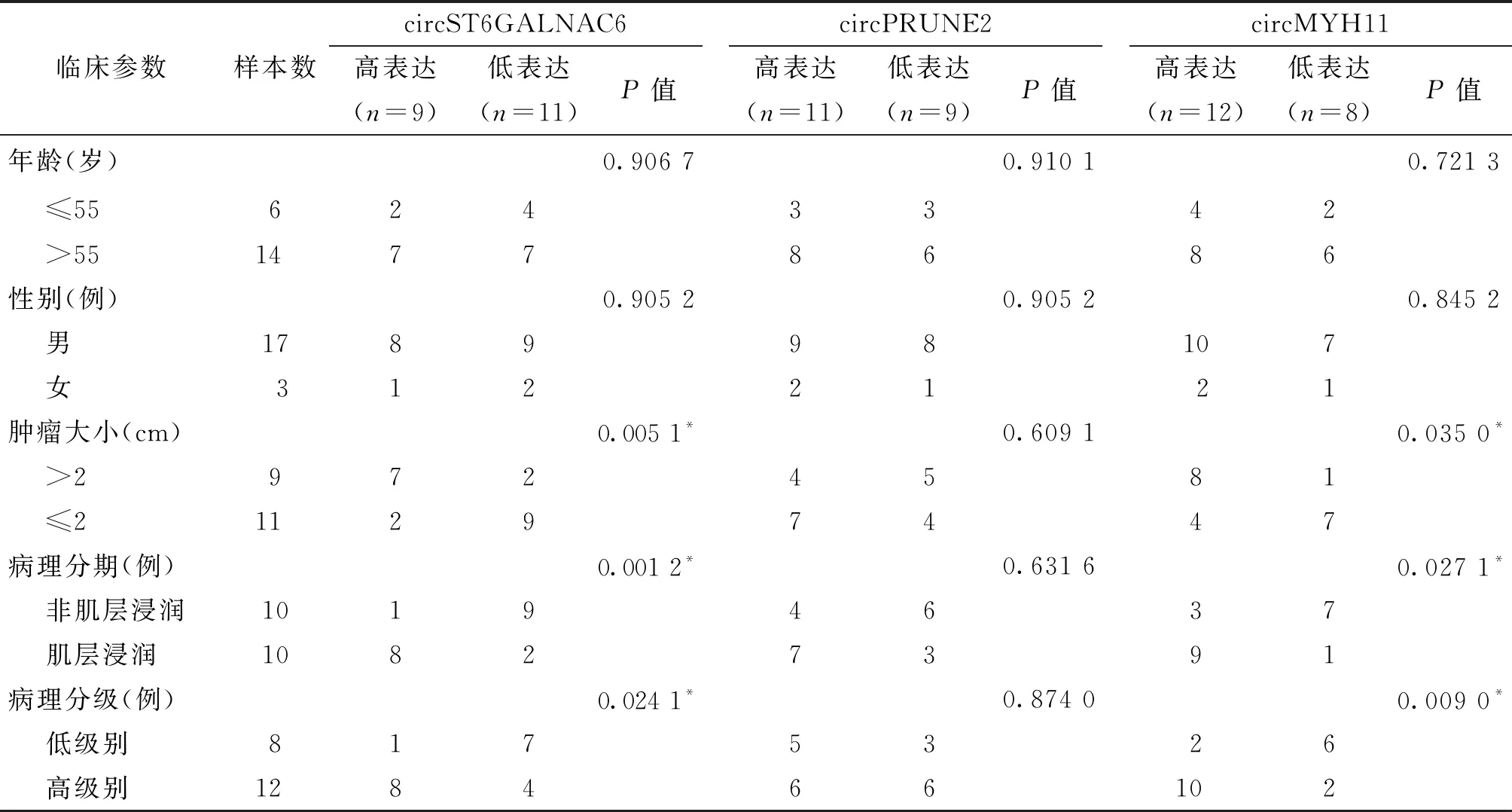
临床参数样本数circST6GALNAC6高表达(n=9)低表达(n=11)P值circPRUNE2高表达(n=11)低表达(n=9)P值circMYH11高表达(n=12)低表达(n=8)P值年龄(岁)0.906 70.910 10.721 3 ≤55 624 >55147733864286性别(例)0.905 20.905 20.845 2 男1789 女312982110721肿瘤大小(cm)0.005 1*0.609 10.035 0* >2972 ≤2 112945748147病理分期(例)0.001 2*0.631 60.027 1* 非肌层浸润1019 肌层浸润108246733791病理分级(例)0.024 1*0.874 00.009 0* 低级别817 高级别1284536626102
注:假设年龄>55岁、男性、肿瘤大小>2 cm、肌层浸润膀胱癌、高级别病理分级参数下circRNA表达水平更高,表中的*P<0.05表明各临床指标与表达水平相关性假设具有统计学意义,P>0.05表明临床指标与表达水平相关性假设不具有统计学意义
五、正常膀胱细胞与膀胱癌细胞之间circRNA表达的差异
与人膀胱上皮永生化细胞SV-HUC-1相比,4种膀胱癌细胞系的circST6GALNAC6与circMYH11表达水平显著下降(P<0.01)。4种膀胱癌细胞系中circST6GALNAC6的表达水平从高到低排列为J82≈T24>5637>SW780;circMYH11的表达水平从高到低排列为J82≈T24>5637≈SW780。膀胱癌细胞系J82的circPRUNE2表达水平与SV-HUC-1相比差异无统计学意义,其他3种膀胱癌细胞系中表达水平从高到低排列为SW780>5637>T24,见图3。
六、Transwell检测膀胱癌细胞间的侵袭能力差异
分析Transwell实验的结果,J82细胞的侵袭细胞数为(106.00±5.29)个,T24侵袭细胞数为(86.67±6.43)个,5637侵袭细胞数为(40.67±5.86)个,SW780侵袭细胞数为(38.00±5.29)个。4种肿瘤细胞的侵袭能力有一定差异,从高到低排列为J82>T24>5637≈SW780,见图4。
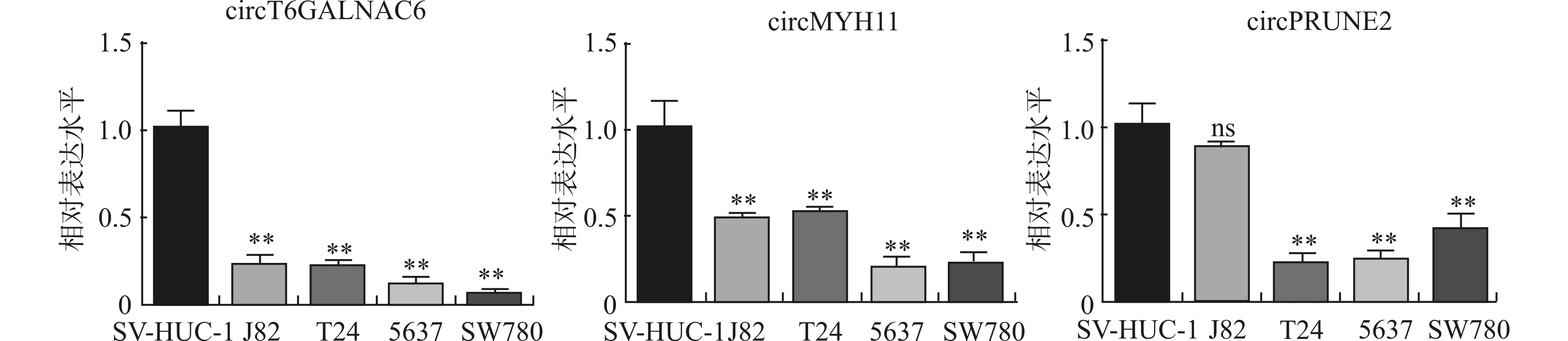
图3 qPCR检测不同细胞之间3种circRNA的表达差异(*P<0.05,**P<0.01,ns-差异无统计学意义)
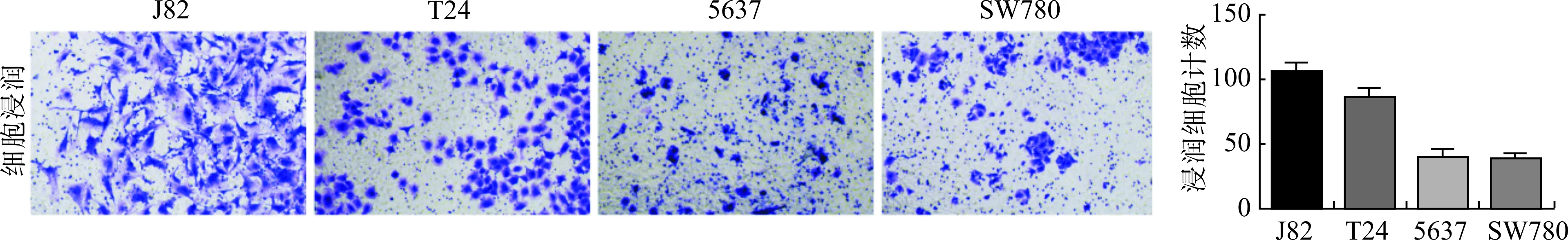
图4 Transwell检测4种膀胱癌细胞的侵袭能力差异
讨 论
为了验证关键circRNA参与调控膀胱癌侵袭能力的假设,系统地分析肌层浸润与非肌层浸润癌组织样本转录组测序中差异表达的circRNA,选出了3个候选circRNA(circST6GALNAC6、circPRUNE2、circMYH11)。通路分析表明这3个circRNA来源于与癌症分化或侵袭相关的基因,癌症的转化和转移受这些circRNA调节的可能性很大。
通过qPCR 检测20例膀胱癌组织样本中3个候选circRNA的相对表达水平,结果表明circST6GALNAC6、circMYH11在肌层浸润癌组织中的相对表达水平显著高于非肌层浸润癌组织(P<0.01);部分样本中circPRUNE2表达水平随膀胱癌侵袭性加强而上升,但差异无统计学意义(P>0.01)。对比分析20例膀胱癌的临床及病理数据发现,circST6GALNAC6与circMYH11的表达水平与性别、年龄无统计学相关性(P>0.01),与肿瘤大小、病理分期和分级具有统计学相关性(P<0.05),且与circRNA的表达水平呈正相关。circPRUNE2的表达水平与临床和病理数据无统计学相关性,推测其与膀胱癌的侵袭能力变化和病理变化不具相关性。
选取人膀胱上皮永生化细胞SV-HUC-1为参照,检测4种膀胱癌细胞系的circRNA表达水平。4种膀胱癌细胞系中circST6GALNAC6的表达水平从高到低排列为J82≈T24>5637>SW780;circMYH11的表达水平从高到低排列为J82≈T24>5637≈SW780;circPRUNE2的表达水平从高到低排列为SW780>5637>T24。针对这4种膀胱癌细胞系进行Transwell侵袭实验,检测4种肿瘤细胞的侵袭能力从高到低排列为J82>T24>5637≈SW780。由此发现膀胱癌细胞系中circST6GALNAC6与circMYH11的表达水平变化与细胞侵袭能力呈正相关,从细胞水平证明了这两种circRNA与膀胱癌细胞侵袭的能力存在相关性。
本研究初步确认circST6GALNAC6与circMYH11两种circRNA的上调与膀胱癌的侵袭可能有关。这一研究结果为进一步深入研究circRNA调控膀胱癌中侵袭过程的部分机制奠定了基础。
因在多种生物样本(如唾液和血液)中都能检测到circRNA,circRNA能作为癌症发展、治疗和预后的潜在诊断指标或预测性生物标志物。CircRNAs的组织特异性和疾病相关表达模式通常具有一定的关联性,这表明它们对疾病可能造成影响[14]。目前已有研究证明特定circRNA的水平在致癌增殖期间发生显著改变[14]。其作用机制主要是circRNA可作为microRNA的海绵,并提升对靶mRNA表达的抑制作用,引起细胞内的转录组学改变[15]。例如,circRNA-circHIPK3-microRNA-miR-558抑制乙酰肝素酶的表达,并负调节膀胱癌的进展[16]。因此,circRNA的失调会导致调节的信号传导途径变化,其涉及多种细胞过程,如细胞增殖的失调等致癌变化。
本研究中的两种circRNA可作为诊断和预后预测的候选指标,但其临床意义尚需通过系统的生物学研究来确定。在未来的研究中,我们将进一步评估和验证这些circRNA在较大临床样本群组中的表达模式,以确认其作为临床生物标志物的可行性。
