与马立克病病毒编码的miR-M31-3p互作的宿主靶基因筛选与鉴定
2019-08-19李会珍朱志坚刘豪丽张改平
张 雅,滕 蔓,李会珍,朱志坚,刘豪丽,3,罗 俊,3,张改平,4
(1.河南农业大学牧医工程学院,河南郑州450002;2.河南省农业科学院动物免疫学重点实验室/农业部动物免疫学重点实验室/河南省动物免疫学重点实验室,河南郑州450002;3.河南科技大学动物科技学院/动物疫病与公共安全重点实验室,河南洛阳471003;4.扬州大学江苏高校动物重要疫病与人兽共患防控协同创新中心,江苏扬州225009)
鸡马立克病(Marek's disease,MD)是由α-疱疹病毒成员马立克病病毒(MD virus,MDV)感染引起鸡的一种高度接触性、传染性淋巴细胞增生性疾病[1],该病给世界养禽业造成经济损失。虽然现有的疫苗对MD 肿瘤的发生起到了很好的免疫保护作用,但随着长期的疫苗免疫压力及病毒自身进化,已导致越来越多毒力增强的致病型病毒株的出现。另外,MDV 感染宿主可引起宿主免疫抑制及快速发作的T淋巴细胞肿瘤,其被认为是研究病毒诱发肿瘤的良好生物模型[2]。因此,深入研究和揭示MDV 的感染及致病机制具有重要的科学意义。
MicroRNA (miRNA)是一类重要的非编码小分子RNA,长度约22 nt~24 nt,其参与调控多种重要的生物过程,包括生长、发育、分化、凋亡、疾病及肿瘤发生等[3]。MDV 编码的病毒miRNA 在基因组中形成3 个基因簇,分别命名为Meq、Mid 和LAT miRNA 基因簇[4],已发现其中一些病毒miRNA 在MD 肿瘤发生过程中发挥重要调控作用[5-8]。前期研究Mid 基因簇中的miRNA 与MDV 致病表型关系时发现,缺失miR-M31-3p 前体miRNA 的病毒对感染鸡的致瘤率明显降低,预示miR-M31-3p 可能调控MD 的肿瘤发生[9]。为了揭示miR-M31-3p 的调控机制,本研究利用3'-Full Race 和杂交PCR 构建了miR-M31-3p 的宿主候选靶基因cDNA 文库,同时结合双荧光素酶报告实验、miRNA 过表达和qRT-PCR分析等方法筛选鉴定miR-M31-3p 的宿主靶基因,为后续揭示miR-M31-3p 调控MD 肿瘤发生的分子机制奠定基础。
1 材料与方法
1.1 病毒、细胞和质粒 MDV GX0101 株由山东农业大学崔治中教授惠赠。MDV miR-M31-3p 基因缺失株GXΔmiR-M31 以及HEK293T 细胞、pcDNA6.2-miR-neg、pcDNA6.2-miR-M31、pcDNA6.2-mut-miRM31 和psiCHECKTM-2 载体均由河南省农科院动物免疫室制备并保存。原代鸡胚成纤维细胞(CEF)由7 日龄~8 日龄SPF 鸡胚制备,用于miRNA 过表达和病毒感染试验。
1.2 主要试剂 pMD19-T (simple)载体、Premix ExTaqTMDNA 聚合酶、限制性内切酶NotⅠ、XhoⅠ、PrimeScriptTMRT reagent Kit with gDNA Eraser、Premix ExTaqTM、DNA Ligation Kit、3'-Full RACE Core Set、Prime ScriptTMRT Master Mix (Perfect Real Time)、E.coliJM109 感受态细胞均购自TaKaRa 公司;DNA提取、胶回收试剂盒购自OMEGA 公司;TRIzolReagent 购自ThermoFisher 公司;Annealing Buffer for DNA Oligos (5×)购自碧云天生物技术有限公司;FastStart Universal SYBR Green Master (ROX)、X-tremeGENE HP DNA Transfection Reagent 购自Roche 公司;双荧光素酶报告系统(DLRA)购自Promega 公司。Lipofectamine 2000 购自Invitrogen 公司;胰蛋白酶-EDTA 消化液(0.25 %)、DMEM、DEPC 水均购自Solarbio 公司。
1.3 引物设计与合成 采用Primer Premier 5.0 软件,根据前期预测的宿主各候选靶基因序列(未发表文章),设计3'-UTR 的引物对(1~6)、寡核苷酸互补引物对(7~12),以及用于qRT-PCR 的引物对(13~19),引物由上海生工生物工程技术服务股份有限公司合成(表1)。
1.4 宿主候选靶基因cDNA 文库的构建 依照TRIzol 试剂说明书提取CEF 细胞总RNA,按照3'-Full RACE Core Set 试剂说明书反转录获得cDNA,以其为模板,按照试剂盒说明书进行两轮PCR 反应。首先以miR-M31-3p 特异性反向互补引物(5'-RGCRACAGRCGRGAGCAGARCAA-3',“R”为“G”或“A”)为上游引物、试剂盒中所带3'-RACE Outer Primer (5'-TACCGTCGTTCCACTAGTAGTGAT TT-3')为下游引物,进行第一轮PCR 扩增。然后用上述miR-M31-3p 特异性反向互补引物为上游引物、试剂盒中所带3'-RACE Inner Primer (5'-CGCGGATC CTCCACTAGTGATTTCACTATAGG-3')为下游引物;以第一轮PCR 产物为模板进行第二轮PCR 扩增。最终的PCR 产物经1 %琼脂糖凝胶电泳分析后割胶回收并纯化100 bp~1 000 bp 的PCR 产物,分别连接至pMD19-T 载体后转化JM109 感受态细胞,挑取阳性单克隆摇菌,分别利用miR-M31-3p 特异性反向互补引物和3'-Full RACE Inner 引物进行菌液PCR 鉴定,阳性菌液由生工生物工程(上海)股份有限公司测序。测序结果利用BLAST 软件进行对比分析,最终确定候选靶基因的序列和名称。

表1 引物序列及产物大小Table 1 Primer sequence and fragment length
1.5 双荧光素酶报告质粒的构建及鉴定 以1.4 中cDNA 作为模板,以表1 中所示的相应基因引物对(1~6)扩增鸡的候选基因磷酸二羟基丙酮酰基转移酶(Glyceronephosphate O-acyltransferase, GNPAT)、转录因子12 (Transcription factor 12,TCF12)、胞质非特异性肌肽酶2 (Carnosine dipeptidase 2,CNDP2)、微粒体谷胱甘肽S-转移酶1 (Microsomal glutathioneS-transferase 1,MGST1)、凋亡相关基因CD99 分子样蛋白 2 (CD99 molecule-like 2, CD99L2)以及FIGNL1 3'-UTR 等基因片段。PCR 产物胶回收后分别克隆至pMD19-T 载体,并转化至JM109 感受态细胞,挑取单克隆摇菌提取重组质粒进行测序鉴定,然后阳性质粒经XhoⅠ/NotⅠ酶切后纯化回收目的片段,二次克隆至psiCHECKTM-2 载体构建野生型候选双荧光素酶报告质粒, 分别命名为psiCHECK-GNPAT-3'-UTR、psiCHECK-TCF12-3'-UTR、psiCHECK-CNDP2-3'-UTR、psiCHECK-MGST1-3'-UTR、 psiCHECK-FIGNL1-3'-UTR 和 psiCHECKCD99L2-3'-UTR。上述质粒经PCR 扩增和XhoⅠ/NotⅠ双酶切鉴定,符合预期的阳性菌由上海生工生物工程股份有限公司测序。将表1 所示的寡核苷酸引物对(7~12)分别用ddH2O 溶解至终浓度为50 μmol/μL,进行退火反应。反应体系为:DEPC 水40 μL,退火缓冲液(5×)20 μL,正向和反向引物各20 μL;反应程序设为95 ℃变性2 min,后每隔1 min 下降1 ℃,直至降至25 ℃为止,形成寡核苷酸互补链,然后XhoⅠ/NotⅠ酶切后定向插入psiCHECKTM-2 载体,构建上述6 个候选靶基因3'-UTR 突变体的双荧光素酶报告质粒,分别命名为psiCHECK-mut-GNPAT-3'-UTR、 psiCHECK-mut-TCF12-3'-UTR、 psiCHECK-mut-CNDP2-3'-UTR、psiCHECK-mut-MGST1-3'-UTR、psiCHECK-mut-CD99L2-3'-UTR 和 psiCHECK-mut-FIGNL1-3'-UTR,同上述方法鉴定后由上海生工生物工程技术服务有限公司测序。
1.6 双荧光素酶报告实验(Dual luciferase reporter assay,DLRA)将293T 细胞铺至48 孔板,待细胞汇合度约80 %时,将1.5 中构建的包含野生型和突变型双荧光素酶报告质粒分别与pcDNA6.2-miR-neg、pcDNA6.2-miR-M31 和pcDNA6.2-mut-miR-M31以每种质粒各300 ng 两两组合后,利用Lipofectamine 2000 共转染293T 细胞,利用DLRA 进行检测。每个转染分别做3 个重复,计算海肾荧光素酶/萤火虫荧光素酶活性的比值,进行统计分析。
1.7 qRT-PCR 分析候选靶基因的转录水平 常规方法制备CEF 细胞单层,按照X-tremeGENE HP DNA Transfection Reagent 使用说明书分别将pcDNA6.2-miR-neg、pcDNA6.2-miR-M31 和pcDNA6.2-mut-miR-M31 转染CEF 细胞,进行miRNA 过表达,分别于转染后24 h、48 h 收集细胞备用。另外采用MDV GX0101 株和GXΔmiR-M31 株分别感染CEF单层细胞,以未感染CEF 细胞作为阴性对照,于病毒感染后72 h、96 h 和120 h 分别收集细胞备用。分别提取上述CEF 细胞样品总RNA,反转录为cDNA后用表1 所示的引物对(13 ~19)进行qRT-PCR 反应,反应程序为:95 ℃5 min、95 ℃15 s、60 ℃30 s,共40 个循环。以β-actin 为内参基因,用2-ΔΔCt法统计分析相关数据,比较分析检测上述6 个候选靶基因在miR-M31-3p 过表达和MDV 感染CEF 细胞中的相对转录水平。
2 结 果
2.1 宿主候选靶基因的cDNA 文库构建及筛选结果利用杂交PCR 构建与miR-M31-3p 互作的宿主候选靶基因cDNA 文库,对共计946 个文库菌落进行PCR 鉴定。随机挑选360 个阳性克隆菌落测序(占PCR 菌落筛选总样38 %),并进行序列比对分析,结果显示其中有159 个克隆可在以NCBI 中找到对应基因序列,排除重复序列后共获得77 种宿主基因,其中49 个与miR-M31-3p 互作的宿主基因的靶点位于3'-UTR 中,经分析确定6 个候选靶基因,分别为鸡GNPAT、TCF12、FIGNL1、CNDP2、MGST1和CD99L2 靶基因(表2)。
2.2 双荧光素酶报告质粒的构建及鉴定结果 以CEF 细胞cDNA 为模板,用PCR 分别扩增候选靶基因CNDP2、FIGNL1、GNPAT、CD99L2、MGST1 和TCF12 的3'-UTR 基因片段,结果显示PCR 产物大小均与预期相符(图1A)。将这些基因片段回收纯化后定向插入到psiCHECKTM-2 载体,酶切鉴定(图1B)以及测序分析结果与预期一致。表明正确构建了上述候选靶基因的野生型3'-UTR 双荧光素酶报告质粒。同上,将人工合成的6 对突变型3'-UTR 引物退火形成双链,定向插入到psiCHECKTM-2 载体,双酶切测序结果表明构建6 个候选靶基因的突变型3'-UTR 双荧光素酶报告质粒(图略)。
2.3 DLRA 分析miR-M31-3p 与候选靶基因的相互作用结果 将各突变型和野生型3'-UTR 双荧光素酶报告质粒分别与pcDNA-miR-M31、pcDNA-miR-neg或pcDNA-mut-miR-M31 两两组合后转染293T 细胞,并在转染后36 h 利用DLRA 检测,计算海肾荧光素酶活性值/萤火虫荧光素酶活性值的比值,结果显示,CNDP2,FIGNL1,GNPAT,CD99L2,MGST1,TCF12 基因各实验组比值分别为:0.29,0.78,0.81,0.61,0.48,0.62,而各组内对照组比值接近于1 (0.97 ~0.98)。经统计学分析显示CNDP2、FIGNL1、CD99L2、TCF12 和MGST1 被极显著抑制(p<0.01),GNPAT 被显著抑制(p<0.05)(图2)。表明miR-M31-3p 在体外可靶向结合上述6 个基因的3'-UTR,并且这种结合具有序列特异性。
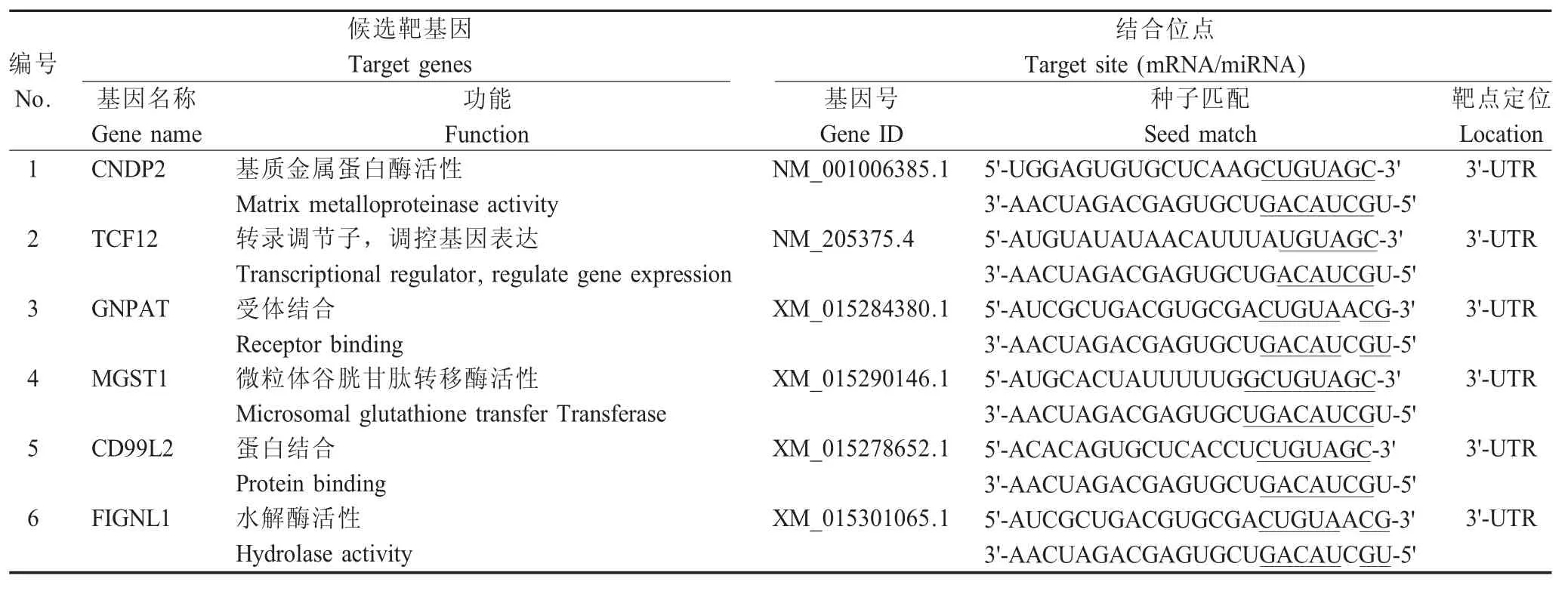
表2 miR-M31-3p 候选靶基因相关信息以及作用靶点分析Table 2 Information of target candidates and their corresponding binding sites of miR-M31-3p

图1 候选靶基因3'-UTR 的PCR 扩增(A)及其重组质粒(B)的双酶切鉴定Fig.1 Amplification of target gene 3'-UTRs (A)and identification of the recombinant plasmid (B)by double enzyme digestion

图2 DLRA 分析miR-M31-3p 与宿主候选靶基因的3'-UTR 在体外的相互作用Fig.2 Analysis of the in vitro interaction between the miR-M31-3p and the 3'-UTRs of host target genes utilizing DLRA
2.4 qRT-PCR 检测宿主靶基因在体内的转录水平CEF 在分别转染pcDNA-miR-M31 和pcDNA-mut-miR-M31 后24 h、48 h 收集样品,利用qRT-PCR检测靶基因mRNA 转录水平,结果显示,转染后48 h 时各组内对照组mRNA 水平相对数值均接近1(0.97~0.99),而pcDNA-miR-M31 转染细胞中CNDP2、FIGNL1、 GNPAT、 CD99L2、 MGST1、 TCF12 的mRNA 转录水平相对数值分别为0.71,0.75,0.75,0.72,0.71,0.77,经统计学分析结果显示CNDP2、GNPAT 被显著抑制(p<0.05),FIGNL1、CD99L2、TCF12 和MGST1 被极显著抑制(p<0.01),但pcDNA-mut-miR-M31 转染细胞中上述基因的mRNA 转录水平则显著恢复(图3)。表明宿主各靶基因的mRNA转录水平均显著下调。

图3 qRT-PCR 分析过表达miR-M31-3p 的CEFs 中候选宿主靶基因的mRNA 的相对转录水平Fig.3 Relative transcriptional levels of candidate host target genes mRNA in miR-M31-3p overexpressed CEFs determined by RT-qPCR
在病毒感染实验中,在感染MDV GX0101 株和GXΔmiR-M31 株72 h、96 h、120 h 时利用qRT-PCR分别检测各组mRNA 转录水平相对数值,具体结果见图4,其中感染120 h 后各组内对照组mRNA 转录水平相对数值接近于1 (0.98~0.99),而CNDP2、FIGNL1、GNPAT、CD99L2、MGST1、TCF12 基因在MDV 感染时mRNA 转录水平相对数值分别为0.27、0.60、0.21、0.93、0.72、0.63。经统计学分析结果显示,与CEF 阴性对照相比,除CD99L2 基因之外,在感染MDV GX0101 株的细胞中CNDP2、GNPAT、TCF12、MGST1、FIGNL1 基因的mRNA转录水平在120 h 时均显著下调(p<0.01),而感染GXΔmiR-M31 的细胞中上述基因的mRNA 转录水平则显著恢复(图4)。表明miR-M31-3p 在体内可靶向调控并显著抑制宿主CNDP2、GNPAT、TCF12、MGST1 和FIGNL1 各基因的转录水平。CD99L2 基因在DLRA、过表达miRNA 的CEF 细胞中其转录水平均可以被miR-M31-3p 抑制表达,但在病毒感染的CEF 细胞中,其mRNA 转录水平并无显著变化,这可能因为病毒感染后在多种细胞因子综合作用下使宿主细胞内CD99L2 基因不表现下调。
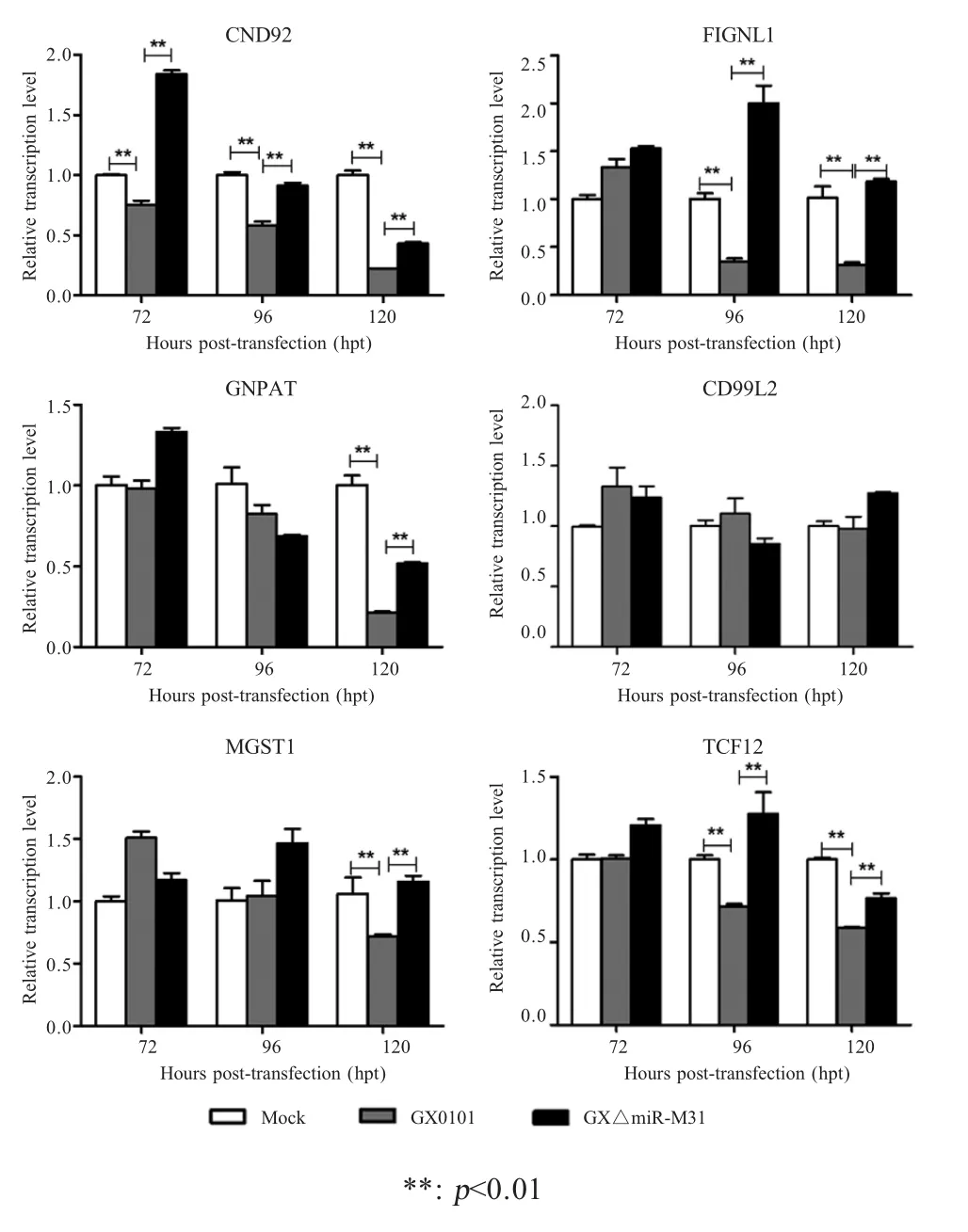
图4 qRT-PCR 分析GX0101 和GXΔmiR-M31 感染的CEF 细胞中靶基因mRNA 的相对表达水平Fig.4 Relative transcriptional levels of host target genes in GX0101 or GXΔmiR-M31 infected CEFs determined by qRT-PCR
3 讨 论
最新研究发现,MDV 编码的miRNA 参与MD肿瘤发生,如敲除miR-M4-5p 的MDV 致病和致瘤能力显著减弱[10],miR-M4-5p 还可通过下调LTBP1(Latent TGF-β binding protein 1)的表达来抑制TGF-β信号通路的传递,进而激活宿主原癌基因c-Myc 的表达,最终促进MD 肿瘤的发生[5]。miR-M31-3p 与宿主miR-221 具有相同的种子序列,后者靶向调控p27Kip1 蛋白的表达。p27Kip1 是细胞周期的关键调节因子,该蛋白的下调促进癌细胞的生长和增殖[11]。本实验室前期研究发现缺失miR-M31 可以降低MDV 感染鸡的死亡率和肿瘤发生率[9],但其具体调控机制尚不清楚。本研究利用杂交PCR 法构建与miR-M31-3p 互作的宿主靶基因cDNA 文库,共筛选到49 个miRNA 结合靶点位于宿主靶基因3'-UTR,进一步测序分析筛选发现,miR-M31-3p 与CNDP2、GNPAT、CD99L2、MGST1、TCF12 以及FIGNL1 基因的3'-UTR 均存在相互作用,后续过表达试验证实miR-M31-3p 可以抑制全部6 个基因的表达。同时在MDV 感染实验中,除CD99L2 基因之外,CNDP2、GNPAT、MGST1、TCF12 和FIGNL1 基因的转录水平均可被miR-M31-3p 极显著抑制。这些结果证实CNDP2、GNPAT、MGST1、TCF12 和FIGNL1 为与miR-M31-3p 互作的宿主靶基因。
在这些宿主靶基因中,MGST1 是一种膜结合的谷胱甘肽转移酶,与机体解毒过程有关,是抵抗机体因有害作用产生的活性氧簇(Reactive oxygen species,ROS)所必须的。细胞内高水平的活性氧(ROS)被认为是导致癌细胞凋亡的主要原因之一[12-13],因此MGST1 常被作为细胞应对活性中间体的一部分从而保护细胞免受死亡[14]。miR-M31-3p 靶向作用MGST1,预示其具有抑制肿瘤发展的潜能。CNDP2的异常表达可以显著抑制细胞增殖、诱导细胞凋亡和细胞周期阻滞[15]。另外CNDP2 的敲除可以抑制表皮生长因子受体、细胞周期蛋白B1 和E 的表达,表皮生长因子受体通常促进细胞的生长发育,一旦发生基因异常表达,细胞可能不受控制地生长[16]。miR-M31-3p 对CNDP2 的负调控可能也会使细胞不受限制的增长。CD99L2 是一种表达于白细胞、内皮细胞以及其它类型细胞的I 型糖蛋白[17],与炎症条件下嗜中性粒细胞、单核细胞和T 淋巴细胞的外渗有关[18]。CD99L2 是白细胞外渗所必需的[19],白细胞从血液渗出到炎症部位是先天性免疫的关键步骤,miR-M31-3p 作用于CD99L2 可能对白细胞的渗出有影响,使宿主免疫失调。FIGNL1 编码的蛋白是一种中心体蛋白,能够抑制细胞纤毛形成[20],而且还参与细胞核中DNA 的修复[21],其可能与细胞癌变有关。TCF12 是一种转录因子,所编码的蛋白是bHLH 蛋白家族的一个成员,能够促进肿瘤细胞的迁移和入侵[22]。miR-M31-3p 对这些宿主靶基因的调控,进一步验证了本实验室前期报道的其与MD肿瘤发生的密切关系,也为后续揭示miR-M31-3p调控MDV 感染及致癌的机制奠定了重要基础。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
