一株H9N2亚型猪流感病毒的遗传进化和致病性分析
2019-08-19孙王杨吉刘子拓范佳文石火英
孙王杨吉,刘 源,刘子拓,范佳文,石火英
(扬州大学兽医学院/农业部畜禽传染病学重点开放实验室/江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
猪流感病毒(Swine influenza virus,SIV)属于正黏病毒科,A 型流感病毒属,能够引起猪的呼吸道疾病。其在感染宿主时需要先结合宿主细胞表面的唾液酸受体,不同的流感病毒具有不同的受体结合倾向。人流感病毒倾向于与宿主细胞表面的α-2,6-唾液酸结合,而禽流感病毒(Avian influenza virus,AIV)优先与α-2,3-唾液酸结合[1]。猪呼吸道细胞表面同时具有α-2,6-唾液酸和α-2,3-唾液酸[2],所以AIV 或人流感病毒均可以直接感染猪[3]。若AIV 和人类流感病毒同时感染猪,则可能在猪体内发生重组,从而产生新型的流感病毒。因此猪成为禽源、猪源、人源等不同流感病毒基因重组或重配的“混合器”和流感病毒新流行株产生的“孵育器”[4]。有研究表明H9N2 亚型流感病毒可以为其它型流感病毒提供部分或整个内部基因,产生新的感染人类的重配体,如H5N1、H7N9、H10N8 和H5N6 病毒等[5]。因此,有必要对SIV 的流行实时监测,分析其遗传进化规律,监测并评估SIV 对人类公共卫生安全的潜在威胁。
本研究从有流感病毒症状的病猪鼻拭子中分离出一株H9N2 亚型SIV,对分离病毒进行了全基因组测序和分析;同时探究其对SPF 鸡和豚鼠的致病性,为H9N2 亚型SIV 的遗传进化趋势和流行病学特性研究提供参考依据。
1 材料与方法
1.1 实验动物和主要试剂 SPF 鸡胚购自北京梅里埃公司;SPF 鸡由扬州大学实验动物比较医学中心提供;Hartley 品系,体质量约300 g 的雌性健康豚鼠购自北京维通利华实验动物技术有限公司。TRI-zol 试剂购自Invitrogen 公司;反转录试剂(Prime-Script Reverse Transcriptase)、RNA 酶抑制剂(Rnase Inhibitor)和高保真酶(PrimeSTAR HS DNA Polymerase)购自宝生物工程(大连)有限公司;H9 亚型、H5 亚型流感病毒阳性血清和新城疫阳性血清为本实验室制备。
1.2 病料样品的采集及病毒分离 于2015 年在江苏省某动物医院就医的疑似流感症状的病猪中采集鼻拭子,样品经双抗处理后用于病毒分离;将处理的拭子样品上清液取0.2 mL 经尿囊腔接种SPF 鸡胚, 收取24 h 后死亡的鸡胚尿囊液,120 h 未死亡的鸡胚,4 ℃过夜,收集其尿囊液并参照OIE 标准方法检测其HA 效价,同时使用H9 亚型、H5 亚型流感病毒阳性血清和新城疫阳性血清进行HI 试验[6]。
1.3 分离病毒的RT-PCR 扩增 参照文献[7],根据GenBank 中的相关基因序列,采用Prime Premier 5.0 软件设计针对H9N2 亚型AIV 8 个基因节段的特异性通用引物,共12 对,其中PB2、PB1 基因分段扩增。引物由上海生工生物工程技术服务有限公司合成。
采用TRIzol 法提取1.2 分离病毒的总RNA,以其为模板反转录为cDNA。以cDNA 为模板,利用特异性通用引物与高保真酶(PrimeSTAR HS DNA Polymerase)扩增目的片段。PCR 反应程序:95 ℃5 min;94 ℃10 s、54 ℃15 s、72 ℃20 s,35 个循环。PCR 产物经1 %琼脂糖凝胶电泳检测,回收纯化后由上海生工生物工程技术服务有限公司测序。
1.4 分离病毒的遗传进化与分子特征分析 将扩增得到的8 个基因节段(MH885509-MH885516)采用Lasergene 7.1 软件中的Editseq、MegAlign 模块进行序列拼接成全基因组序列。利用Clustal 1.83 软件,将分离病毒各基因节段序列与NCBI 数据库中2015年之前的部分禽源、人源、猪源的H9N2 亚型流感病毒相应基因序列进行同源性比对,同时通过MEGA6 软件对分离病毒全基因进行同源性比对分析、构建基因的进化树(文中仅保留HA 基因进化树),并对病毒基因推导氨基酸序列进行流感病毒分子特征分析。
1.5 分离病毒鸡胚半数感染量(EID50)的测定 将1.2 得到的鸡胚尿囊液10 倍倍比稀释(10-4~10-11),按每个稀释度经尿囊腔途径接种5 枚10 日龄SPF鸡胚,0.2 mL/枚,37 ℃孵育120 h 后检测各稀释度血凝效价呈阳性的鸡胚数目,按Reed-Muench 公式计算出病毒的EID50。
1.6 分离病毒对鸡的致病性试验 将8 只3 周龄SPF 鸡分为感染组和对照组,每组4 只。将分离的病毒分别经滴鼻、点眼、气管接种途径进行感染,感染剂量分别为50 μL、50 μL、100 μL,病毒量为106EID50/0.2 mL,每只鸡的感染剂量为2×106EID50。对照组SPF 鸡接种等量的PBS。接种后每天观察鸡的临床症状;感染后第3 d 和第5 d 每组各取3 只鸡,分别无菌采集其气管和肺脏,进行病毒滴度测定。以上试验重复2 次,将3 次的试验结果合并分析。
1.7 分离病毒对豚鼠的致病性试验 将18 只雌性健康豚鼠分为感染组、直接接触组和对照组,每组6 只。将豚鼠经0.1 mL/只速眠新麻醉,将分离病毒经滴鼻途径感染,每个鼻孔感染剂量为100 μL,病毒量为106EID50/0.2 mL,对照组豚鼠接种等量的PBS。直接接触组6 只豚鼠与感染组同笼饲养。接种后每天观察豚鼠的临床症状、采食和饮水情况,定期称重并记录采食量;感染后第3 d 和第5 d 每组各取3 只豚鼠,分别无菌采集其鼻甲骨、气管、肺、脾脏、肝脏和肾脏进行病毒滴度测定。以上试验重复1 次,将2 次的试验结果合并分析。
2 结 果
2.1 病毒的分离鉴定结果 根据接种病料样品的鸡胚尿囊液HA 和HI 试验结果,初步表明从病猪鼻拭子中分离得到一株H9 亚型SIV。提取分离病毒的RNA,反转录后以其为模板对其8 个基因节段进行RT-PCR 扩增,结果显示扩增的各基因节段大小均与预期目的片段相符。经对分离病毒的HA 和NA基因序列比对,表明分离病毒为H9N2 亚型SIV,命名为A/swine/Jiangsu/1/2015 (H9N2),以下称为SW/JS/1/15,病毒滴度为109.25EID50/0.2 mL。
2.2 分离病毒的核苷酸同源性和遗传进化分析 通过NCBI 中的BLAST 程序对SW/JS/1/15 的全基因序列进行比较,得到与分离病毒各基因节段核苷酸同源性最高的病毒株。下载各参考株序列,使用Megalign 软件分别与分离病毒各基因节段进行核苷酸同源性比对,结果显示分离病毒的各基因节段序列与各参考株的同源性均在98.5 %以上(表1)。结果表明分离病毒可能具有为H7N9 等流感病毒提供内部基因的潜力。
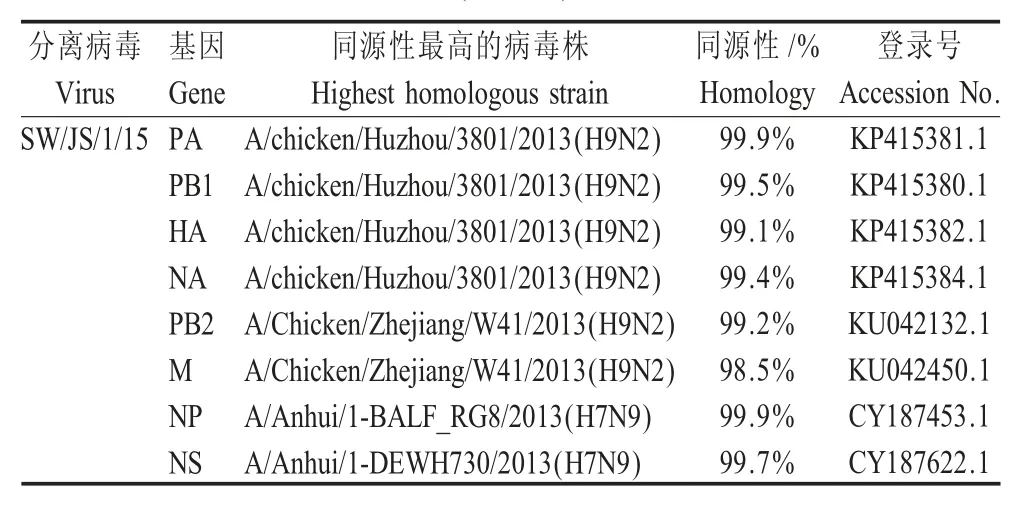
表1 与分离病毒SW/JS/1/15 (H9N2)的各基因节段最高同源性的病毒株Table 1 Pertentage homolegy of influenza virus closely related to SW/JS/1/15 (H9N2)swine influenza virus
利用MEGA6 软件对分离病毒及参考株的各基因节段进行遗传进化分析。结果显示,分离病毒SW/JS/1/15 的HA 基因与A/chicken/Shandong/JN/1999属于同一分支,属于BJ/94 系(图1);NA 基因与A/Chicken/Shandong/sd01/2010 属于同一分支,属于BJ/94 系;PB2 基因与A/duck/Shantou/7488/2004 属于同一分支,而DK1 系以A/duck/Shantou/7488/2004 为代表株,所以分离病毒属于DK1 系;PB1、PA 和NP 基因属于F/98 系;M 基因与A/Quail/Hong Kong/G1/97 属于同一分支,属于G1/97 系;NS 基因与A/Chicken/Shanghai/F/98 属于同一分支,属于BJ/94 系。而目前广泛流行的G57 基因型H9N2 流感病毒正是由BJ/94 系的HA、NA 和NS 基因,DK1系的PB2 基因,F/98 系的PB1、PA 和NP 基因以及G1/97 系的M 基因组成的。分离病毒8 个基因节段组成与G57 基因型均相同(图2),因此分离病毒属于G57 基因型。

图1 分离病毒SW/JS/1/15 (H9N2)HA 基因进化树Fig.1 The phylogenetic tree based on the HA gene of SW/JS/1/15(H9N2)
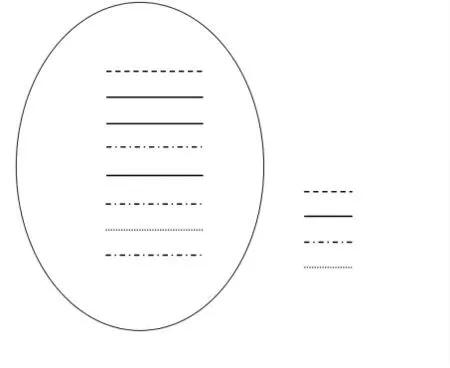
图2 分离病毒SW/JS/1/15 (H9N2)8 基因重配示意图Fig.2 Genome reassortment of SW/JS/1/15(H9N2)
2.3 分离病毒HA、NA 关键位点分析 将分离病毒 HA 关键位点与疫苗株 SH/F/98、 SD/6/96、GD/SS/94 相关关键位点比较结果显示,分离病毒HA 的裂解位点为PSRSSR↓GLF,符合低致病性流感病毒的特征。HA 右侧臂(aa232 ~aa237)出现变化,由3 株疫苗株的QQG 突变为LMG;在受体结合位点中,仅198 位点发生了A198T 突变,其余受体结合位点保守性较强(表2)。表明198 位点可能在H9N2 流感病毒进化过程中起到重要作用。本研究以已公开报道的H9N2 流感病毒的部分抗原位点为范围,分析分离病毒HA 抗原位点的特点,结果显示,相对于疫苗株SH/F/98、SD/6/96、GD/SS/94,分离病毒共有10 个抗原位点发生了突变,分别是G90E、 S127R、 S145N、 D153G、 N167S、 A168N、 A198T、T200R、N201D、Q235M (H9 numbering)。上述结果表明分离病毒的HA 抗原表位可能发生了变异。
以疫苗株SH/F/98、SD/6/96、GD/SS/94 为参照,对NA 关键位点的分析结果显示,分离病毒共有6个关键位点发生变化。其中有4 个突变发生在红细胞吸附位点,分别是K367R、K/E368N、D369N、D401E。其余两个突变K143N 和T434P 分别发生在活性中心和抗原决定簇中。同时分离病毒NA 蛋白颈部杆状结构在aa63~aa65 位置缺失,该部位的3 个氨基酸的缺失被认为是中国大陆H9N2 流感病毒分离株的一个标记[8]。上述结果表明,相比最初的疫苗株,分离病毒的NA 蛋白已经发生了演化,具有了新的分子特征,NA 抗原表位和功能活性可能发生了改变。
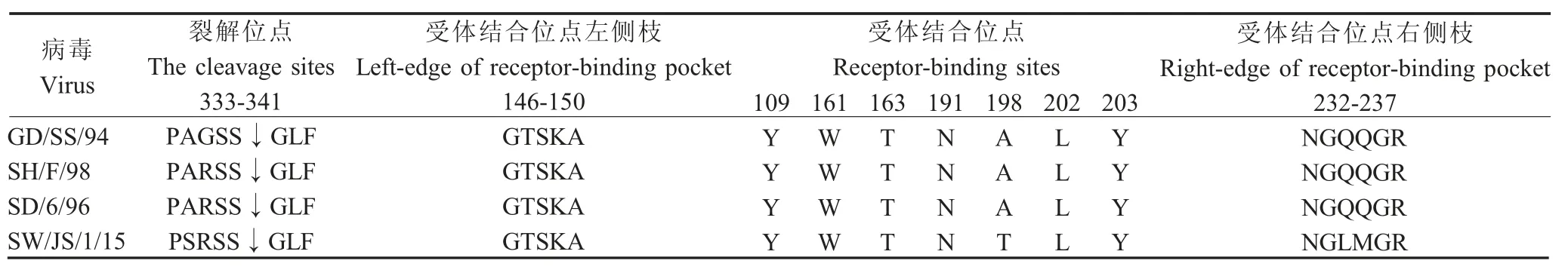
表2 分离病毒及疫苗株中HA 受体结合部位和裂解位点处的氨基酸序列Table 2 Amino acid sequences at the receptor binding site and cleavage site of the isolates and vaccine strains
2.4 分离病毒潜在糖基化位点分析 分离病毒与人源H9N2 参考株一样,均有9 个潜在糖基化位点,其中因发生S145N 突变而在HA 的145 位新增1 个潜在糖基化位点NGT,因发生T220V 突变导致218 位潜在糖基化位点缺失,因发生P315S 突变而在313 位新增1 个潜在糖基化位点NCS。本实验室经反向遗传突变研究发现,缺失218 位糖基化位点,同时增加313 位糖基化位点的病毒的抗原性未发生变化,但毒力呈微弱的增加[9]。
2.5 分离病毒对鸡的致病性试验结果 分离病毒分别经滴鼻、点眼、气管途径人工感染SPF 鸡2 d 后出现精神不振,食欲减退等临床症状;对照组SPF鸡未出现明显症状。感染组在感染后第3 d 检测结果显示气管和肺组织分离病毒的EID50分别为104.5EID50/0.2 mL 与102.88EID50/0.2 mL;感染后第5 d 采集的气管和肺组织分离病毒的EID50分别为102.75EID50/0.2 mL 与101.75EID500/0.2 mL。对照组鸡气管和肺组织中未分离到病毒(图3)。结果表明,分离病毒SW/JS/1/15 能够直接感染鸡并引起明显的临床症状。
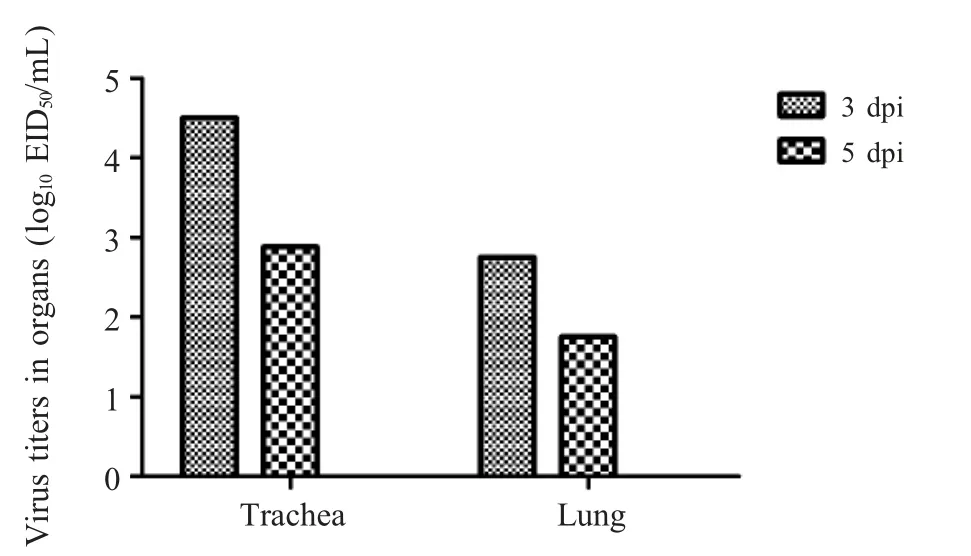
图3 分离病毒感染3 d 和5 d 后SPF 鸡脏器病毒的滴定结果Fig.3 Virus titers in organs of SPF chicken at 3 days and 5 days post infection
2.6 分离病毒对豚鼠的致病性试验结果 分离病毒经滴鼻人工感染豚鼠后2 d 后出现聚堆,精神不振等临床症状。感染后第5 d 在豚鼠鼻甲骨组织中分离出病毒,肺、气管等其余组织中未分离到病毒。测得其EID50为101.25EID50/0.2 mL;而在感染后第3 d的豚鼠所有组织中均未分离出病毒。直接接触组与对照组豚鼠并未出现异常表现,其组织中也未分离出病毒。结果表明分离病毒SW/JS/1/15 能够感染豚鼠,但不能在豚鼠中水平传播。
3 讨 论
H9N2 亚型SIV 属于低致病性流感病毒,主要表现为高致病率与低死亡率,对畜牧业影响较大。本研究分离的SIV 核苷酸同源性分析结果显示,分离病毒的8 个基因节段与两株禽源H9N2 亚型流感病毒A/chicken/Huzhou/3801/2013 (H9N2)和A/Chicken/Zhejiang/W41/2013 (H9N2)的8 个基因节段均高度同源,推测该分离病毒是一株AIV 直接感染猪的病例;分离病毒PB1、PB2、PA、M、NP 与NS 等6个内部基因节段与两株人源H7N9 亚型流感病毒A/Anhui/1-BALF_RG8/2013 (H7N9)和 A/Anhui/1-DEWH730/2013(H7N9)的6 个内部基因高度同源。本研究分离到的SIV 可能是上述禽源H9N2 亚型AIV 和人源H7N9 亚型流感病毒的纽带,也表明猪不仅是流感病毒基因重组的天然混合器,还在AIV 从禽类宿主到哺乳动物宿主的跨种传播中发挥重要作用。遗传进化分析表明,本研究分离病毒8 个基因节段均属于G57 基因型。自2007 年以来,G57 病毒已经传播到家养水禽、野生鸟类和猪中。2013 年出现的H7N9 病毒内部基因与H9N2 亚型G57 基因型病毒的主要内部基因最为相似[10]。在2010 年后,在禽、猪或人中分离的H7N9 以外亚型的新型重配体(例如H5N2、H7N7 和H10N8 病毒)也同样具有G57 基因型内部基因[11]。因此,推测分离病毒具有为多种流感病毒提供内部基因的潜力。
分离病毒HA 基因的裂解位点为PSRSSR*GL,符合低致病性流感的特征。有研究表明H9N2 病毒已经获得了感染人类的受体结合特征,能够增加病毒在人类和猪呼吸道中重配的可能性[12]。Q234L 突变发生在分离病毒HA 受体结合位点的右侧,该突变能够将受体改变为结合哺乳动物细胞的特性[13]。而分离病毒HA 234 位点的L 以及236 位点的G 表明其能够结合哺乳动物α-2,6-唾液酸受体[14]。同时,有研究表明HA 198 位点不同的氨基酸残基会影响病毒与唾液酸受体结合的亲和力,以198V 对人类的亲和力最高,198T 次之,198A 最低[15]。因此,该分离病毒对人类受体可能亲和力更强。参照Okamatsu 等对HA 抗原位点的研究,分离病毒HA 的抗原位点发生了共计10 个突变,可见分离病毒在进化过程中发生了抗原特性的改变[15-18]。糖基化位点分析显示,分离病毒在218 位缺失糖基化位点,又在145、313 位新增糖基化位点,其特点与人源H9N2参考株A/Environment/Hunan/18355/2014(H9N2)相同。而本研究室前期研究表明HA 蛋白中313/218 位糖基化位点的变化影响了病毒对鸡胚和鸡的感染力和病毒在组织中的复制能力,但该糖基化位点的变化对病毒的气溶胶传播特性和抗原性没有影响[19]。而HA 的S145N 突变使得病毒自145 位新增一个糖基化位点,该位点的变化使得病毒毒力增强,免疫原性发生改变[19]。分离病毒NA 基因颈部杆状结构在aa63~aa65 位置缺失,它们在宿主范围变化中可能存在的作用尚未完全阐明,但这些缺失能够作为中国流感病毒分支的标志[8]。
分离病毒内部基因分析结果显示,其内部基因一些关键位点较2013 年~2015 年的禽源分离病毒并未发生明显变化。且分离病毒的8 个基因片段与2 株禽源H9N2 病毒的8 个基因高度同源。推测该分离病毒可能是由禽源H9N2 亚型流感病毒感染猪所致。并且禽源病毒未发生适应性变异就能够感染猪,更加突出了猪作为不同亚型流感病毒的“混合器”和“孵育器”的潜在威胁,需要加以严密的监控。
致病性试验中,分离病毒对鸡的致病作用最严重,在豚鼠模型中也能够感染,但并未在直接接触组的豚鼠组织中分离到病毒,表明分离病毒尚未获得在豚鼠间水平传播的能力,但未来是否会通过在猪宿主中的适应性进化而获得在豚鼠中水平传播的能力仍值得关注。
综上所述,本研究于2015 年分离到了一株猪源H9N2 流感病毒,该分离病毒能够无障碍地感染宿主猪,表明猪是禽、猪流感病毒共同感染的宿主。因此,猪可能在流感病毒基因重组、变异、产生新流行株的过程中起重要作用。因此,需要进一步监测H9N2 流感病毒,以了解其在不同宿主中的毒力变化和抗原性变化,为H9N2 流感病毒的防控奠定基础。
