蓝狐β-防御素1基因(vBD1)的真核表达及其抑菌活性分析
2019-08-19铁宇娟刘陶林王东阳刘志平田丽红
铁宇娟,刘陶林,蔡 卉,王东阳,刘志平,田丽红
(东北林业大学野生动物资源学院,黑龙江哈尔滨150040)
β-防御素(Beta-defensin,DEFB)是哺乳动物体内一类重要的抗菌肽,广泛分布于粘膜上皮细胞和中性粒细胞中,是机体先天性免疫和获得性免疫的重要组成部分[1]。由于DEFB具有广谱的抗微生物活性、细胞毒性、免疫调节等作用,被认为具备成为抗生素或抑菌活性药的替代品的潜力药物[2]。DEFB的抑菌作用与其独特的生物学结构有着密切的联系,其抑菌途径主要可分为两类:一类是DEFB作用于细菌膜或细胞壁。DEFB杀菌的经典机制是“孔隙形成”理论[3],即带正电荷的抗菌肽连接带负电荷的细菌膜(脂多糖、磷壁酸或磷脂),然后形成孔洞导致细菌分解,如DEFB hBD-3 通过与脂质双分子层的连接来抑制细菌细胞壁的合成,从而杀死细菌[4];另一类是DEFB作用于细菌内部。DEFB可以诱导细菌细胞凝集,通过吞噬细胞吞噬发挥抗菌活性[5],或者DEFB进入细菌内结合遗传物质并抑制其蛋白质的形成[6]。
此外,DEFB还可以作为机体体内免疫应答的重要调控因子,通过多种方式参与宿主免疫防御,包括增强巨噬细胞吞噬作用,加快中性粒细胞激活补体,促进树突状细胞(Dentritic cells,DC)和促进T细胞成熟等[7]。近年来的研究显示[8-9],DEFB参与人的免疫调节、抗肿瘤及男性生殖功能调节等作用,在牛和猪的抑菌、免疫调节及对雄性精子活性保护等方面发挥重要作用[10-11],与哺乳动物机体的炎症反应和免疫应答密切相关,但有关蓝狐DEFB的研究在国内外均未见相关报道。蓝狐作为我国重要的特种毛皮经济动物[12],养殖量逐年上升,疾病预防和有效繁殖直接关系到养殖经济效益,蓝狐DEFB的相关研究对于蓝狐细菌病防治和提高生殖性能均具有重要意义。为此,本研究对蓝狐DEFB 1(Vulpes lagopusbeta-defensin 1,vBD1)基因进行扩增克隆,并对该基因进行生物信息学分析,在此理论基础上,进一步构建了vBD1 重组基因酵母真核表达体系,表达了vBD1 重组蛋白,并初步探究了其抑菌活性,为进一步研究该蛋白的功能及应用奠定基础。
1 材料与方法
1.1 主要实验材料 蓝狐肾脏样本由哈尔滨华隆蓝狐育种有限公司提供;毕赤酵母菌GS115 标准菌株购自中国农业微生物菌种保藏管理中心(ACCC);pPIC9K 载体、大肠杆菌DH5α 和TOP10 感受态细胞均由东北林业大学动物医学实验室保存;各培养基根据需要加入终浓度为100 μg/mL 的氨苄青霉素(Amp)。
限制性内切酶(EcoRⅠ、NotⅠ)和T4 DNA 连接酶均购自宝生物工程(大连)有限公司;超纯总RNA提取试剂盒购自百泰克生物技术有限公司;反转录试剂盒(HiScriptⅡQ RT SuperMix)购自南京诺唯赞生物科技有限公司;Amp、DNA 凝胶回收试剂盒和质粒(小量)提取试剂盒等均购自哈尔滨迅捷生物科技有限公司;胰蛋白胨、琼脂糖、酵母粉和NaCl等均购自哈尔滨东山试剂生物技术有限公司;鼠抗His-Tag 单克隆抗体(MAb)等购自北京百奥莱博科技有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(IgG-HRP)购自哈尔滨市泰斯特生物科技有限公司。
1.2 引物的设计及合成 根据GenBank 中蓝狐vBD1 基因序列(MH491013)和pPIC9K 载体信息,设计vBD1 基因的PCR 引物与载体引物(表1)。
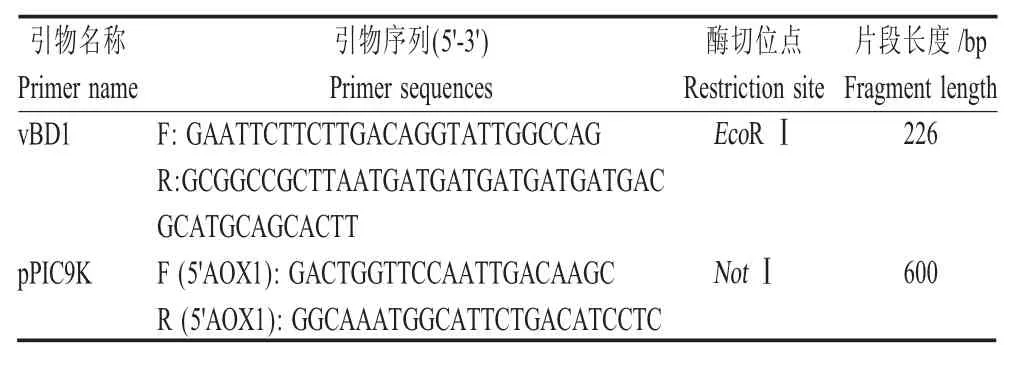
表1 PCR 扩增所用的引物信息Table 1 The primer sequences for PCR amplification
1.3 蓝狐vBD1 基因的PCR 扩增 采用超纯总RNA 提取试剂盒提取蓝狐肾脏样本总RNA,利用反转录试剂盒将其反转录成cDNA,以cDNA 为模,PCR 扩增vBD1 基因,PCR 反应程序:95 ℃5 min;95 ℃30 s、53 ℃30 s、72 ℃45 s,30 个循环;72 ℃7 min。PCR 产物经5 %琼脂糖凝胶电泳检测,并由吉林省库美生物科技有限公司测序。
1.4 vBD1 蛋白的生物信息学分析
1.4.1 vBD1 蛋白的理化性质分析通过DNAMAN 8.0 将vBD1 基因序列翻译成氨基酸序列,利用Antheprot 软件对vBD1 蛋白进行一级结构(氨基酸含量、质量、等电点等)分析。应用EXPASY 服务器(https://web.expasy.org/cgi-bin/)的Protparam、ProtScale分析工具对蛋白质的分子质量大小、理论等电点、氨基酸组成及蛋白的亲水性与疏水性进行分析。
1.4.2 vBD1 蛋白的结构分析利用在线软件http://www.cbs.dtu.dk/services/的SignalP、TMHMM program、NetPhos、NetNGlyc 和NetOGlyc、NetCTL 在线网站,采用默认参数,选择高严谨度搜索,分析VBD1 氨基酸的信号肽、蛋白的跨膜区、磷酸化位点、N-糖基化位点、O-糖基化位点以及T 细胞结合位点。利用http://tools.immuneepitope.org/bcell/对可能存在的线性B 细胞抗原表位进行分析。利用在线软件https://www.predictprotein.org/# 对二硫键数量进行分析。同时利用在线软件https://npsa-prabi.ibcpfr/cgibin/npsa_automaplpage=/NPSA/npsa_server.html和SWISS-MODELWorkspace 对蛋白二级结构及三级结构进行分析。
1.5 pPIC9K-vBD1 重组表达载体的构建及鉴定将1.3 中PCR 扩增得到的vBD1 基因回收,将其克隆至pMD19-T 载体,构建重组质粒pMD19-T-vBD1。用EcoRⅠ和NotⅠ将表达载体pPIC9K 和重组质粒pMD19-T-vBD1 分别双酶切,回收纯化后,T4 DNA 连接酶16 ℃连接过夜,连接产物转化TOP10 大肠杆菌感受态细胞,PCR 和双酶切鉴定为阳性的重组菌由吉林省库美生物科技有限公司测序。测序正确的重组质粒命名为pPIC9K-vBD1。
1.6 无内毒素质粒DNA 的线性化及纯化回收 根据毕赤酵母表达载体pPIC9K 的结构特点,利用限制性内切酶SacⅠ将提取的无内毒素质粒pPIC9KVBD1 线性化,酶切条件为:37 ℃,4 h~6 h。再经氯仿抽提法,提取线性化产物DNA,-20 ℃备用。
1.7 毕赤酵母阳性转化子的筛选及PCR 鉴定 采用电转化方法分别将线性化质粒DNA(pPIC9K-vBD1和pPIC9K)转化至100 μL 新鲜制备的毕赤酵母GS115 感受态细胞中,再经过高拷贝转化子(G418抗性)的筛选以及Mut+(Methanol utilization plus)甲醇利用正常型转化子的筛选,获得毕赤酵母阳性转化子。将筛选的pPIC9K-vBD1 的His+Mut+高拷贝转化子接种于YPD(Yeast Extract Peptone Dextrose Medium)液体培养基,28 ℃250 r/min 培养16 h~20 h,对3份样品(2 份pPIC9K-vBD1/GS115, 1 份pPIC9K/GS115 培养后,离心收集菌体,提取酵母基因组。再以针对vBD1 和pPIC9K 的两对引物(表1)对每个样品进行PCR 鉴定。
1.8 重组蛋白的诱导表达及鉴定 将1.7 中鉴定的阳性菌分别接种于10 mL BMGY (Buffer Minimal Glycerol-complex of Yeast)+Amp 酵母诱导表达前培养基中,28 ℃250 r/min 恒温震荡培养至OD600nm值为0.65~0.80,转接至200 mL BMMY (Buffer Minimal complex of Yeast)酵母诱导表达培养基中,并加入终浓度为1 %的甲醇(甲醇每24 h 补充一次)。以28 ℃250 r/min 诱导48 h 开始,每隔24 h 收集10 mL菌液(至120 h 为止),离心,取上清液,-80 ℃冻存。收集的部分上清液经过12 h 冻干浓缩处理后,进行Tricine-SDS-PAGE 分析;并将含有重组表达蛋白vBD1 的诱导菌上清液经镍离子琼脂糖蛋白纯化柱纯化,-80 ℃冻存。再以鼠抗His-Tag MAb (1∶4 000)为一抗,山羊抗小鼠IgG-HRP (1∶1 000)为二抗,对纯化的蛋白进行western blot 鉴定。
1.9 重组蛋白的抑菌活性试验 分别取100 μL 的大肠杆菌和金黄色葡萄球菌接种于5 mL 的LB 培养基,37 ℃180 r/min 培养至OD600nm值为0.60~0.70。再以LB 培养基为底液,稀释1.8 中纯化的重组蛋白,分别依次接种0.5 mL 大肠杆菌和金黄色葡萄球菌的菌液,使得重组蛋白终浓度分别为0、30 μg/mL、60 μg/mL 和120 μg/mL,37 ℃180 r/min 培养,分别于接种后的0、4 h、8 h、12 h 和16 h 取样,以10倍递进稀释,进行CFU 平板法计数,分析重组蛋白的抑菌率。
2 结 果
2.1 vBD1 氨基酸序列的同源性比对分析 蓝狐vBD1 基因的编码氨基酸序列与NCBI 中其它11 个物种的DEFB1 氨基酸序列比对分析显示,蓝狐vBD1 蛋白氨基酸序列与犬的DEFB1 的相似度最高,仅有1 个氨基酸的差异。蓝狐vBD1 与其它11 个物种的DEFB1 均具有6-4-9-6-0 的半胱氨酸(Cyc)间隔模式,并且氨基酸序列长度与其余物种保持一致。
2.2 vBD1 蛋白的理化性质分析结果 利用Antheprot 软件对vBD1 推导氨基酸序列的理化性质进行分析预测,结果显示vBD1 蛋白为69 aa,分子质量为7.715 ku,其中半胱氨酸(Cyc)、甘氨酸(Gly)和亮氨酸(Leu)含量相对较高,分别为10.14 %、11.59 %和17.39 %;丙氨酸(Ala)、天冬氨酸(Asp)、甲硫氨酸(Met)和谷氨酰胺(Gln)的含量相对较低,为2.89 %。利用ProtScale 对vBD1 蛋白的疏水性进行预测(Windows size=9),根据氨基酸分值越低亲水性越强,反之分值越高疏水性越强的规律,结果显示,vBD1蛋白总平均疏水性(GRAVY)为-0.490,其在第10 位的分值最高(3.656),有最强疏水性;在第31 位的分值最低(-1.489),有最强的亲水性。主要疏水部位分布在aa5~aa18、aa21~aa28 和aa47~aa53;主要亲水部位分布在aa29 ~aa39、aa41 ~aa44 和aa56 ~aa65。表明vBD1 属于亲水类蛋白。
2.3 vBD1 蛋白的结构分析结果 利用predictprotein 对vBD1 蛋白的二级结构进行预测分析,结果显示,该蛋白具有信号肽,其二级结构主要有α-螺旋和无规则卷曲构成,其中α-螺旋(Hh)占34.78 %(24 个),伸展链(Ee)占14.50 % (10 个),无规则卷曲(Cc)占50.72 % (35 个)。根据kinasephos2 的预测分析显示,vBD1 蛋白具有12 个磷酸化位点,分别为3 个丝氨酸(Ser)、5 个苏氨酸(Thr)和4 个酪氨酸(Tyr),潜力均大于50 %。vBD1 蛋白具有3 个二硫键,分别位于第37 和第66 位、第44 和第59 位和第49 和第67 位。三级结构预测结果显示,vBD1 蛋白序列与PDB 数据库中人类β-防御素1 (Human beta defensin 1,hBD1)2nlc.2A 模板序列相似性达63.89 % (图1)。
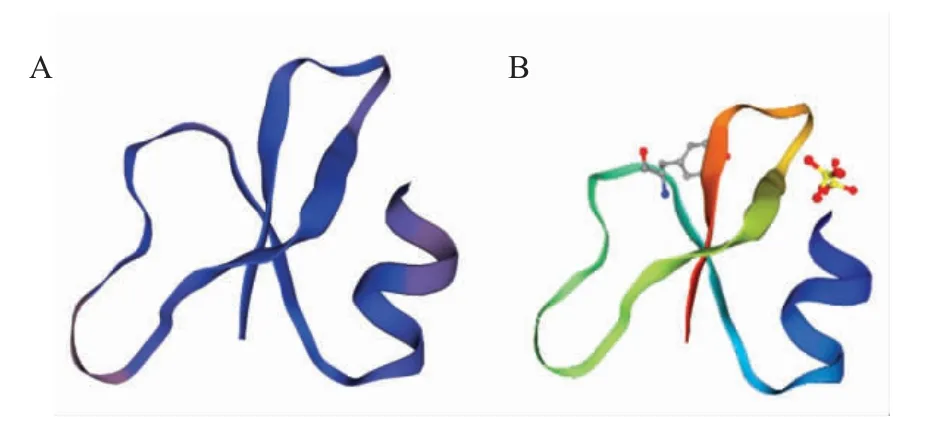
图1 蓝狐vBD1 蛋白的三维结构预测分析Fig.1 Tertiary structure prediction analysis of vBD1 protein
2.4 pPIC9K-vBD1 重组表达载体的构建与鉴定以蓝狐肾脏样本RNA 反转录的cDNA 为模板PCR扩增结果显示,扩增出约200 bp 的目的基因片段(图2)。vBD1 基因序列测定和同源性分析结果显示该基因大小为226 bp,与预期的226 bp 大小相符,编码69 个氨基酸,该基因与蓝狐vBD1 基因(MH491013)的同源性为100 %,表明获得了蓝狐vBD1 基因。将该基因克隆至pPIC9K 载体构建了重组质粒pPIC9K-vBD1,经EcoR Ⅰ和NotⅠ双酶切后,结果显示,产生9 000 bp 的载体条带和200 bp左右的目的条带(图3),表明重组质粒pPIC9K-vBD1正确构建。
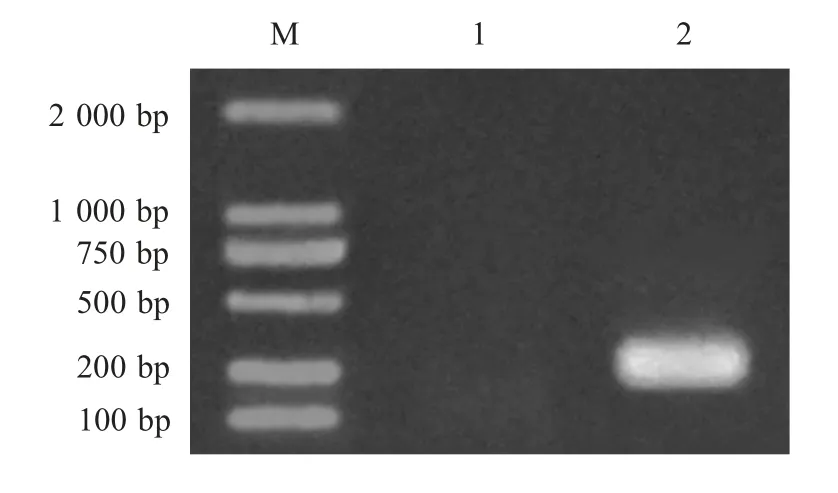
图2 vBD1 基因的PCR 扩增Fig.2 Amplification of vBD1 gene by PCR
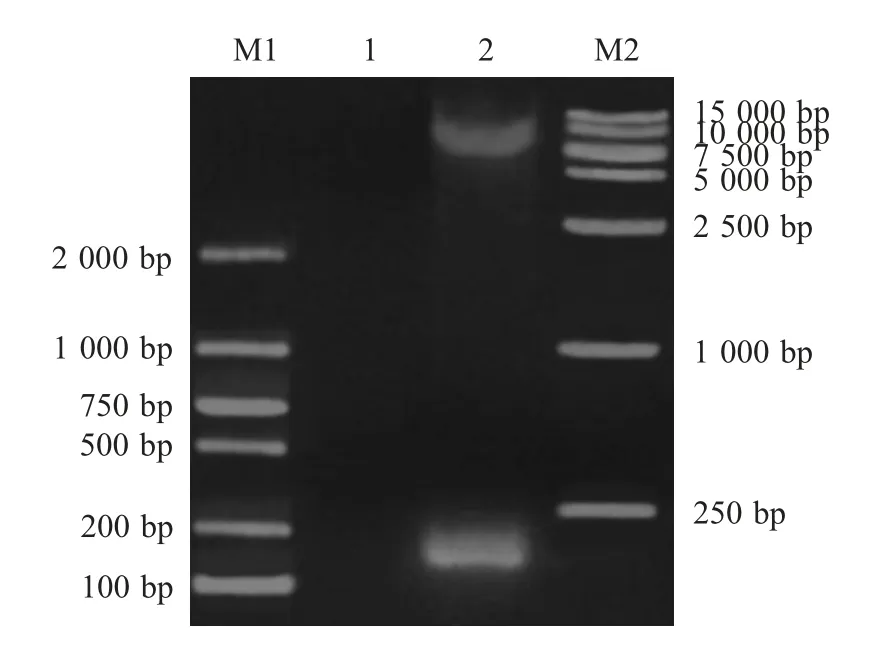
图3 pPIC9K-vBD1 的双酶切鉴定结果Fig.3 Double enzyme digestion identification of pPIC9K-vBD1 by PCR
2.5 毕赤酵母His+Mut+高拷贝转化子的PCR 鉴定对筛选出的3 株重组毕赤酵母菌基因组,以pPIC9K通用引物5'AOXⅠ-F/3'AOXⅠ-R 进行PCR 鉴定结果显示3 个样本在约600 bp 存在明显条带;再以特异性引物5'AOXⅠ-F/vBD1-R 进行PCR 鉴定,结果显示pPIC9K-vBD1 转化子样本在约800 bp 出现特异性条带,而pPIC9K 空载体对照在约600 bp 出现条带(图4)。表明目的基因vBD1 整合至酵母基因组。
2.6 重组vBD1 蛋白的表达及western blot 鉴定分别收集重组菌pPIC9K-vBD1/GS115 和pPIC9K/GS115 诱导48 h、72 h、96 h 和120 h 的上清液,冻干浓缩后进行Tricine-SDS-PAGE 电泳分析,结果显示,出现分子量约为7 ku 的目的条带,表明重组vBD1 蛋白在酵母菌中以分泌形式获得表达(图5)。并对冻干浓缩后的上清样液进行his 标签镍柱纯化后,获得纯度较高的重组蛋白,经western blot 分析,结果显示诱导48 h、72 h、96 h 和120 h 样品均在约7 ku 处出现一条特异性抗体结合条带,而pPIC9K/GS115 对照样本在相应位置处无此特异性条带(图6),表明具有His 标签的目的蛋白获得表达,且96 h 的表达量最高。
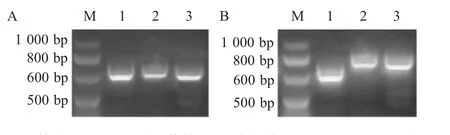
图4 含有重组质粒pPIC9K-vBD1 的毕赤酵母基因组的PCR 鉴定Fig.4 Identification of Pichia genome containing recombinant plasmid pPIC9K-vBD1 by PCR

图5 重组vBD1 蛋白的Tricine-SDS-PAGE 分析Fig.5 Analysis of recombinant vBD1 protein by Tricine-SDS-PAGE
2.7 重组蛋白的抑菌活性试验结果 将重组vBD1蛋白分别以不同终浓度与大肠杆菌和金黄色葡萄球菌共培养,分别于不同时间点取样,进行CFU 法计数统计,计算抑菌率。结果显示,终浓度为60 μg/mL和120 μg/mL 的重组蛋白对大肠杆菌的抑菌率分别为22.92 %和29.17 %,对金黄色葡萄球菌的抑菌率分别为28.40 %和30.18 %,抑菌活性均在12 h 达到最佳;终浓度为30 μg/mL 的重组蛋白基本不具备抑菌活性(表2)。表明重组蛋白vBD1 具备一定的抑菌活性,但其抑菌效率并不高。
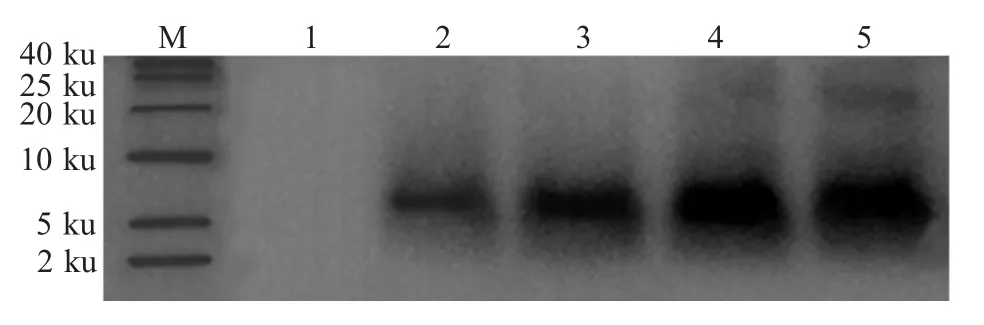
图6 重组蛋白vBD1 的western blot 分析Fig.6 Analysis of recombinant protein vBD1 by western blot
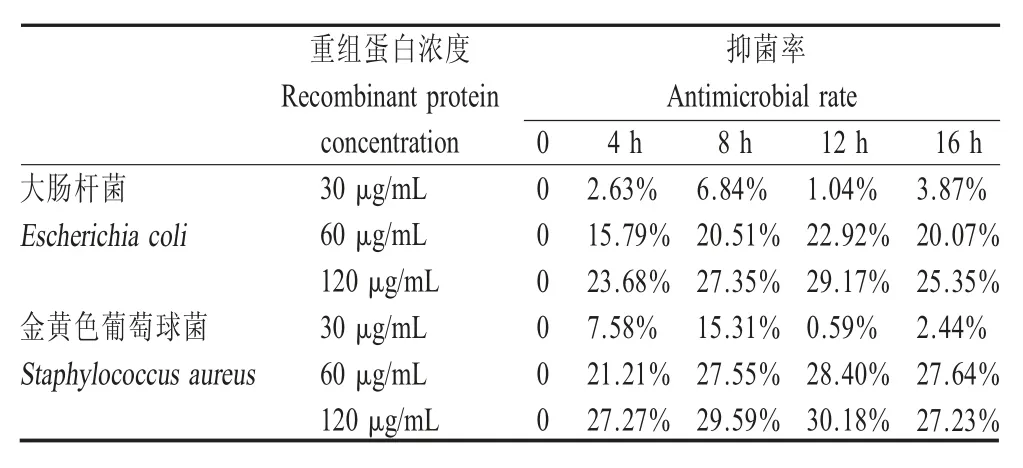
表2 重组蛋白vBD1 的抑菌率Table 2 Antimicrobial rate analysis of recombinant protein vBD1
3 讨 论
本研究通过重组载体真核诱导表达,获得了较高纯度的蓝狐vBD1 蛋白,采用生物信息学软件对该蛋白的结构、磷酸化位点等生物学信息进行预测分析。尽管不同宿主间DEFB1 的氨基酸序列存在差异,却大体上均保持着拥有约69 aa 的成熟肽序列,同时均拥有“6-4-9-6-0”的半胱氨酸的分布模式,提示不同宿主间的DEFB1 蛋白拥有着类似的空间结构。蛋白三级结构预测(图1)进一步证实蓝狐vBD1蛋白与人hBD1 蛋白具有很高相似度。此外,对蓝狐vBD1 蛋白序列在线预测分析,发现蓝狐vBD1蛋白存在着12 个潜在的磷酸化位点,提示蓝狐vBD1 蛋白可能会作为受体蛋白,与细胞内信号转导和蛋白定位等过程有密切联系。
CFU 抑菌活性显示,蓝狐vBD1 蛋白呈现较弱的抑菌活性,然而DEFB 家族作为哺乳动物体内重要的免疫调节因子[7],其在参与免疫调节过程中具有重要意义。hBD1 作为人体重要的抗菌肽之一,广泛分布于肺脏、肝脏、肾脏以及外周血等组织器官中[13-14],与蓝狐vBD1 的分布情况相似。Lehmann等通过荧光定量检测发现,正常肾组织与慢性细菌感染的肾组织中hBD1 的表达量并没有发生较大波动,而hBD2 的表达量明显上升[15],提示hBD1 对外源细菌微生物的直接作用并不明显。Bose 等的体外细胞模型实验发现,hBD1 能够作为信号因子,其诱导前列腺癌细胞的快速溶解,提示其可能具有抑癌能力,并且推测在前列腺癌症患者中,致癌基因PAX2 通过与hBD1 启动子结合,从而抑制hBD1 的表达,引发前列腺癌[16]。Raschig 等通过电子显微镜检测和免疫荧光法发现,hBD1 的抑菌过程中,能够形成一种网状结构来包裹住细菌,从而抑制细菌的侵染性,但并不直接杀死细菌[17],表明hBD1 的直接抑菌活性较低,与重组蛋白vBD1 的抑菌试验结果一致。因此,推测hBD1 在参与免疫过程中的主要作用是通过识别病原微生物或病变组织细胞,附着或以网状结构包裹抗原表面,进而递呈给吞噬细胞或巨噬细胞,诱导免疫反应,而并不具备直接杀菌的能力。鉴于蓝狐vBD1 与人hBD1 在氨基酸组成和蛋白三级结构相似性较高,且vBD1 蛋白的抑菌率约为30 %,提示vBD1 的主要抑菌途径是通过作用标记病原微生物表面,诱导机体免疫反应,而达到抑菌作用。但蓝狐vBD1 蛋白是否作为免疫因子在细胞间传递信号以及具体的抑菌机制等目前尚未清楚。本实验采用更接近于真核细胞天然结构的毕赤酵母表达系统,首次获得了蓝狐vBD1 的体外表达,并对该蛋白的体外抑菌活性进行了初步研究,为进一步探究蓝狐vBD1 蛋白抑菌功能以及免疫调节机制奠定了良好的物质基础。
