miR-145-5p通过靶向ABCE1表达影响人肺腺癌A549细胞的增殖和迁移
2019-08-15李晓倩杨雪英
于 潜,韩 旭,李晓倩,杨雪英*
0 引言
肺癌是世界上最常见的恶性肿瘤之一,而非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占肺癌总数的80%,具有致病因素及临床症状多样等特点[1]。肺腺癌是NSCLC重要的病理类型之一,其复发和转移是导致患者死亡的主要因素。虽然目前以手术切除为主、放化疗以及生物靶向治疗为辅的综合治疗能够在一定程度上减轻患者痛苦,但肺癌的死亡率仍逐年增加[2]。肺癌转移是多基因参与的综合过程,涉及到多种肿瘤转移相关基因的结构和(或)功能异常[3-4]。因此,筛查和识别肿瘤转移相关基因、探寻基因治疗、为临床提供新的诊疗靶点尤为重要。
微小RNA(microRNA,miR)属于非编码RNA家族中的一员,基因序列高度保守,广泛存在于哺乳类动物中,通过与靶基因的3′非编码区(3′Untranslated Regions,3′UTR)互补结合,抑制靶基因翻译或降解,从而发挥其转录后基因调控功能,在细胞生长、分化、增殖过程中起关键作用,也是有待研发的肺癌基因治疗的重要工具[5-6]。既往研究发现,miR-145-5p通过负性调控其靶基因表达参与多种肿瘤发生和转移[7-9],但其在NSCLC中的作用尚无报道。
ATP结合盒转运蛋白E1(ABCE1)属于ABC超家族的一员,能够重新启动翻译,调控真核生物的蛋白合成,参与病毒衣壳的装配过程,并在机体组织防御过程中发挥重要作用,与某些恶性肿瘤的发展密切相关[10-12]。前期研究显示,肺腺癌及转移淋巴结组织中,ABCE1表达明显高于癌旁组织和正常肺组织,并通过Fe-S簇结构域调控细胞骨架,促进肺癌转移[13-14]。
因此,本研究观察miR-145-5p在肺癌组织和细胞系中的表达,通过改变miR-145-5p的表达水平,探讨其与ABCE1可能存在的内在联系以及在A549细胞侵袭及迁移中的作用和机制。
1 实验方法
1.1 临床资料收集 选取2018年1-6月于中国医科大学附属第四医院行手术治疗的20例肺腺癌患者,男10例,女10例,年龄40~72岁,平均(62.9±5.58)岁。所有患者术前均未进行放、化疗。术中切除原发灶作为实验样本,同时切除距原发灶10 cm以上、且经病理医生证实无癌组织侵犯的肺组织作为对照的癌旁组织。
1.2 A549细胞培养和转染 细胞购自中国科学院上海生命科学研究院细胞资源中心。A549细胞培养条件:10%胎牛血清的F12K培养基,37 ℃、5%CO2细胞培养箱。细胞进入对数生长期后,经PBS缓冲洗涤后,室温下在100 μl DNA-氯化钙-2-(二乙醇氨基)乙磺酸-缓冲盐的混合物中静置20 min。使用磷酸钙法细胞转染试剂盒(碧云天)将miR-145-5p的模拟物、抑制剂和阴性对照物分别转染到A549细胞中孵育48 h。
1.3 miR-145-5p靶基因预测和验证 生物信息学软件TargetScan Human(http://www.targetscan.o rg/)列出能与ABCE1结合的所有miRs,根据互补碱基对长度、是否保守等因素初步确定为miR-145-5p。分别构建带有野生型和突变型结合位点的荧光报告基因载体,通过测序确认克隆载体成功构建。将各组细胞接种于24孔板中,荧光报告载体与miR-145表达质粒和阴性对照质粒均转染入A549 细胞株。48 h后按照试剂盒说明检测A549细胞中萤火虫和海肾荧光素酶的活性,结果以萤火虫荧光素酶/海肾荧光素酶活性比值表示。
1.4 MTT实验 将各组细胞均以1×103个/孔的密度接种于96 孔板,接种细胞后2、12、24、36、48 h观察细胞状态,贴壁且生长状态良好者继续每孔加入180 μl 10% F12K培养基与20 μl 5 mg/ml MTT的混合培养液,继续培养4 h后酶标仪OD 570 nm读数。以时间为横坐标、吸光度为纵坐标,绘制生长曲线。
1.5 划痕愈合实验 采用对数生长期、融合度超过90%的细胞,使用灭菌后Axygen 200 μl移液器吸头垂直在24孔细胞培养板上划线。PBS缓冲液彻底清洗划线后的脱落细胞并拍照。划痕后48 h观察细胞,并再次对划痕处进行拍照对比。
1.6 荧光定量PCR 使用TaqMan微小RNA试剂盒提取并通过qRT-PCR测定miR-145含量。Trizol提取各实验组中A549细胞的总RNA,按照逆转录试剂盒说明书逆转录为cDNA。PCR的反应条件:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s(30个循环)。溶解曲线参照仪器自动程序。使用U6和GAPDH作为内参,相对表达量以2-△△C法计算。引物序列为:miR-145-5p,上游:5′-ATC GTCCAGTTTTCCCAGG-3′,下游:5′-CGCCTCCACACACTCACC-3′;U6,上游:5′-ATTGGAACGATACAG AGAAGATT-3′,下游:5′-GGAACGCTTCACGAATTTG-3′;ABCE1,上游:5′-GAGGATCCCCGGGTACCGGTCGCCACCATGGCAGACAAGTTAACGAG-3′,下游:5′-TCCTTGTAGTCCATACCATCATCCAAGAAAAAGTAGTTTC-3′;GAPDH,上游:5′-AGCCACATCGCTCAGACAC-3′;下游:5′-GCCCAATACGACCAAATCC-3′。
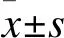
2 实验结果
2.1 miR-145-5p在肺癌组织和人肺腺癌A549细胞系中的表达变化 与癌旁组织相比,miR-145-5p在人非小细胞肺癌组织中的表达量显著降低(P<0.05),见图1A;与293T工具细胞相比,miR-145-5p在人肺腺癌A549细胞系表达量亦显著降低(P<0.05),见图1B。
2.2 ABCE1 miR-145-5p的靶基因 TargetScan生信预测软件提示,ABCE1可能为miR-145-5p的靶基因,在3′UTR存在互补结合的碱基对(图2A)。报告基因实验显示,在转染miR-145-3p表达质粒的A549细胞中,共转染野生型ABCE1-3′ UTR载体能够显著降低荧光素酶活性(P<0.05),见图2B;而共转染突变型ABCE1-3′UTR载体未见荧光素酶活性明显变化(P>0.05)。在转染miR-145-5p阴性表达对照质粒的A549细胞中荧光素酶活性均未见明显改变(P>0.05)。
2.3 miR-145-5p表达的变化对A549细胞中ABCE1 mRNA表达的影响 转染48 h后,PCR检测结果显示,在A549细胞中转染miR-145-5p模拟物可显著增加miR-145-5p的表达,降低ABCE1 mRNA的表达(P<0.05),见图3A;转染miR-145-5p抑制物可显著抑制miR-145-5p的表达,增加ABCE1 mRNA的表达(P<0.05);转染miR-145-5p阴性对照物没有明显变化(P>0.05)。
2.4 miR-145-5p表达的变化对A549细胞增殖能力的影响 MTT实验结果显示,与未转染细胞相比,转染miR-145-5p模拟物组在OD 570 nm时测定的吸光度数值明显小于未转染组、抑制物组和对照组,提示增殖能力降低(P<0.05),见图3B;抑制物组的吸光度明显高于另外3组,提示增殖能力显著增强(P<0.05);而转染阴性对照物组与未转染组的吸光度数值比较差异无统计学意义(P>0.05)。
2.5 miR-145-5p表达的变化对A549细胞迁移能力的影响 细胞划痕愈合实验结果显示,转染后,与未转染细胞相比,转染miR-145-5p模拟物组的划痕清晰,距离未见明显缩短(P<0.05),见图3C;转染抑制物组的划痕距离明显缩短,细胞迁移能力增强(P<0.05),而转染阴性对照物组的划痕距离虽有改变,但迁移能力仍弱于抑制物组细胞(P>0.05)。
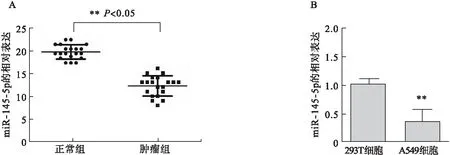
图1 miR-145-5p在肺癌组织和人肺腺癌A549细胞系中的表达
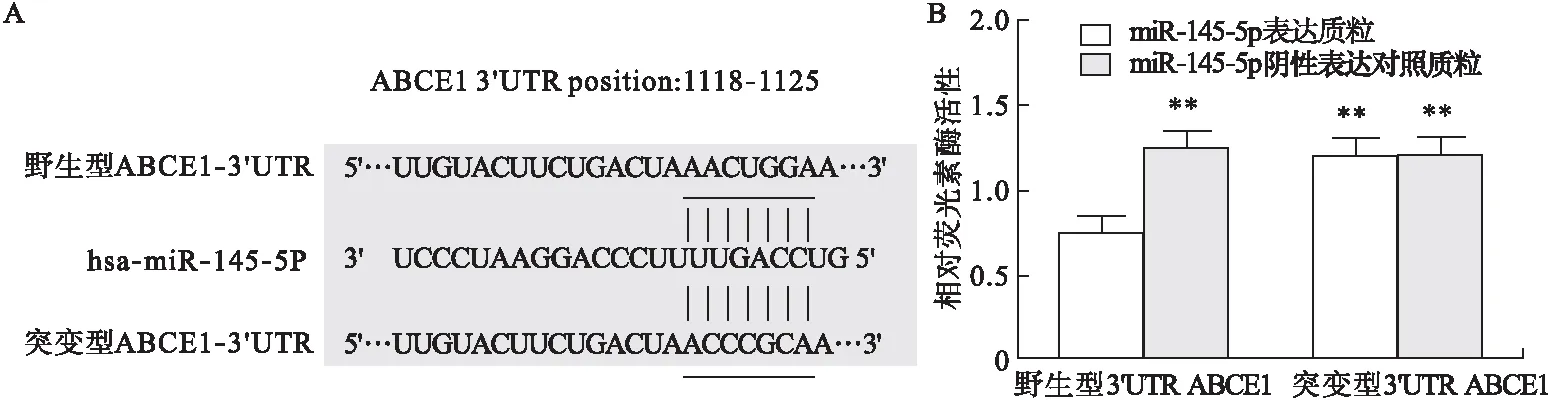
图2 miR-145-5p的靶基因预测和荧光素酶报告基因实验验证
注:A.Target ScanHuman生信数据库预测miR-145-5p和ABCE1存在的结合部位,B.荧光素酶报告基因实验证实ABCE1是miR-145-5p的靶基因。与共转染miR-145-5p表达质粒和野生型ABCE1-3′UTR载体的A549细胞比较,**P<0.05

图3 miR-145-5p表达变化对A549细胞中ABCE1表达、增殖和迁移能力的影响
注:A.PCR检测转染48 h后A549细胞中ABCE1 mRNA表达变化,B.MTT检测转染后A549细胞增殖能力变化,C.划痕愈合实验检测转染48 h后A549细胞迁移能力变化。与miR-145-3p过表达质粒ABCE1-3′UTR载体的A549细胞比较,**P<0.05
3 讨论
miRs是一类长度约为18~22个核苷酸的非编码RNAs。近年来,越来越多的研究证实,miRs表达水平和差异可作为癌症诊断、治疗和评估预后的重要指标[15-16]。在甲状腺癌中,miR-145可由甲状腺癌细胞分泌,通过调控靶基因AKT3的表达,进一步影响PI3K/Akt通路的活化,是促进甲状腺癌生长的主要调节因素[17]。在胰腺导管腺癌中,外源性增加miR-145-5p的表达,可以通过降低靶基因Smad3的表达,从而促进细胞凋亡,抑制癌细胞的增殖和侵袭[18]。同样,本研究发现,在肺腺癌中,癌组织和A549细胞系中miR-145-5p的表达均明显下降,提示miR-145-5p与肺腺癌的发生发展关系密切。
通常,miR通过与靶基因3′UTR互补结合,在转录后水平负性调控靶基因的表达,从而发挥调控分化、免疫和肿瘤发展等多种生物学作用[16]。同样,本研究通过TargetScan Human数据库预测,在ABCE1 3′UTR的1118至1125位置存在7个连续与miR-145-5p互补的核苷酸,结合稳定性高,可能存在调控关系。进一步采用双荧光素酶报告基因实验,发现在共转染miR-145-5p表达质粒和野生型ABCE1 3′UTR载体的A549细胞中荧光素酶活性显著降低,而突变型载体没有明显变化,证实ABCE1是miR-145-5p的靶基因。此外,转染人工合成的miRs产物从外源性改变miR-145-5p的表达,发现miR-145-5p的模拟物能够明显降低ABCE1的表达,而miR-145-5p抑制剂能明显增加ABCE1的表达,两者呈负相关,与荧光素酶报告基因结果一致。
转染不同miRs产物对A549细胞的增殖和迁移能力有影响,与既往研究结果一致[17-18]。本研究发现,与未转染或转染阴性对照物的细胞相比,miR-145-5p的模拟物能够明显降低A549细胞中ABCE1 mRNA的表达,同时降低在OD 570 nm时测定的吸光度数值,缩短划痕后的愈合迁移距离,表明A549细胞的增殖和迁移能力明显下降;而转染miR-145-5p抑制物组的A549细胞增殖和迁移能力明显增强。
综上所述,ABCE1是miR-145-5p的靶基因,外源性改变miR-145-5p的表达能够通过负性调控ABCE1的变化,进一步改变人肺腺癌细胞A549的增殖和迁移能力。本研究揭示了肺腺癌转移的新的机制,为临床综合治疗提供了新的作用靶点。
