正交试验法优化加杨树皮中白杨素的纯化工艺
2019-08-15赵友谊廖盼华王奇志
印 敏,严 奇,赵友谊,王 鸣,徐 曙,廖盼华,王奇志*
(1. 江苏省中国科学院植物研究所 江苏省植物资源研究与利用重点实验室,江苏 南京210014;2. 江苏省中国科学院植物研究所 江苏省农业种质资源保护与利用平台,江苏 南京210014)
加拿大杨(PopuluscanadensisMoench),又名加杨,是杨柳科(Salicaceae)杨属(Populus)多年生落叶大乔木,主根和侧根发达,树干通直挺拔,枝叶茂密;其品种生长快,适应性强,是速生用材林、防护林和行道河渠绿化的好树种,广泛应用于城乡绿化[1]。此外,加拿大杨还含有大量酚酸类化合物,如白杨素、高良姜素-3-甲氧基、乔松素、槲皮素-3,7-二甲氧基、鼠李素、山柰酚-3-甲氧基、芹菜素等[2],具有镇痛、抗自由基、抗肿瘤等药理作用,能保护心脑缺血损伤和肝损伤,对生殖系统、消化系统、内分泌系统、神经系统等均有作用[3-4]。其中,白杨素的作用尤为显著,能够抗炎,抗抑郁,抑制肿瘤细胞,调节免疫反应,修复睾丸损伤等[5-9],也是合成抗菌、抗癌、降血糖、调节免疫等药物的原料[10-13]。
根据文献报道,白杨素的分离纯化工艺主要是,以乙醇-水系统为洗脱剂,利用大孔树脂柱层析,进行梯度洗脱,收集洗脱液,重结晶得到白杨素粗品[14-15]。然而,由于大孔树脂的有机物残留高,对酚酸类化合物的纯化效果不及聚酰胺。因此,开发简便、准确、有效的从经石油醚冷浸脱脂后的杨树皮总酚酸流浸膏中提纯白杨素的制备方法具有重要意义。本实验以白杨素的纯度为指标,采用正交试验法优化聚酰胺纯化白杨素的工艺,为加拿大杨资源的进一步开发利用提供科学参考。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
高效液相色谱仪(美国Aglient 公司,Aglient 1110 HPLC);R-210型旋转蒸发器(瑞士Buchi公司);LIBROR AEL-200型电子天平;DK-98-II型电热恒温水浴锅。
1.1.2 试剂
加拿大杨树皮由江苏泗阳昇茂木业有限公司提供,经江苏省中国科学院植物研究所袁昌齐研究员鉴定为加拿大杨,标本现存放于江苏省中国科学院植物研究所药用植物研究开发中心(标本编号:Pc20170919)。白杨素对照品(购自中国药品生物制品检定所,批号:111701-200501);乙腈为色谱纯,其他试剂均为分析纯;聚酰胺(上海源叶生物公司)。
1.2 试验方法
1.2.1 杨树皮总酚酸的提取
称取经石油醚冷浸脱脂后的杨树皮15 kg,用60%乙醇,总液料比10∶1 (mL·g-1),回流提取3次,每次2 h,过滤,合并滤液,浓缩得总酚酸流浸膏2.5 kg。
1.2.2 对照品溶液的制备
精密称取白杨素对照品5.01 mg,置50 mL棕色量瓶中,加60%乙醇溶解并定容,得白杨素贮备液(0.1002 mg·mL-1);精密量取白杨素贮备液适量,用60%乙醇配制成系列浓度的对照品溶液,即得。
1.2.3 样品的测定
精密吸取正交试验样品1 mL,过滤,取滤液,即得供试品溶液。通过高效液相色谱法,计算白杨素的纯度。
2 结果与分析
2.1 聚酰胺对总酚酸中白杨素的静态吸附-洗脱性能实验
取3种不同型号的聚酰胺(30-60目、60-80目、100-200目),加入已测含量的总酚酸提取液,静置、吸附、过滤、滤液定容、得未吸附溶液。过滤的聚酰胺用80%的乙醇洗脱至无色、定容得洗脱液。另外聚酰胺烘干,称重,计算平均重量。通过高效液相色谱测定各溶液中白杨素的含量。最终得出60-80目聚酰胺对总酚酸中白杨素的静态吸附量为30-60目聚酰胺的3倍(体积比),静态洗脱量为100-200目聚酰胺的7倍(体积比),吸附率为99%,洗脱率98%。
2.2 聚酰胺柱解吸附影响因素的考察
预装60-80目聚酰胺柱6 根,将等量总酚酸提取液吸附上样,依次用水、20%、40%、60%、80%、100%乙醇溶液各3个柱体积洗脱,收集洗脱液,检测各溶液中白杨素的浓度,选择最佳洗脱溶剂。通过高效液相色谱法测定各溶液中白杨素的含量。结果表明,60%乙醇溶液是最佳洗脱溶剂,此部位白杨素含量较高。
2.3 单因素试验
2.3.1 上样浓度的筛选
预装60-80目聚酰胺柱5 根,将等量不同浓度的总酚酸提取液(上样浓度:总酚酸流浸膏的稀释倍数,分别稀释1、2、3、4、5倍)吸附上样,以60%乙醇溶液为流动相,洗脱3个柱体积,收集洗脱液,经重结晶得白杨素粗品,按照“1.2.3项”方法进行纯度测定。结果显示,在一定范围内,白杨素纯度与稀释倍数呈正相关;当稀释倍数为3时,白杨素纯度与上样浓度无关,几乎为一定值。从白杨素工艺生产的角度考虑,故选择稀释倍数为3,见表1。

表1 上样浓度的筛选
2.3.2 上样量的筛选
预装60-80 目聚酰胺柱5 根,将不同量已稀释3 倍的总酚酸提取液(上样量:上样样品与聚酰胺柱的体积比,分别为2∶1、1∶1、1∶2、1∶4、1∶8)吸附上样,以60%乙醇溶液为流动相,洗脱3个柱体积,收集洗脱液,经重结晶得白杨素粗品,按照“1.2.3项”方法进行纯度测定。结果显示,在一定范围内,白杨素纯度与上样量呈负相关;当上样量达到1∶2时,白杨素纯度与上样量无关,几乎为一定值。从白杨素工艺生产的角度考虑,故选择上样量为聚酰胺柱体积的1/2,见表2。

表2 上样量的筛选
2.3.3 吸附流速的筛选
预装60-80目聚酰胺柱6根,量取聚酰胺柱体积1/2的已稀释3倍的总酚酸提取液,分别以5、10、20、40、60、100 ml/min的流速吸附上样,以60%乙醇溶液为流动相,洗脱3个柱体积,收集洗脱液,经重结晶得白杨素粗品,按照“1.2.3项”方法进行纯度测定。结果显示,在一定范围内,白杨素纯度与吸附流速无关;当吸附流速达到20 ml/min时,白杨素纯度与吸附流速呈负相关。从白杨素工业生产效率的效率考虑,故选择吸附流速为20 ml/min,见表3。

表3 吸附流速的筛选
2.3.4 洗脱流速的筛选
预装60-80目聚酰胺柱6根,量取聚酰胺柱体积1/2的已稀释3倍的总酚酸提取液,以40 ml/min的流速吸附上样,以60%乙醇溶液为流动相,分别以10、20、40、80、120、160 ml/min的流速洗脱3个柱体积,收集洗脱液,经重结晶得白杨素粗品,按照“1.2.3项”方法进行纯度测定。结果显示,在一定范围内,白杨素纯度与洗脱流速无关;当洗脱流速达到80 ml/min时,白杨素纯度与洗脱流速呈负相关。从白杨素工业生产的效率考虑,故选择洗脱流速为80 ml/min,见表4。
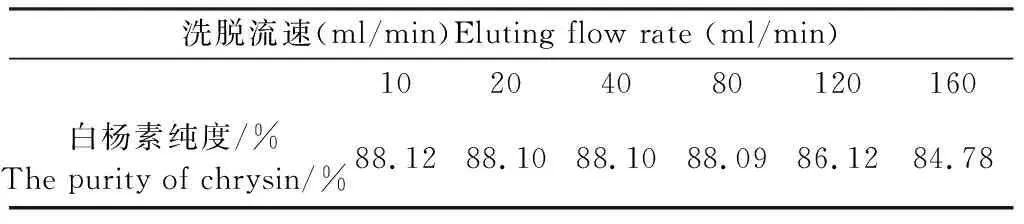
表4 洗脱流速的筛选
2.4 正交试验设计
为探究聚酰胺柱层析纯化总酚酸溶液中白杨素的最佳工艺条件,对影响分离效果的主要因素设计了4因素3水平的L9(34)正交试验方案,经重结晶得白杨素粗品,以白杨素纯度为考察指标,选择最佳上样浓度(上样浓度:总酚酸流浸膏的稀释倍数)、上样量(上样量:上样样品与聚酰胺柱的体积比)及流速(单位:ml/min)。正交试验因素与水平见表5、试验结果见表6、方差分析结果见表7。

表5 正交实验设计
2.5 正交样品溶液的制备
分别称取杨树皮总酚酸流浸膏2.5 kg,按照L9(34)正交试验表上样、过柱。
2.6 正交试验方法及结果
用L9(34)正交试验表进行正交试验研究,试验结果见表6,并对白杨素纯度进行方差分析,结果见表7。
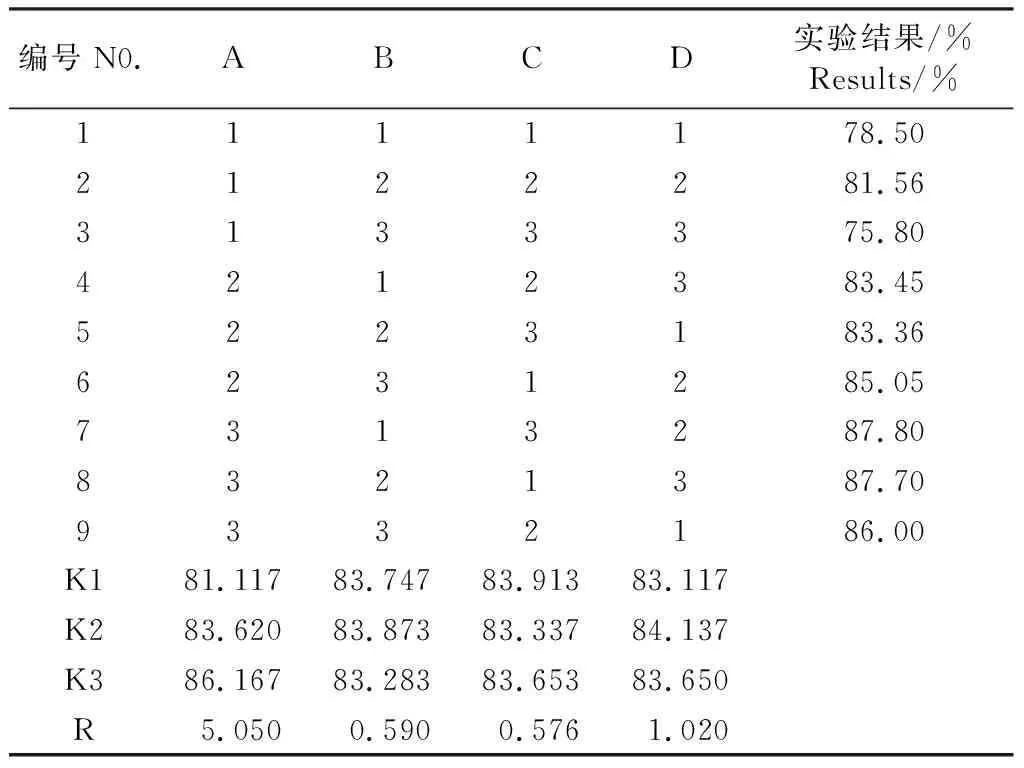
表6 正交试验结果及分析
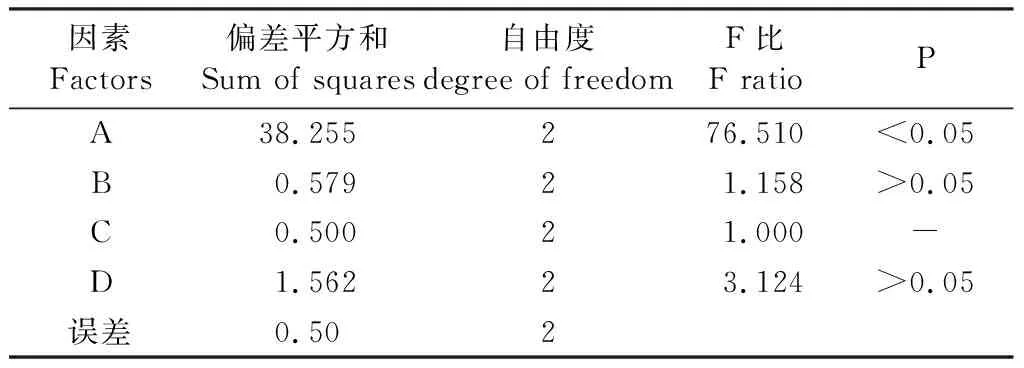
表7 方差分析结果
由表7能够直观地看出,以白杨素纯度为考察指标,影响纯度的因素依次为A>D>B>C,即上样浓度(总酚酸流浸膏稀释倍数)的影响最高,其余依次是洗脱流速、上样量(上样样品与聚酰胺的体积比),影响最小的是吸附流速。根据方差分析结果可知,A因素对白杨素纯度的影响有显著性差异,B和D因素对白杨素纯度的影响无显著性差异。根据表6各因素k的变化,A3>A2>A1,B2>B1>B3,C1>C3>C2,D2>D3>D1,得出A因素应选择水平3,B和D因素应选择水平2,C因素应选择水平1,即A3B2C1D2。最终确定最佳的聚酰胺纯化工艺条件为:A3B2C1D2,即上样浓度为稀释3倍的杨树皮总酚酸流浸膏,上样量与聚酰胺柱的体积比为1∶2,吸附流速为20 ml/min,洗脱流速为80 ml/min。
2.7 最佳纯化工艺条件的验证
按照上述最佳的聚酰胺纯化工艺进行3次验证试验,其结果见表8。由验证结果可知,按最佳的聚酰胺纯化工艺得到的白杨素纯度均高于其它各正交试验值,三份样品白杨素的平均提取率为88.34%,RSD为0.44%。说明该工艺稳定、可靠,达到了纯化条件优化的目的。

表8 验证试验结果
3 结论
3.1 本试验使用高效液相色谱法,对白杨素对照品溶液及供试品溶液进行检测,直接测定供试品溶液中白杨素的纯度,操作简单,干扰少,测定结果更准确。
3.2 白杨素是加拿大杨树皮中总酚酸的主要成分之一,本实验以白杨素纯度为考察指标,采用了L9(34) 正交试验,确定了最佳的纯化工艺条件为:以60-80目的聚酰胺聚酰胺装柱,以60%乙醇溶液为流动相,上样浓度为稀释3倍的经石油醚脱脂后的杨树皮总酚酸流浸膏,上样量与聚酰胺柱的体积比为1∶2,吸附流速为20 ml/min,洗脱流速为80 ml/min。收集60%乙醇溶液洗脱部位,此部位白杨素含量较高,经重结晶可得白杨素粗品。该提取工艺稳定可行,适用于白杨素的工业化生产。
