万寿菊不定根发生中全蛋白双向电泳体系构建※
2022-09-16李雪萍
●李雪萍 金 鑫
(1.兰州新区现代农业发展研究院 甘肃 兰州 730300;2.临沂大学 山东 临沂 276005)
万寿菊(Tagetes erectaL.),又名臭芙蓉,为菊科万寿菊属植物。为了提高万寿菊的栽培观赏价值,研究者对万寿菊品种抗旱性[1]、耐盐性[2]进行了综合评价,并对干旱条件下促进万寿菊不定根的发生[3]进行了研究,并取得一定的研究成果。但对万寿菊不定根发生过程中蛋白质组学方面的研究尚未见报道。
双 向 电 泳(Two dimensional electrophoresis,2-DE)作为蛋白质组研究的核心技术之一,最早建立于1975年,该方法大大提高了蛋白质分离的分辨率和重复性[4]。本研究采用改良TCA/丙酮沉淀法,在膜蛋白和疏水性蛋白的提取方面进行了改善,对双向电泳的上样量、等电聚焦参数及分离胶浓度等条件进行了优化,得到适于万寿菊全蛋白分析的提取方法和双向电泳技术体系。
1 材料与方法
1.1 试验材料
试验所用万寿菊种子为泛美奇迹系列黄色,2021年2月购自兰州市甘肃新时代园林工程公司。参考Liao等[5]的方法,将万寿菊种子进行消毒,萌发5 d。控制好环境因子,萌发期间培养箱温度为(25±1)℃,每天光照14 h,光强为200 μmol/(s·m2)。培养 5 d 后的万寿菊幼苗,在下胚轴基部切去乳白色初生根,作为外植体在装有蒸馏水、0.1% PEG溶液(w/v)、PEG+NO (SNAP作为NO供体)和PEG+H2O2中继续培养3 h[6]后取样,用液氮速冻保存至-80℃冰箱备用。
1.2 试验方法
1.2.1 TCA/丙酮法取4 g样品于研钵中,加入0.4 g 聚乙烯吡咯烷酮(PVPP)用液氮研磨至粉末。用含0.7 g/L二硫苏糖醇(DTT)的丙酮溶液洗涤沉淀至颜色变白,沉淀真空干燥。加入裂解液室温裂解2 h,离心上清即为蛋白[7]。
1.2.2 改良TCA/丙酮法参照Damerval等[7]的方法并做修改。取2 g样品于研钵中,加入0.04 g PVPP,5倍体积的 Tris-Hcl(含1 mmol/L PMSF),混匀离心,取上清加入5倍体积TCA/丙酮[含10% TCA和0.07% β-巯基乙醇(β-ME)],弃上清,沉淀用预冷丙酮(含0.07% β-ME)进行洗涤,干燥后加蛋白裂解液,其中DTT现加,离心上清即为蛋白。
1.2.3 蛋白定量参照Bradford方法进行蛋白定量,配制考马斯亮蓝(CBB)G-250染色液和牛血清蛋白(BSA)标准溶液,加超纯水配制不同浓度的蛋白溶液,加比色液测定其显色后的OD值,绘制标准曲线。在595 nm波长下测定蛋白样品的OD值,依据BSA标准曲线计算待测样品蛋白质的浓度[8]。
1.2.4 蛋白质双向电泳参考Bio-Rad 双向电泳操作手册,使用Bio-Rad Protean®i12TMIEF Cell系统,选取17 cm pH 4~7的线性胶条,上样量设为400 μg 和600 μg,加入水化上样缓冲液,补足至400 μL。设置IEF程序,开始第一向等电聚焦。设置每根胶条的极限电流50 μA,设置等点聚焦温度为20℃。聚焦结束后,立即开始胶条平衡,平衡结束后,开始第二向SDS-PAGE,再进行染色脱色。
2 结果与分析
2.1 不同方法提取对万寿菊全蛋白含量的影响
图1中的maker是对照组(a),清晰度适中,中间2个不清晰的垂直电泳条带(b,c)是通过TCA/丙酮法提取万寿菊全蛋白得到的,右边2条清晰的垂直电泳条带(d,e)是通过改良TCA/丙酮法提取万寿菊全蛋白得到的,且改良后的垂直电泳条带明显有增加。因此,改良后的方法更适合万寿菊全蛋白的提取。

图1 万寿菊全蛋白不同提取方法的SDS-PAGE图谱
2.2 不同分离胶浓度对万寿菊蛋白质分离效果的影响
由图2所示,条带a分离胶浓度为10%时,蛋白分离过快,至电泳跑胶完成时,蛋白条带集中在尾部,且由于蛋白分离速度较快,分离区域长度无法满足;当分离胶浓度为15%(条带c)时,蛋白质分离过慢,至电泳跑胶完成时,胶的上部存在大量蛋白聚集,蛋白质未能充分分离;相比较而言,在浓度为12%(条带b)的分离胶中,对蛋白的分离效果最好,各分子量蛋白条带都较清晰的展现在SDS-PAGE图谱上。因此,分离胶浓度为12%时,最适合万寿菊全蛋白的分离。
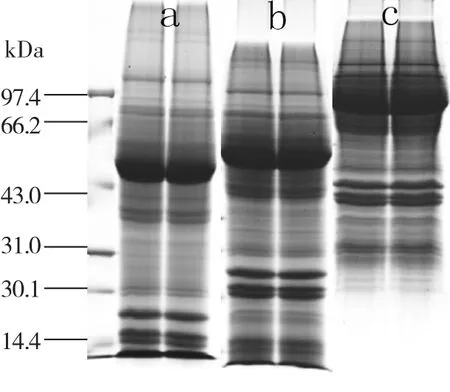
图2 不同分离胶浓度对SDS-PAGE图谱的影响
2.3 不同蛋白上样量对2-DE图谱的影响
上样量对2-DE图谱具有较大影响,上样量过高或过低均不能满足双向电泳分析的需要,合适的上样量才能达到最佳的蛋白分离效果。试验设400 μg和600 μg 2个上样量进行双向电泳(图3)。上样量为400 μg,分离胶浓度为10%时,横条纹、竖条纹多,背景不够清晰,蛋白点有较为明显的拖尾,并且有些较大的斑点将周围低丰度蛋白斑点掩盖(图3-a)。上样量为400 μg,分离胶浓度为12%时,2-DE图谱的效果略有改善,但蛋白点分离不够清晰(图3-b)。上样量为600 μg,分离胶浓度为12%时,一些低丰度蛋白得到充分分离且各丰度蛋白点得到均匀的分布,2-DE图谱背景清晰,存在较小扩散及拖尾现象(图3-c)。因此,选择600 μg上样量、12%分离胶浓度进行双向电泳分析可达到较好的分离效果。

图3 不同上样量对2-DE图谱的影响
3 讨论
本试验参照Wang等[9]的方法,选定65 mmol/L DTT加入水化上样缓冲液和裂解液,是为了保护二硫键并促进其溶解,两性离子去污剂CHAPS能显著提高蛋白质的溶解性,所以在裂解液中添加了4%的CHAPS 促进蛋白质溶解。
蛋白质分离的清晰度很大程度上由分离胶浓度决定,若胶的浓度较低,虽然蛋白质点能够较好地分离,但会丢失分子量较小的蛋白;若胶浓度过高,蛋白质分离不够清晰且有的蛋白点会出现重叠[10]。对于番茄子叶[11]等多数植物组织来说 ,12% 的分离胶浓度较适合其蛋白质的分离,本研究也得出浓度为12%的分离胶更适合万寿菊幼苗全蛋白的分离。
上样量的大小直接影响蛋白点的获取和双向电泳的分辨率。合适的上样量有利于蛋白的分离,并且在凝胶图谱上清晰地显现更多不同分子量的蛋白。在番茄子叶总蛋白双向电泳的研究中,选择300 μg为最适上样量[11];向日葵种子蛋白双向电泳中,选择1000 μg为最佳上样量[12]。在本研究中,当上样量达到600 μg时,2-DE 蛋白质图谱的分辨率较高,而且一些低丰度蛋白得以显现,因此,600 μg上样量足以进行后续研究。
