Hoxc13基因在苏博美利奴羊胎羔生长发育期不同组织中的表达分析
2019-08-15杜建文何军敏陈春艳田月珍徐新明付雪峰哈尼克孜吐拉甫
杜建文,何军敏,陈春艳,田月珍,徐新明,付雪峰,哈尼克孜·吐拉甫,
赵冰茹1,朱 桦1,黄锡霞1,田可川2
(1.新疆农业大学动物科学学院,乌鲁木齐,830052;2.新疆畜牧科学院畜牧研究所,乌鲁木齐,830011)
0 引 言
【研究意义】苏博美利奴羊是超细毛美利奴羊新品种,在2014年5月通过了国家农业部的验收,于我国新疆阿克苏地区拜城县种羊场培育出[1]。该品种具有抗逆性强、繁殖成活率高、羊毛细度为17~18 μm、羊毛品质好、产毛量高等特点[2]。羊毛受多种基因调控,其发育源于皮肤毛囊,是皮肤的衍生物[3]。美利奴细毛羊皮肤开始形成初级毛囊约在胚胎发育至50 d;形成初级毛囊约在70 d;第一种次级毛囊开始出现,约在胚胎发育至85 d;第二种次级毛囊开始形成,约在胚胎发育至105 d;至羔羊出生时,所有的毛囊都已形成[4-6]。【前人研究进展】研究已经发现了大量毛囊发育的相关基因参与了毛发周期性生长和毛发形态发生的发育。例如Hox基因、骨形成蛋白、Msx基因、成纤维生长因子、Wnt和Shh等基因,还有大量的激素也一起参与了毛囊生长发育的调控[7]。Hox基因是和肿瘤、胚胎发育以及其他各种疾病的发生密切相关的重要因子,与癌症发展和细胞周期控制密切相关的突出例子是Hox11[8]。Hox基因目前已鉴定的共有39个在哺乳类动物中,是重要的转录调节因子,其对毛囊细胞的分化与增殖有着重要作用[9-11]。在胚胎发育时期,Hox基因与动物的发育相关的头尾轴和背负轴的表达,受到对控基因与间隔基因的调控,模式表达为时空共线性[12]。Hox基因中Hoxc13是第一个被证实在控制毛发的发育和生长中有着重要作用的基因,当它过量表达或者缺少时,小鼠毛发生长都会表现出缺陷[13]。【本研究切入点】近年来对基因的表达量进行了研究,寻找相关的分子标记。研究苏博美利奴羊不同组织中Hoxc13基因mRNA的表达量差异。【拟解决的关键问题】研究Hoxc13基因在苏博美利奴羊不同组织和皮肤中的定量表达,建立苏博美利奴羊皮肤、肌肉以及不同内脏组织中GAPDH基因的SYBR Green Ⅱ RT-PCR的检测方法。
1 材料与方法
1.1 材 料
1.1.1 样本
试验羊群体是来自新疆科创畜牧繁育中心的苏博美利奴羊,对胎龄分别为65和135 d两个时期公羔的左侧肩胛部皮肤,右腿大腿后侧肌肉以及不同内脏组织(心脏、脾脏、肝脏、肺脏、肾脏)进行采集,置于冻存管中,于-80℃冰箱保存,用于后续总RNA的提取。
1.1.2 主要仪器设备
研究所用的仪器设备主要有ZHJH-C1112B超净工作台、∑H2O摩尔超纯水仪、BIOFUGE PRIMO R型低温离心机、Thermo NanoDrop 2000微量分光光度计、BIO-RAD凝胶成像系统、BIO-RAD普通PCR仪、BIO-RAD实时荧光定量PCR仪、LDZM-80KCS-Ⅲ立式压力蒸汽灭菌锅、GZX-9140MBE电热恒温鼓风干燥箱、METTLER TOIEDO电子天平、DYY-6C型电泳仪、微型离心机、IKA MS3涡旋振荡器、Eppendorf移液器等。
表 主要仪器设备
Table 1 Main equipment

主要仪器供应商 ZHJH-C1112B超净工作台海尔-20℃冰箱海尔4℃冰箱中科美菱超低温冷冻储存箱美的微波炉∑H2O摩尔超纯水仪BIOFUGE PRIMO R型低温离心机Thermo NanoDrop 2000微量分光光度计BIO-RAD凝胶成像系统BIO-RAD普通PCR仪BIO-RAD实时荧光定量PCR仪LDZM-80KCS-Ⅲ立式压力蒸汽灭菌锅GZX-9140MBE电热恒温鼓风干燥箱METTLER TOIEDO电子天平DYY-6C型电泳仪DYY-Ⅲ32型电泳槽微型离心机IKA MS3涡旋振荡器雪科制冰仪Eppendorf移液器 上海智城分析仪器制造有限公司山东山东山东广东上海摩勒科学仪器厂美国Thermo公司美国美国美国美国上海申安医疗器械厂上海博讯实业有限公司医疗设备厂德国北京六一北京六一杭州奥盛仪器德国江苏德国eppendorf公司
1.1.3 主要试验试剂
SYBR Green Ⅱ 荧光染料试剂盒、cDNA合成试剂盒(TaKaRa)、Trizol试剂、MarkerDL2000、Taq酶等,购自上海生工生物公司;硼酸、琼脂糖、核酸染料、无水乙醇、Tris碱、DEPC、氯仿、四甲基乙二胺(EDTA)、异丙醇等均由北京鼎国生物有限公司提供。
1.1.4 溶液配置
试剂的配置需要调节pH值的试剂在调节pH值后,需要进行高压灭菌处理,其灭菌条件为:1.034×105Pa,蒸汽灭菌20 min;在无特殊要求的情况下溶剂均为超纯水。以黄培堂[14]的分子克隆实验指南精编版为试验中试剂配制的参考。
(1)75%乙醇溶液:将75 mL无水乙醇加入25 mL超纯水中,使其充分混匀;
(2)0.5 moL/L EDTA:18.61 g EDTA- Na 2H2O,80 mL水,将pH值调至8.0并定容至100 mL,高压灭菌后4℃过夜;
(3)5×TBE:分别加入27 g Tris碱、0.5 M EDTA(pH 8.0)10 mL、13.75 g硼酸于容量瓶中,定容至500 mL;
(4)0.5×TBE:取10 mL 5×TBE溶于90 mL超纯水中,充分混匀;
(5)1%琼脂糖:向100 mL 0.5×TBE中加入1 g琼脂糖,在微波炉中加热使其充分溶解;
(6)2%琼脂糖:向100 mL 0.5×TBE中加入2 g琼脂糖,在微波炉中加热使其充分溶解;
(7)0.01%DEPC水:取1 mL DEPC溶于1 000 mL超纯水中,将其充分混匀后高压灭菌,37℃孵化过夜。
1.2 方 法
1.2.1 目的基因引物设计
采用引物设计软件Primer Premier 5.0根据NCBI提供的基因序列进行引物设计,并送至上海生工生物工程有限公司合成所需引物。引物设计的基本原则为避免引物二聚体以及具有特异性,上下游引物不能相差太大,引物长度在17~25个碱基以内,G C含量在40%~60%,避免DNA污染,碱基随机分布等。列出试验引物序列。表2
表2 实时荧光定量PCR引物序列
Table 2 Real-time PCR primer sequences
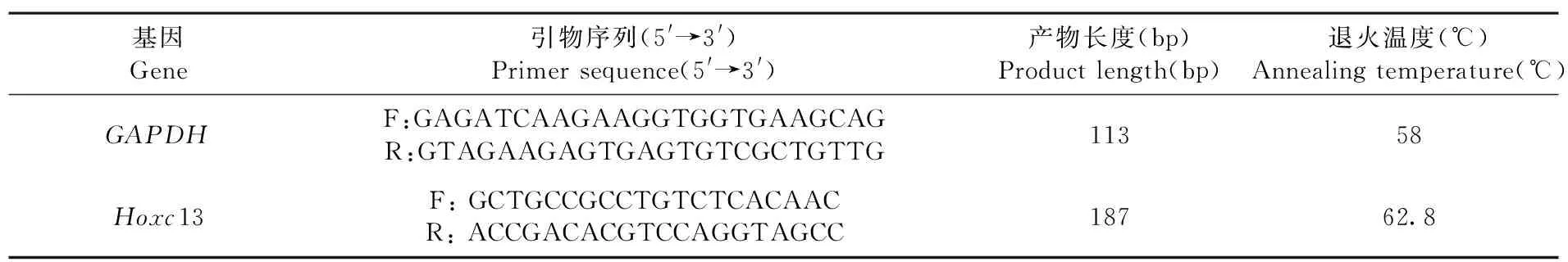
基因Gene引物序列(5'→3')Primer sequence(5'→3')产物长度(bp)Product length(bp)退火温度(℃)Annealing temperature(℃)GAPDHF:GAGATCAAGAAGGTGGTGAAGCAGR:GTAGAAGAGTGAGTGTCGCTGTTG11358Hoxc13F: GCTGCCGCCTGTCTCACAACR: ACCGACACGTCCAGGTAGCC18762.8
注:F:代表上游引物 R:代表下游引物
1.2.2 苏博美利奴羊不同组织RNA的提取及检测
(1)取细毛羊的皮肤及六种不同组织50~100 mg样品置于研钵中,分别在液氮中快速研磨成碎末状;
(2)分别在2 mL离心管中添加1 mL Trizol试剂,再用在液氮中预冷的小勺将研钵中的组织碎末刮出,并将其加入离心管中涡旋混匀,室温放置5 min;
(3)将离心管放入低温离心机中12 000 r/min,4℃,离心10 min,取新的2 mL离心管向其中加入200 μL氯仿,将离心后的上清液取出移入离心管中,剧烈摇动15 s后室温放置3 min;
(4)低温离心机中12 000 r/min,4℃,离心15 min,另取一新的1.5 mL离心管,将溶有RNA的上层上清液(约500 μL)转移至其中;
(5)添加500 μL(等体积)异丙醇于装有取出的上清液的离心管中,漩涡混匀,室温放置30 min;
(6)低温离心机中12 000 r/min,4℃,离心10 min,弃上清,在剩下的沉淀物中加入1 mL 75%的乙醇洗涤;
(7)低温离心机中8 000 r/min,4℃,离心5 min,去乙醇,将残留的少量液体瞬时离心后用移液枪小心吸出,室温放置5 min;
(8)添加适量DEPC水(30~50 μL),根据提取出的RNA沉淀量的多少选择,涡旋混匀,使其充分溶解RNA;
(9)分装出3 μL提取出的RNA溶液,用于RNA的纯度检测,剩余提取出的RNA溶液于-80℃冰箱中保存;
(10)纯度检测:先用ddH2O将微量分光光度计调零,再取2 μL RNA提取物测定其纯度,检测要求OD260/OD280的数值在1.8~2.0。
1.2.3 反转录合成cDNA
(1)将样本RNA于冰盒上解冻,反转录试剂盒于室温解冻;
(2)用微量分光光度计检测样本RNA浓度,记录并计算所需RNA以及RNase-free ddH2O的使用量;
(3)按表3成分于冰盒上配置反应步骤一体系混合液1,然后分装到每个PCR管中,最后加入RNA样品;表3
(4)将装有配置好的混合液1的PCR管放入普通PCR仪中42℃ 2 min;
(5)按表4成分于冰盒上配置反应步骤二体系混合液2;
(6)取出PCR管,分别向装有混合液1的PCR管中分装10 μL混合液2;
表3 反应步骤一体系
Table 3 Reaction Step 1: System

试剂Reagent使用量Usage amountgDNA Eraser5X gDNA Eraser BufferRNase-free ddH2ORNA模板1 μL2 μL补至10 μL1 μL
(7)轻柔混匀,放入PCR仪中37℃ 15 min,85℃ 5 s,4℃保存,反应结束后取出反应管置于-20℃冰箱储存。表4
表4 反应步骤二体系
Table 4 Reaction Step II: System

试剂Reagent使用量Usage amountPrimeScript RT Enzyme MixⅠ5X PrimeScript Buffer 2 (for Real Time)RT Primer MixRNase-free ddH2O1 μL4 μL1 μL4 μL
1.2.4 荧光定量PCR反应体系的建立
所有提取出的样品RNA都用内参引物GAPDH扩增,再分别用相对应的Hoxc13基因引物做3个平行样本进行扩增,并与内参引物扩增的片段长度进行对比。具体的试验操作流程按照产品的说明书实施。
(1)配置Real Time反应体系。表5
表5 PCR反应体系
Table 5 PCR reaction system

组成成分Composition体积VolumecDNA模板SYBR上游引物下游引物RNase-free ddH2O1 μL12.5 μL0.5 μL0.5 μL10.5 μL
(2)在Bio-Rad公司的CFX96实时荧光定量PCR仪上建立反应程序。表6
(3)荧光定量PCR产物检测:取5 μL的荧光定量PCR产物与1 μL的6×Loading buffer充分混匀,在110 V条件下2%琼脂糖凝胶电泳20 min进行检测,产物片段的大小以DL2000为Marker来标记。
表6 荧光定量PCR反应程序
Table 6 Fluorescence quantitative PCR reaction procedure

反应程序Reaction procedure温度Temperature时间Time预变性变性退火延伸(收集荧光)95℃95℃62.8℃95℃30 s5 s30 s5 s 循环40次
1.3 数据处理
使用软件SPSS19.0进行组间差异显著性分析,使用Excel软件对内参基因及目的基因的相对表达水平进行统计分析,每个分析对象都采用3次重复试验数据的平均值。
相对定量分析2-△△Ct公式:
ΔCt= 目的基因平均Ct-内参基因平均Ct
(1)
ΔΔCt=ΔCt(待测样本)-ΔCt(对照样本)
(2)
F= 2-△△Ct
(3)
Ct值:每个反应荧光信号达到设定阈值所经历的循环数。

图1Hoxc13基因经琼脂糖凝胶电泳检测
Fig.1Hoxc13 gene detected by agarose gel electrophoresis
2 结果与分析
2.1 实时荧光定量PCR
2.1.1 实时荧光定量PCR扩增产物的检测
用美国Thermo公司的NanoDrop 2000微量分光光度计对从苏博美利奴羊各组织器官中提取出的RNA进行纯度检测,经检测OD260/OD280读数在1.8~2.0,说明所提取出的RNA纯度高,可以用作后续的试验;使用2%的琼脂糖进行凝胶电泳检测,结果表明,Hoxc13基因经琼脂糖电泳检测,结果显示与预期的扩增片段大小一致,无非特异性条带,可用于后续的试验。图1
2.1.2 熔解曲线
将试验反应体系中目的基因Hoxc13和内参基因GAPDH的扩增曲线和熔解曲线进行分析,研究表明,扩增前期曲线重合性好并且为单一峰,曲线为S型荧光定量动力学曲线,为理想型扩增曲线。熔解曲线分析结果表明,GAPDH和Hoxc13基因的熔解温度分别近似为84和81℃;各基因熔解曲线均只有一个特异峰,未出现引物二聚体,说明GAPDH基因及Hoxc13基因的特异性好,PCR反应条件得到了较好的优化。图2,图3

图2 不同组织GAPDH基因荧光定量PCR扩增及熔解曲线
Fig.2 Fluorescence quantitative PCR amplification and melting curve ofGAPDHgene in different tissues

图3 不同组织Hoxc13基因荧光定量PCR扩增及熔解曲线
Fig.3 Fluorescence quantitative PCR amplification and melting curve of different tissues ofHoxc13 gene
2.2 不同组织不同时期中Hoxc13基因的表达量
在定量检测试验中,内参基因是GAPDH,运用SYBR Green Ⅱ染料实时荧光定量PCR的方法来进行验证。试验采用相对定量法,以GAPDH基因作为内参基因,对苏博美利奴羊胎龄在65和135 d两个时期,各三只羊的皮肤和六种不同组织(肌肉、心脏、脾脏、肝脏、肺脏、肾脏)中,Hoxc13基因mRNA的表达量进行了分析。图4
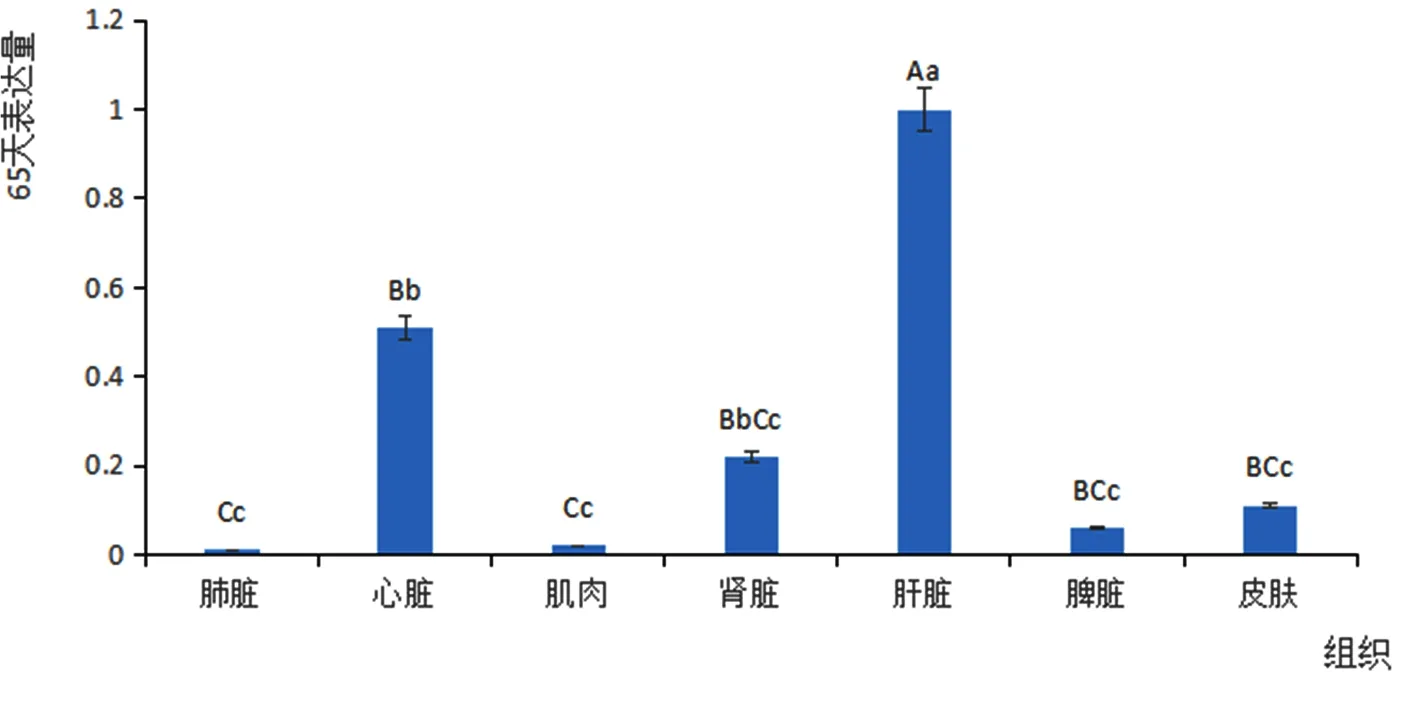
图4Hoxc13基因在65 d不同组织中的表达量
Fig.4 Expression of Hoxc13 gene in different tissues at 65 days
2.2.1Hoxc13基因65 d各组织中的表达量
研究表明,选择ΔCt值最小的组织(肝脏)为参照。苏博美利奴羊在胎龄65 d时Hoxc13基因的相对表达量在各组织器官中差异极显著,在肝脏中的表达量极显著高于在其它各组织和皮肤中的表达量(P< 0.01),在皮肤、心脏、肾脏和脾脏中的表达量显著高于在肺脏和肌肉组织中的表达量(P< 0.05)。
2.2.2Hoxc13基因135 d各组织中的表达量
研究表明,苏博美利奴羊在胎龄135 d时Hoxc13基因在皮肤和各组织中的相对表达量有显著差异,在皮肤中的表达量显著高于在肌肉、心脏、脾脏、肝脏、肺脏、肾脏组织中的表达量(P< 0.05)。Hoxc13基因在135 d胎龄的苏博美利奴羊的各组织器官中均有表达,并且在皮肤中最高。图5
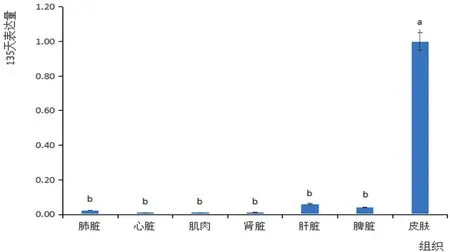
图5Hoxc13基因在135 d不同组织中的表达量
Fig.5 Expression ofHoxc13 gene in different tissues at 135 days
2.2.3 不同时期中Hoxc13基因的表达量分析
在胎龄65和135 d这两个时期,以65 d这一时期作为参照,分析135 d皮肤和各组织中Hoxc13基因的相对表达量,胎龄在135 d时期较65 d这一期,Hoxc13基因在皮肤中的表达量显著高于在肌肉、心脏、脾脏、肝脏、肺脏、肾脏组织中的表达量(P< 0.05),Hoxc13基因与毛囊发育密切相关。图6

图6Hoxc13基因在不同时期不同组织中的表达量
Fig.6 Expression ofHoxc13 gene in different tissues at different times
3 讨 论
3.1 RT-PCR分析
RT-PCR技术是一种对不同样品间,基因的差异表达水平进行比较及测定的权威性方法,哈尼克孜·吐拉甫等[15]做了分子遗传标记在绵羊育种中的研究;田月珍等[16]对中国美利奴羊(新疆型)皮肤组织建立了GAPDH基因RT-PCR方法。内参基因选用GAPDH基因,不但对细微表达差异的生物学研究具有重要意义,还有助于校正系统误差,得到更为准确可靠的结果[17]。试验的RT-PCR结果表明,实时荧光定量PCR法可用于苏博美利奴羊不同组织器官中Hoxc13基因表达差异的测定。
3.2 Hoxc13基因在不同组织中的表达
柳楠等[18]在Hox基因家族对细毛羊羊毛性状影响的研究中表明,Hoxc13基因与毛囊的生长发育与分布有关,其mRNA表达强度与羊毛长度存在显著的正相关,并影响羊毛物理性状。试验的实时荧光定量PCR结果显示Hoxc13基因在苏博美利奴羊的皮肤和不同组织(肌肉、心脏、脾脏、肝脏、肺脏、肾脏)中均有表达,且存在差异性。在胎龄65 d时期,Hoxc13基因的相对表达量在各组织器官中差异极显著,在肝脏中的相对表达量最高,其次是心脏、肾脏、皮肤和脾脏组织,在肺脏和肌肉组织中相对表达量最低。在胎龄135 d时期,Hoxc13基因在各组织器官中均有表达,其相对表达量在皮肤中显著高于在肌肉及各内脏组织中的表达量,在各组织间的相对表达量无显著差异。
3.3 Hoxc13基因在不同时期中的表达
对比胎龄在65和135 d两个时期Hoxc13基因在不同组织中的相对表达量,实时荧光定量PCR结果显示,在苏博美利奴羊不同组织和皮肤中均有Hoxc13基因的表达。毛囊的发育始于胚胎期皮肤,阿布来提·苏来曼等[19]对苏博美利奴羊胎儿皮肤毛囊结构及形态发育做了相关研究,研究结果表明,苏博美利奴羊胚胎形成初级毛囊的重要时期是胎龄65~75 d;次级毛囊形成期是胎龄80~85 d;次级毛囊的大量再分化是胎龄105~135 d。试验结果表明,Hoxc13基因广泛表达于苏博美利奴羊各组织器官中,并且其相对表达量在苏博美利奴羊皮肤中最高,推测该基因在皮肤中的表达有重要意义,这与Hoxc13基因的表达水平对毛发生长和毛囊发育影响显著的研究相符[20]。
4 结 论
Hoxc13基因在苏博美利奴羊各组织器官中均有表达且存在表达差异;并且在皮肤中Hoxc13基因的表达量高于在肌肉、肾脏、心脏、脾脏、肺脏和肝脏组织,Hoxc13基因可能与毛囊发育的过程密切相关。
