miR-129通过抑制T细胞因子4的表达影响肺癌A549细胞的上皮间质转化
2019-08-14金灿灿邵世和
金灿灿,邵世和
(江苏大学医学院,江苏镇江212013)
近年来,肺癌的发病率及致死率逐年上升,已成为恶性肿瘤中的“头号杀手”。尽管目前手术、放疗、化疗、分子靶向治疗、免疫治疗等治疗手段不断丰富,但肺癌5年生存率仍较低。肺癌的发生发展是一个涉及多分子靶点、多信号通路调控的过程,其发病机制尚未明确[1]。当前,研究重要的分子调控元件及相关信号通路,可为肺癌的发病机制研究提供有力证据。miRNA作为重要的转录后分子调控因子,参与调控多种生理病理过程。miRNA广泛存在于动植物的基因组中,本身十分保守,大部分通过与靶基因的3’端非转录区碱基配对的方式来执行对靶基因的切割或抑制翻译的功能,进一步参与到包括肿瘤在内的多种疾病过程[2]。miR-129在细胞生长、发育、癌变等生命过程中发挥重要的生物学作用,在胃癌[3]、乳腺癌[4]、肝癌[5]、甲状腺癌[6]等常见肿瘤中存在明显的差异表达。T细胞因子4(T-cell transcription factor-4,TCF4)作为核内转录辅助因子,其本身不能决定基因表达的开启,与之结合的其他转录激活蛋白决定了它所调节的靶基因的表达状态。TCF4参与诸多肿瘤的发生与发展进程,有望成为肿瘤基因治疗的一个新靶点[7]。本课题组前期研究发现,miR-129在人肺腺癌组织中较癌旁组织表达明显减少,证实miR-129可抑制肺腺癌的发生发展,但相关的作用机制目前尚未明确。后期我们通过生物信息学方法发现miR-129存在多个TCF4 3’UTR端的结合位点,提示TCF4可能是miR-129的靶基因,初步指向miR-129可能通过作用于TCF4,进而调控相关下游信号通路,影响肺癌的发生发展。本研究旨在探讨miR-129抑制肺腺癌细胞A549的作用机制。
1 材料与方法
1.1 细胞系、试剂及仪器
肺腺癌细胞系A549(中国科学院上海细胞生物学研究所细胞库);DMEM培养基、胎牛血清、PBS缓冲液(美国Hyclone公司);CO2培养箱(美国Thermo Forma Scientific公司);Opti-MEM培养基(美国Gibco公司);转染试剂Lipofectamine 2000(美国Invitrogen公司);TRIzol、RT-PCR试剂盒、SYBR Green PCR试剂盒(TaKaRa公司);miR-129、TCF4、E-钙黏蛋白、波形蛋白、β-肌动蛋白引物(上海英骏公司);BCA试剂盒(碧云天公司);Tween-20(AMRECO公司);PVDF膜(Amersham Biosciences公司);半干转膜仪(Bio-Rad公司);预染蛋白标志物(Fermentas公司);兔抗大鼠E-钙黏蛋白单克隆抗体(BD公司);兔抗大鼠波形蛋白单克隆抗体(DAKO公司);兔抗大鼠TCF4单克隆抗体(CST公司);兔抗大鼠GAPDH单克隆抗体(Sigma公司);7500 Fast荧光定量PCR仪(美国ABI公司);全自动凝胶成像仪(北京赛智公司);ND-1000UV微量紫外分光光度计(美国Nanodrop公司)。
miR-129mimic和对照引物序列由上海吉玛公司合成,miR-129 mimic引物上游:5′-CUUUUUGCGGUCUGGGCUUUGC-3′,下游:5′-AAGCCCAGACCGCAAAAAGUU-3′;无关序列引物上游:5′-UUCUCCGAACGUGUCACGUTT-3′,下游:5′-ACGUGACACGUUCGGAGAATT-3′。
1.2 细胞培养和细胞转染
用含10%胎牛血清的DMEM培养液培养A549细胞,置培养箱,常规培养、传代。实验设阴性对照组(无关序列)、miR-129 mimic组。每组各设3个复孔。将A549细胞用0.1%胰酶消化液消化,含2%胎牛血清的DMEM培养液终止消化。细胞计数仪计数细胞,配成8×105/mL细胞悬液,分别接种于6孔培养板,1.5 mL/孔。用250μL不含血清培养基Opti-MEM分别稀释100 pmol miR-129 mimic及5μL脂质体2000;手指轻弹管壁轻轻混匀并室温孵育5 min后,将两种混合液再次轻轻混匀,室温孵育20 min。将miR-129 mimic-lipo2000混合液加入含有细胞的培养板,置于37℃的CO2培养箱中培养,6 h后更换含2%胎牛血清的DMEM新鲜培养基。
1.3 实时定量PCR检测miR-129 mimic的转染效率及TCF4、E-钙黏蛋白、波形蛋白的mRNA表达水平
将转染48 h后的细胞培养基中的培养液吸干,PBS洗涤2次,用Trizol裂解细胞,抽提 RNA,用紫外分光光度仪测定260 nm/280 nm的光密度(D)值,测定RNA浓度。按反转录试剂盒的反转录体系及反应时间将RNA反转录为cDNA,并以cDNA为模板进行PCR扩增引物。引物由上海英骏公司设计并合成,以U6/GAPDH作为内参,实验设3个复孔,并重复3次。PCR反应体系(10μL)包括SYBR Premix ExTaqTM5.0μL、DNA模版 1.0μL、ddH2O 3.6μL、PCR上下游引物(10μmol/L)各 0.2μL。反应条件为94℃预变性30 s,94℃10 s,60℃30 s,共进行40个循环,进行溶解曲线的检测,并进行数据分析。本实验至少重复3次。
1.4 蛋白质印迹检测TCF4、E-钙黏蛋白、波形蛋白的蛋白表达
将转染48 h后的细胞培养基中的培养液吸干,PBS洗涤2次,按1 mL裂解液加10μL PMSF(100 mmol/L),使蛋白充分裂解(整个操作尽量在冰上进行),将裂解好的蛋白在沸水中煮15 min,于4℃下12 000 r/min离心15 min,将离心后的上清液分装转移到1.5 mL的离心管中,置于-80℃保存。根据蛋白定量试剂盒要求定量蛋白,用酶标仪检测D值,绘制标准曲线,计算蛋白质浓度。提取定量后的蛋白,各取40μg行10%SDS-PAGE分离蛋白,电压为80 V,待溴酚蓝显示于下层胶后将电压调至120 V,适时终止电泳。电转移至PVDF膜(250 mA,70 min)。50 g/L脱脂牛奶封闭2 h,分别加入相应的一抗(TCF4、E-钙黏蛋白、波形蛋白抗体稀释比均为1∶1 000),4℃孵育过夜;1×TBST洗膜3次,每次10 min,加入相应的二抗孵育1 h,1×TBST洗膜3次;用自动曝光仪获得图像。重复3次。
1.5 miR-129 mimic和TCF4 3′-UTR报告基因质粒共转染
种植HEK-293细胞至24孔板,1.5×105/孔,培养24 h;用脂质体2000将无关序列(阴性对照组)和miR-129 mimic(miR-129 mimic组)分别转染HEK-293细胞,RNA∶脂质体=1.5μL∶1μL,采用含5%胎牛血清的DMEM培养液培养;10 h后换相同浓度培养液,用脂质体2000将TCF4 3′-UTR报告基因质粒转入HEK-293细胞,质粒DNA∶脂质体=400 ng∶1μL,转染过夜。
1.6 Promega双报告基因试剂盒检测报告基因信号
每孔加入胰酶100μL消化细胞后,加入600μL含5%胎牛血清DMEM培养液终止消化,将细胞收集到1.5 mL离心管;1 200 r/min离心4 min,吸除上层650μL培养液后重悬细胞;吸取细胞悬液15μL/孔(×3复孔)加入384孔板;每孔中加入Promega双报告基因试剂盒Ⅰ15μL,混匀;避光放置10 min,酶标仪检测;每孔中加入Promega双报告基因试剂盒Ⅱ15μL,混匀;避光放置10 min,酶标仪检测。
1.7 统计学分析
应用SPSS 22.0统计软件进行统计学分析。计量数据以均数±标准差表示,配对资料采用配对t检验,P<0.05为差异有统计学意义。采用Graphpad Prism 6.0软件制作图表。
2 结果
2.1 miR-129 mimic的转染效率
miR-129mimic转染肺腺癌细胞系A549后,光镜下可见腺癌细胞向梭形细胞形态转化速度减缓(图1);实时定量PCR检测结果显示,miR-129表达明显上调约339.24倍(t=0.098 4,P<0.01)。见图2。
图1 miR-129 mimic转染后的A549细胞形态(光学显微镜×400)
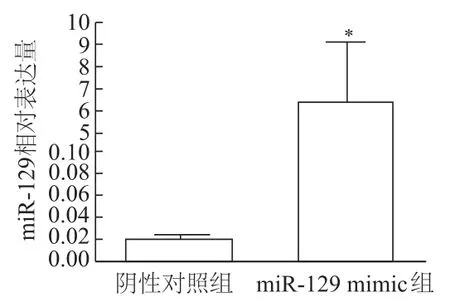
图2 实时定量PCR检测miR-129 mimic的转染效率
2.2 miR-129 mimic转染后A549细胞TCF4及E-钙黏蛋白、波形蛋白的表达
实时定量PCR检测结果显示,miR-129 mimic转染后,A549细胞miR-129靶基因TCF4 mRNA表达较阴性对照组下调约53.07%(t=0.979,P<0.05),E-钙黏蛋白mRNA表达上调约6.09倍(t=0.998,P<0.01),波形蛋白 mRNA表达下调约41.15%(t=0.000 4,P<0.01),差异均有统计学意义(图3)。
蛋白质印迹结果显示,miR-129 mimic转染肺腺癌细胞系A549后,TCF4和波形蛋白的蛋白表达下调,E-钙黏蛋白表达上调(图4)。
2.3 验证miR-129对TCF4 3′-UTR的靶向调控作用
生物信息学分析(targetscan网站)显示miR-129与TCF4存在相互结合位点(图5);将miR-129 mimic与TCF4 3′-UTR报告基因质粒共转染HEK-293细胞,结果显示miR-129表达上调后,TCF4报告基因质粒荧光素酶活性明显降低(t=0.845,P<0.01)。见图6。

图3 实时定量PCR检测TCF4、E-钙黏蛋白和波形蛋白的m RNA表达

图4 蛋白质印迹检测TCF4、E-钙黏蛋白和波形蛋白的表达

图5 miR-129与TCF4存在相互结合位点

图6 TCF4报告基因质粒荧光素酶活性检测
3 讨论
在恶性肿瘤的发展初期,肿瘤细胞可分泌基质降解酶等有害物质破坏基底膜,进而发生形态学改变,即上皮间质转化(epithelial-mesenchymal transition,EMT)[8-10]。进一步,恶性肿瘤细胞在发生转移前及转移时也会在相应微环境的改变下发生EMT[11]。此时,肿瘤细胞不仅会发生形态学的改变,更重要的是在各种分子调控元件及信号通路的调控下,发生一系列上皮、间质分子及其转录因子的表达改变,导致肿瘤细胞的迁移和侵袭能力增强及新的转移瘤的形成[12-15]。研究表明,miR-129可通过抑制PDPK1的表达抑制人管状上皮细胞的EMT[16],也可通过抑制 H3K27m3的表达影响乳腺癌的EMT进程[17]。本研究结果显示,上调miR-129的表达可以使肺腺癌细胞E-钙黏蛋白的表达增加、波形蛋白的表达降低,提示miR-129可阻遏A549细胞EMT进程。
TCF4是EMT进程中重要的转录因子,能促进肿瘤的侵袭能力[18-19]。本研究结果表明上调miR-129的表达可以使TCF4的mRNA水平及蛋白表达明显下调。我们进一步利用miR-129 mimic与TCF4 3′-UTR报告基因质粒共转染HEK-293细胞,结果显示TCF4报告基因质粒荧光素酶活性降低,证实TCF4为miR-129沉默的靶基因。因此,miR-129可能是通过抑制TCF4表达,进而抑制EMT进程及肺腺癌的发生发展。
综上所述,本研究结果显示,miR-129可能通过抑制TCF4表达阻遏A549细胞的EMT进程,进而抑制肺腺癌的发生发展。
