莫诺苷对小鼠T细胞体外活化与分化的影响
2019-08-14吴仪仇欣张燕周婧文李慈赵传祥高凤威刘烁姚雪夏圣
吴仪,仇欣,张燕,周婧文,李慈,赵传祥,高凤威,刘烁,姚雪,夏圣
(江苏大学医学院,江苏镇江212013)
植物山茱萸属(Cornus)根据地理分布和形态学等可以细分为65种[1],大约在2 200年前,中草药山茱萸(Cornus officinalis Sieb.et Zucc)就被记录在《神农本草》中[2],其与中药板蓝根有相似的植物来源,具有抗炎、抗高血压以及增强免疫系统的功能[3]。研究表明,属于环烯醚萜苷类的莫诺苷和马钱苷是中草药山茱萸中主要的活性物质[4]。研究表明莫诺苷可以调控细胞Wnt/β-连环蛋白信号通路,而Wnt信号通路参与细胞增殖和不对称细胞分裂的控制等[5]。因此,通过调控Wnt信号通路,莫诺苷具有防脱发[6]、抗心肌细胞凋亡[7]、促进细胞增殖、组织再生等广泛的药理作用。但是,目前这些研究大多局限于成骨细胞[8]、心肌细胞等组织细胞。
T细胞在发育、分化成熟的过程中伴随着细胞增殖、归巢等事件,Wnt信号在其中扮演着重要的角色。特异性敲除T细胞中β-连环蛋白,可导致其发育过程中细胞表面受体前体形成受损,细胞发育障碍[9]。但有关莫诺苷是否也会通过Wnt信号通路影响T细胞分化,尚不清楚。因此,本实验中拟利用莫诺苷与抗原受体信号活化的T细胞共培养,探讨山茱萸提取物莫诺苷对T细胞功能的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物 SPF清洁级C57BL/6小鼠(JAX 000664),同窝雌性,6~12周龄,体质量18~22 g,购自江苏大学动物中心,合格证编号:No.201907363。
1.1.2 主要试剂 山茱萸莫诺苷提取物(成都普瑞法公司);RPMI-1640培养基、胎牛血清(美国Gibco公司);48、96孔细胞培养板(丹麦 Nunc公司);总RNA提取试剂Trizol、反转录试剂盒、SYBR Green荧光染料(日本TaKaRa公司);总蛋白提取RIPA裂解液、牛血清白蛋白(上海碧云天公司);AnnexinV、Th1、Th2流式细胞检测试剂盒、IL-4试剂盒、TGF-βELISA试剂盒、抗小鼠IgG-HRP抗体、小鼠内参蛋白-HRP(杭州联科公司);IFN-γELISA试剂盒、BCA试剂盒、蛋白指示条带(美国Thermo公司);红细胞裂解液、细胞刺激阻断剂、功能性抗CD3抗体、功能性抗CD28抗体、抗小鼠Ki67 PercPCy5.5、抗小鼠CD25 PE、抗小鼠CD69 FITC、抗小鼠Foxp3 APC(美国 eBioscience公司);抗小鼠CD4 APC、抗小鼠CD8 APC、抗小鼠CD4 PE(美国Biolegend公司);小鼠β-连环蛋白抗体(美国CST公司);Tbx21、Gata3、淋巴样增强因子 1(lymphoid enhance factor 1,LEF1)引物序列由上海生物工程公司合成。
1.1.3 主要仪器 超净工作台(苏州净化厂);细胞培养箱(美国Thermo公司);蛋白质免疫印迹系列设备、PCR仪、CFX96定量PCR仪(美国Bio-Rad公司);倒置式生物显微镜(日本Nikon公司);BD FACSCanto10C流式细胞仪(美国BD公司)。
1.2 小鼠脾脏淋巴细胞单细胞悬液的制备与计数
取适龄雌性C57BL/6小鼠,采用断颈法处死,用手术剪和弯镊无菌分离脾脏;置于预冷PBS中,将其剪碎至细小颗粒状;并于300目筛网上过滤至无明显红色,即获得脾脏单细胞悬液。将所获悬液于4℃行1 000 r/min离心5 min,弃上清液;加入4 mL红细胞裂解液,混匀,室温静置10 min;加入3倍体积的PBS终止反应;按上述条件再次离心、弃上清液;最后用1 mL含10%胎牛血清的RPMI-1640培养基重悬。用改良牛鲍氏计数板进行细胞计数后备用。
1.3 T细胞的活化及分组
抗CD3抗体包被:用无菌PBS将功能性抗CD3抗体原液(1 mg/mL)稀释至5μg/mL,48孔板每孔加入200μL(96孔板每孔加入100μL),4℃包被过夜(>12 h);弃板中液体,预冷无菌PBS洗涤2遍;接种“1.2”中脾脏混合淋巴细胞,1×106/孔;用含10%胎牛血清的RPMI-1640培养基补至400μL/孔(96孔板补至200μL/孔);加入功能性抗CD28抗体原液(1 mg/mL),计算加入体积,保证终浓度为2μg/mL。铺板完成后,将细胞分为2组,对照组和莫诺苷组。对照组不做任何处理培养96 h;莫诺苷组加入终浓度为10μmol/L的莫诺苷,于37℃、5%CO2条件下培养48 h;再次加入10μmol/L莫诺苷,继续培养48 h;收集细胞进行后续实验。
用于流式细胞术检测T细胞亚群的细胞,需要在实验前加入1×细胞刺激阻断剂(原液500×)处理4~5 h,再收集检测。
1.4 流式细胞术检测T细胞活化、凋亡、增殖和分化的相应标志
收集“1.3”中T细胞,加入适量PBS洗涤2次;于4℃行1 000 r/min离心5 min;弃上清液,加入相应检测不同表面标志的荧光抗体,1μL/管,4℃避光孵育30 min;PBS洗去游离抗体,加入适量PBS重悬细胞。用流式分析仪检测对照组和莫诺苷组细胞相应表面荧光信号。
用于凋亡、增殖和细胞亚群检测的细胞需在上述表面标志染好后,按照试剂盒说明书再加入相应破核、破膜试剂和荧光抗体,最后用相应缓冲液重悬细胞,用流式分析仪检测细胞比例。
1.5 蛋白质印迹检测T细胞中β-连环蛋白表达
收集“1.3”中2组T细胞,于4℃行1 000 r/min离心5 min;弃培养基,用PBS洗2遍;加入RIPA裂解液提取蛋白;用BCA试剂盒检测蛋白浓度;行10%SDS-PAGE分离蛋白;120 V湿转2 h,将所有目的蛋白和内参条带转至PVDF膜;5%牛血清白蛋白封闭1 h;剪下对应分子量的条带,分别加入目的蛋白小鼠β-连环蛋白(1∶1 000)和内参蛋白抗体(1∶10 000),4℃孵育过夜;次日用TBST洗涤条带3次,每次10 min;内参蛋白携带HRP基团可以直接进行暗室曝光,而 β-连环蛋白则需加入1∶10 000稀释的抗小鼠IgG-HRP,室温孵育1 h;TBST洗涤3次,每次10 min,行暗室曝光显影。
1.6 ELISA检测T细胞培养上清液中相关细胞因子的水平
收集“1.3”中2组T细胞上清液,按照ELISA试剂盒说明书的要求,分别检测上清液中IFN-γ、IL-4和TGF-β的含量。
1.7 qRT-PCR检测T细胞转录因子mRNA表达
收集“1.3”中2组T细胞,加入预冷PBS洗2遍;分别加入1 mL Trizol提取总RNA,按照反转录试剂盒说明书,将500 ng mRNA反转录为cDNA。以β-肌动蛋白为内参,cDNA为模板,定量检测Th1、Th2转录启动子Tbx21、Gata3和Wnt信号通路下游分子LEF1 mRNA水平。小鼠内参β-肌动蛋白序列:上游5′-TGGCGCTTTTGACTCAGGAT-3′,下游5′-GGGATGTTTGCTCCAACCAA-3′;小鼠Tbx21序列:上游5′-TGTGGATGTGGTCTTGGTGG-3′,下游5′-ATAAGCGGTTCCCTGGCAT-3′;小鼠Gata3序列:上游5′-GTCATCCCTGAGCCACATCT-3′,下游5′-AGGGCTCTGCCTCTCTAACC-3′;小鼠LEF1序列:上游5′-TCACTGTCAGGCGACACTTC-3′,下游5′-TGAGGCTTCACGTGCATTAG-3′;qRT-PCR反应体系:SYBR Green 5μL、双蒸水3.6μL、上下游引物各0.2μL、cDNA 1μL,总反应体系 10μL。扩增条件为95℃ 5 s,57.8℃ 20 s(LEF1为56.5℃),72℃ 30 s,39次循环,用 2-ΔΔCT法计算相关基因表达。
1.8 统计学分析
流式实验数据采用Flowjo 10.0进行分析处理,其他实验数据采用GraphPad Prism 5.0软件处理,各组样本n均≥3,采用配对样本t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 莫诺苷对T细胞增殖和活化的影响
如图1所示,莫诺苷组与对照组细胞镜下均可见细胞活化形成的集落,但集落大小和数量无显著差异。莫诺苷组CD4+T细胞和CD8+T细胞增殖较对照组均有所上调,但差异无统计学意义(图2)。由图3可见,对照组和莫诺苷组间T细胞早期活化标志 CD69无明显差异,但莫诺苷组 CD4+T和CD8+T细胞的晚期活化标志CD25荧光强度较对照组显著增强(t=4.214,P=0.006;t=2.521,P=0.045)。
图1 显微镜下观察小鼠脾脏源T细胞形态
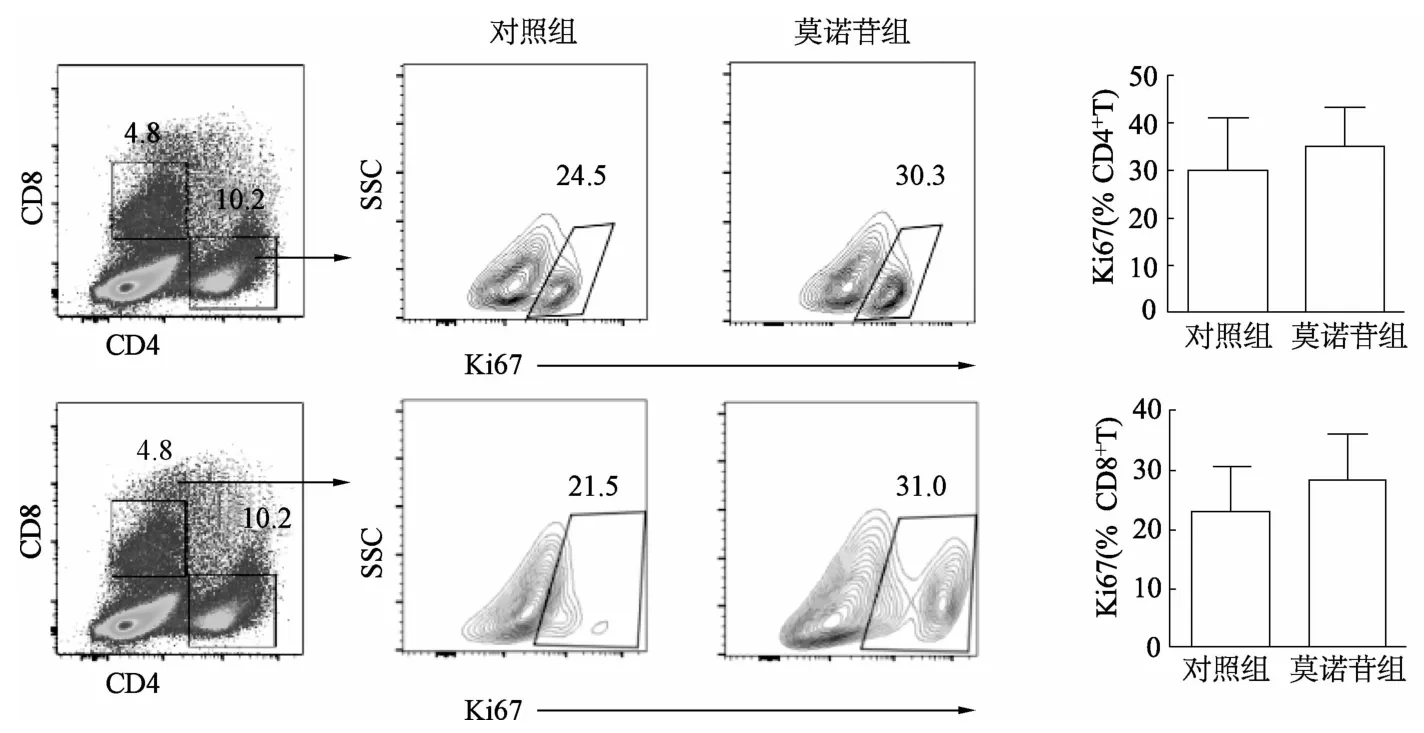
图2 流式细胞术分析小鼠CD4+T和CD8+T细胞的增殖比例

图3 流式细胞术分析各组小鼠CD4+T和CD8+T细胞的活化情况
2.2 莫诺苷对T细胞凋亡的影响
与对照组相比,莫诺苷组CD4+AnnexinV+和CD8+AnnexinV+细胞比例降低,但差异无统计学意义(t=0.470,P=0.655;t=0.215,P=0.841)。见图4。
2.3 莫诺苷对CD4+T细胞亚群体外分化的影响
与对照组相比,莫诺苷组T细胞分化功能明显增强,分化的Th1、Th2和Treg亚群比例和细胞数均明显升高(P均<0.05)。见图5。
2.4 莫诺苷对T细胞活化转录因子和细胞因子分泌水平的影响
如图6所示,与对照组相比,莫诺苷组Th1和Th2细胞发育的转录起始因子Tbx21 mRNA和Gata3 mRNA表达量均显著增加(t=3.47,P=0.040;t=14.78,P=0.005)。与对照组相比,莫诺苷组T细胞分泌的IL-4水平明显增加(t=3.402,P=0.009),但 IFN-γ水平差异无统计学意义。见图7。
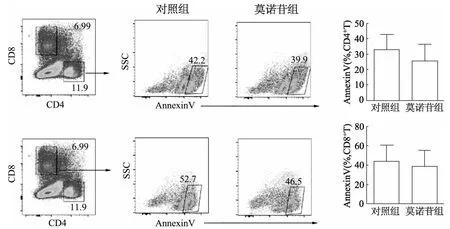
图4 流式细胞术分析各组小鼠脾脏CD4+和CD8+T细胞的凋亡比例

图5 流式细胞术分析各组小鼠脾脏T细胞分化为Th1、Th2和Th17的情况
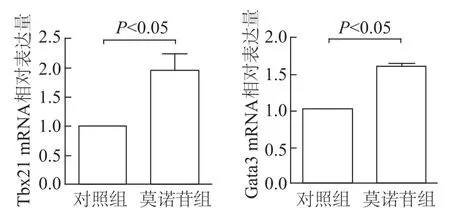
图6 qRT-PCR法检测各组小鼠脾脏T细胞Tbx21 m RNA和Gata3 m RNA的表达

图7 ELISA法检测两组T细胞IFN-γ和IL-4水平
2.5 莫诺苷对T细胞Wnt信号通路的影响
与对照组相比,莫诺苷组T细胞β-连环蛋白相对表达量明显增加(t=16.47,P=0.004);LEF1 mRNA表达水平增强(t=2.605,P=0.048);同时细胞因子TGF-β表达水平显著上调(t=2.664,P=0.029)。见图8和图9。
3 讨论

图8 蛋白质免疫印迹检测各组小鼠脾脏T细胞β-连环蛋白水平
中国传统医学因其在慢性疾病中突出的优势、稳定的疗效且较西药毒性低,受到了越来越多的关注[10]。山茱萸活性物质莫诺苷可通过调控Wnt信号通路,具有治疗糖尿病[11]、抗炎镇痛[12]等作用。Wnt信号通路主要由4条通路构成:β-连环蛋白、T细胞因子/淋巴细胞-增强子-结合因子通路、细胞极性通路和Wnt-Ca2+通路[13]。已有文献表明,Wnt信号通路对于T细胞的发育也必不可少[14]。因此本研究通过实验设计,在小鼠脾脏来源的T细胞中加入功能性CD3/CD28抗体,体外诱导T细胞活化、增殖和分化以评估山茱萸提取物莫诺苷是否能够通过调控Wnt信号影响T细胞功能。
根据前期关于莫诺苷研究的文献结果[15],本实验选择莫诺苷的处理浓度为5μmol/L和10μmol/L。在预实验过程中,我们发现5μmol/L对于T细胞作用并不明显,所以最终确定使用10μmol/L莫诺苷进行后续实验。本实验结果表明,与对照组相比,莫诺苷组T细胞中,Wnt信号通路下游分子β-连环蛋白和LEF1 mRNA表达量上调,活化的Wnt通路诱导细胞因子TGF-β分泌量增加,Treg细胞比例增加。同时莫诺苷组T细胞晚期活化标志CD25表达增加,T细胞分化为Th1、Th2功能增强,而转录起始因子Tbx21、Gata3等mRNA水平和细胞因子IL-4分泌增加也验证T细胞分化能力增强。Wnt家族中Wnt5a能够通过上调IL-12分泌从而促进Th1细胞的表达[16],但又有研究表明,Wnt信号通路中 T细胞因子能够通过诱导Gata3表达,从而促进T细胞向Th2细胞分化[17]。由于Wnt信号通路的不同下游分子活化后本身就具有促进炎症发生或者抑制炎症反应的不同作用,这就可以解释本实验结果,加入莫诺苷后,多种Wnt信号通路下游分子被激活,导致Th1和Th2亚群分化比例和细胞数均升高。
本研究通过模拟外周T细胞活化的抗原刺激信号,验证山茱萸提取物莫诺苷可促进T细胞活化与分化。但是由于莫诺苷对Wnt信号的多条通路均有影响,T细胞分化的各个亚群方向也受其影响,具体是何种机制在莫诺苷对T细胞功能调控中起主导作用,需要后续增加不同Wnt信号通路的抑制剂与莫诺苷共同处理培养T细胞实验进一步验证。
