莫诺苷对小鼠骨髓源树突状细胞表型及功能的影响
2019-08-14李慈张燕周婧文仇欣吴仪赵传祥高凤威周文慧刘烁姚雪夏圣
李慈,张燕,周婧文,仇欣,吴仪,赵传祥,高凤威,周文慧,刘烁,姚雪,夏圣
(江苏大学医学院,江苏镇江212013)
莫诺苷(morroniside)是一种从山茱萸中提取的物质,可以促进神经功能的恢复[1-3]。也有研究显示,莫诺苷对预防糖尿病血管病发挥有益作用[4]。据报道,莫诺苷有抗氧化和抗凋亡的作用[5],可通过细胞外基质和细胞黏附分子促进骨髓间充质干细胞增殖[6]。这些结果均表明莫诺苷具有许多生物学活性,与免疫系统密切相关。树突状细胞(dendritic cell,DC)作为最重要的抗原提呈细胞,在免疫应答的起始和调节过程中起着关键作用,迄今为止莫诺苷对树突状细胞的调节作用尚不明确。为此,本实验利用小鼠骨髓源树突状细胞(bone-marrow derived dendritic cells,BMDCs),探究莫诺苷对其分化、表型和功能的影响,为莫诺苷的开发应用提供理论依据。
1 材料和方法
1.1 实验动物
C57BL/6小鼠(No.201907363)购于江苏大学动物中心,H2-Kb-OVA323-339肽抗原特异性OTⅡ小鼠(No.004194)购于Jackson Laboratory。所有实验均使用6~12周龄的雌性小鼠。
1.2 主要试剂及仪器
RPMI 1640培养基(上海源培生物公司);胎牛血清(美国Gibco公司);12孔细胞培养板(韩国Spl Life Sciences公司);96孔细胞培养板(Nunc公司);莫诺苷(成都普瑞法科技开发有限公司);脂多糖、卵清蛋白(Sigma公司);羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)荧光染料(Invitrogen公司);CD11c-Percpcy5.5、CD11b-APC、CD80-PE、CD86-PE、MHC-I-PE、MHC-Ⅱ-PE、CD4-APC、CD69-FITC和CD25-Percp-cy 5.5(eBioscience公司);小鼠Naive CD4+T细胞磁分选试剂盒(Stem Cell公司);小鼠IL-6、IL-12p70 ELISA试剂盒(杭州联科生物有限公司);酶标仪(Rayto公司);细胞培养箱(Thermo公司);荧光倒置显微镜(Axiovert 200M,德国 Zeiss公司);Accuri C6流式细胞仪、FACSCautoTMⅡ流式细胞仪(BD公司)。
1.3 小鼠BMDCs的体外培养
BMDCs的体外培养参照文献[7]进行。处死C57BL/6小鼠,使用无菌PBS冲洗股骨和胫骨,从骨髓腔中制备骨髓细胞。培养基为含10%胎牛血清、粒细胞-巨噬细胞集落刺激因子(GM-CSF,10 ng/mL)、IL-4(1 ng/mL)的RPMI 1640,培养条件为37℃、5%CO2。每隔1天,半量换新鲜培养基并加入莫诺苷刺激(终浓度10μmol/L),7 d后收集悬浮细胞并进行磁珠分选,得到CD11c+细胞,作为未成熟的BMDCs,成熟的BMDCs则需经过脂多糖(终浓度1μg/mL)诱导18~24 h。
在培养过程中半量换新鲜培养基不加莫诺苷和脂多糖刺激的细胞作为对照组,只加莫诺苷刺激的为莫诺苷组,只加脂多糖刺激的为脂多糖组,莫诺苷和脂多糖均加的为莫诺苷+脂多糖联合处理组。
1.4 流式细胞术检测莫诺苷刺激后BMDCs的分化效率
取“1.3”中获得的骨髓细胞,加入荧光染料CFSE(终浓度2.5μmol/L),避光、37℃孵育10min。加入含10%胎牛血清的RPMI 1640溶液10 mL终止反应,4℃、1 000 r/min离心5min,再用 PBS洗1遍。每隔1天,半量换新鲜培养基并加入莫诺苷(10 μmol/L)进行培养,第7天,在光学显微镜下观察细胞形态,并进行拍照。收集细胞并计数,标记CD11c荧光抗体,4℃孵育30 min,PBS洗细胞2遍后,流式细胞仪检测CD11c+群体数以及CFSE的荧光强度。
1.5 流式细胞术检测BMDCs膜表面CD80、CD86、MHC-Ⅰ和MHC-Ⅱ类分子的表达
将诱导培养7 d的BMDCs按每孔1×106细胞加入到12孔板中,经过18~24 h脂多糖刺激后,收集细胞。标记 CD11b、CD11c、CD80、CD86,MHC-Ⅰ、MHC-Ⅱ荧光抗体,4℃孵育30 min,PBS洗细胞2遍后,再用流式细胞分析仪检测CD11b和CD11c双阳性群体中 CD80、CD86、MHC-Ⅰ和MHC-Ⅱ类分子的表达情况。使用Flowjo软件分析数据。
1.6 ELISA法检测BMDCs培养上清液中IL-6和IL-12的分泌
收集C57BL/6小鼠BMDCs的培养上清液,按ELISA试剂盒操作步骤检测IL-6、IL-12p70的分泌量。
1.7 流式细胞术检测抗原特异性CD4+T细胞体外活化的能力
BMDCs细胞的处理与准备同“1.3”。将OVA323-339肽与BMDCs共孵育6 h。取肽抗原特异性OT-Ⅱ小鼠脾脏,制备单细胞悬液,无菌PBS洗2遍,用分选缓冲液将细胞数调整为1×108/mL,置于流式管中。向1 mL细胞悬液中加入小鼠血清50 μL/mL;加入 CD4+T细胞分离液60μL/mL,室温7.5 min;加入记忆 T细胞去除液60μL/mL,室温2.5 min;加入 Streptavidin Rapid SpheresTM50001 70μL/mL,室温 2.5 min;加分选缓冲液定容至3 mL,混匀,转移至磁架上,室温2.5 min。将上清液转移至新的流式管中,用1 mL含10%胎牛血清的RPMI 1640重悬计数后,将OT-Ⅱ TCR转基因小鼠的CD4+T细胞与经OVA323-339处理的BMDCs共培养,以 CD4+T(2×105)∶BMDCs(2×104)的比例铺入96孔U底板中,37℃、5%CO2培养4 d后,将细胞标记CD4-APC、CD69-FITC和CD25-Percp-cy5.5荧光抗体,流式细胞仪检测CD4+T细胞的活化。
1.8 流式细胞术检测抗原特异性CD4+T细胞体外增殖的能力
BMDCs细胞的前期处理与准备同“1.7”。将磁珠分选的上清液转移至新的流式管后,用1 mL PBS重悬计数,加 CFSE溶液(5μmol/L),避光、37℃孵育10 min。用10 mL含10%胎牛血清的RPMI1640终止反应,PBS洗2遍。以CD4+T(2×105)∶BMDCs(2×104)的比例铺入96孔U底板中,37℃、5%CO2孵育4 d后,将细胞标记CD4-APC荧光抗体,流式细胞仪检测CD4+T细胞的增殖。
1.9 流式细胞术检测抗原特异性CD4+T细胞体外分化的能力
BMDCs细胞的前期处理与准备同“1.7”。当共培养到第4天后,提前5 h向培养体系中加入布雷非德菌素A(BFA)与佛波酯(PMA)试剂,再分别对细胞进行CD4-APC荧光抗体染色20 min、IC Fixation(胞内固定)溶液避光孵育 20 min、IFN-γ-PE荧光抗体染色20 min后,流式细胞仪检测CD4+T细胞向Th1分化的能力。
1.10 统计学分析
应用GraphPad Prism 5.0软件进行统计学分析,两组之间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 莫诺苷对BMDCs形态和分化效率的影响
如图1所示,与对照组相比,莫诺苷作用后BMDCs的形态和大小以及细胞聚团均无明显影响;细胞总数也无明显差异,对照组细胞数为6.4×106,莫诺苷组细胞数为6.0×106。流式检测结果(图2)显示,莫诺苷处理后,细胞的CFSE荧光强度未发生明显偏移。
图1 莫诺苷处理后BMDCs的形态(光学显微镜×40)
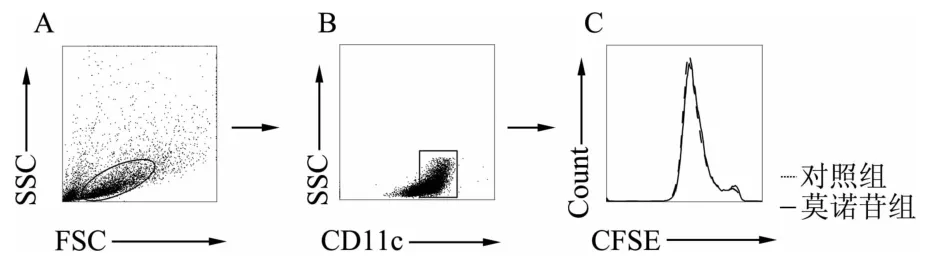
图2 流式细胞术检测CD11c+群体中CFSE的荧光强度
2.2 莫诺苷对BMDCs表型的影响
如图3,与对照组相比,莫诺苷组 BMDCs中CD80、CD86、MHC-Ⅰ和MHC-Ⅱ类分子的表达明显增加(P<0.05和P<0.01);与脂多糖组相比,莫诺苷+脂多糖组 CD80、CD86、MHC-Ⅰ和MHC-Ⅱ类分子的表达也明显增加(P<0.05和P<0.01)。

图3 莫诺苷对BMDCs表型的影响
2.3 莫诺苷对BMDCs分泌IL-6、IL-12的影响
如图4,对于未成熟BMDCs来说,莫诺苷组与对照组相比,上清液IL-6含量明显下降(P<0.01),IL-12p70无明显差异;对于成熟BMDCs来说,莫诺苷+脂多糖组与脂多糖组相比,上清液IL-6含量无明显差异,而IL-12p70的分泌则显著增多(P<0.01)。
2.4 莫诺苷对BMDCs激活抗原特异性CD4+T细胞的活化、增殖和分化的影响
与脂多糖组相比,莫诺苷+脂多糖组CD69的表达无明显差异,而CD25的表达明显增加(P<0.01);莫诺苷+脂多糖组的BMDCs与T细胞共培养时,OTⅡ小鼠的CD4+T细胞大量增殖;莫诺苷+脂多糖组IFN-γ的表达明显增加(P<0.01)。见图5。
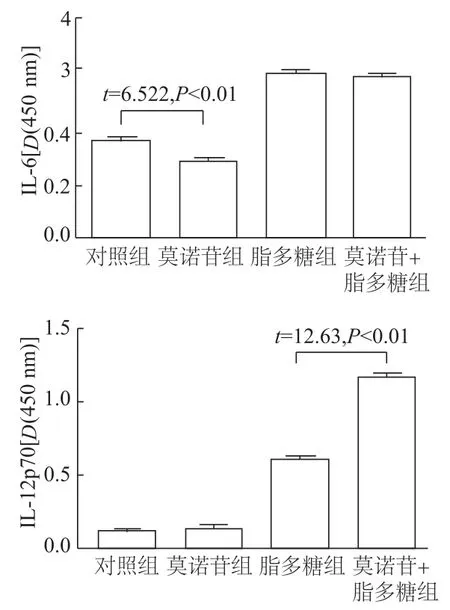
图4 莫诺苷对BMDCs分泌细胞因子的影响
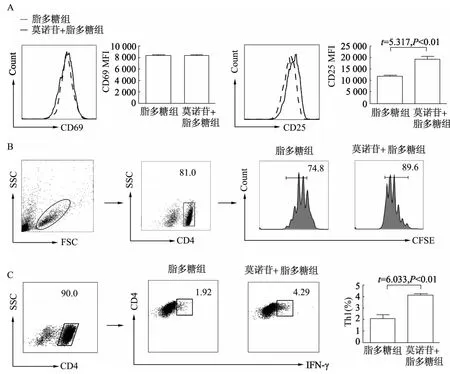
图5 莫诺苷对BMDCs激活抗原特异性CD4+T细胞的影响
3 讨论
本研究结果表明,莫诺苷促进BMDCs的成熟,主要表现在莫诺苷可以增强BMDCs CD80、CD86、MHCⅠ和MHCⅡ类分子等关键表面标志物的表达,对T细胞活化的第一信号和第二信号起到放大作用;并且莫诺苷可以上调BMDCs分泌细胞因子IL-12的能力,进一步诱导T细胞增殖和分化,从而启动完整的免疫应答;此外,莫诺苷还促进BMDCs激活抗原特异性CD4+T细胞的中期活化以及增殖水平,增强BMDCs的抗原提呈功能,促进CD4+T细胞向Th1分化。树突状细胞作为抗原提呈细胞,可以处理抗原并将其呈递给T细胞,因此树突状细胞的激活和成熟对免疫应答具有关键影响。而莫诺苷可以促BMDCs的成熟,增强其抗原提呈功能,从而增强免疫应答,这为莫诺苷的应用提供了新的可能性。
已有文献报道[8],莫诺苷可以降低大鼠心肌中IL-6的表达。我们的实验中,莫诺苷抑制未成熟的BMDCs IL-6的分泌,而在成熟的BMDCs中,IL-6的表达则不受莫诺苷刺激的影响,我们猜测可能由于体外脂多糖的作用大于莫诺苷的作用。目前未有文献明确报道莫诺苷与IL-12的关系。在我们的研究中,成熟的BMDCs受莫诺苷刺激后分泌大量的IL-12。树突状细胞分泌大量IL-12可诱导初始T细胞(Th0)分化为Th1细胞,产生Th1型免疫应答。IL-12作为固有免疫和适应性免疫之间的关键分子,能够驱动Th1细胞分化和扩增,同时抑制IL-4和拮抗Th2反应[9-12]。我们的实验结果也证实了莫诺苷刺激BMDCs后,促进初始T细胞(Th0)向Th1分化。
NF-κB活化可导致促炎细胞因子、趋化因子、黏附分子、炎性受体和炎性酶如iNOS和COX-2的表达增强[13-15],而莫诺苷可以抑制 NF-κB的活化,从而起到抗炎作用[16]。文献报道,莫诺苷可以降低IL-6、IL-1β和TNF-α的水平,对急性心肌梗死后的大鼠具有抗炎作用[8]。然而,从免疫学角度出发,目前对莫诺苷的抗炎机制尚未有深入研究。本实验结果显示,BMDCs受到莫诺苷刺激后,高表达共刺激分子和MHC-Ⅰ、MHC-Ⅱ类分子,并且抗原提呈功能得到增强。但本实验只检测了BMDCs培养上清液中IL-6和IL-12的分泌,对TGF-β、IL-10等抑炎因子未进行检测。综上所述,莫诺苷在体外可促进BMDCs的成熟并增强其抗原提呈功能,并增强CD4+T细胞活化后向Th1分化,但莫诺苷介导树突状细胞调控T细胞分化的机制仍有待探究。
