人参炔醇重塑巨噬细胞表型调控乳腺癌细胞生物学行为
2019-08-14邵琦李佳丽周李宁苏兆亮许化溪
邵琦,李佳丽,周李宁,苏兆亮,许化溪
(江苏大学医学院,镇江江苏212013)
巨噬细胞是高度异质性的细胞群体[1],参与抗原呈递、吞噬和其他免疫调节过程[2]。浸润到实体肿瘤的巨噬细胞(tumor associated macrophages,TAMs)是肿瘤微环境的重要组成部分,在不同因素的刺激下可分化为M1型或M2型巨噬细胞[3-4]。M1型巨噬细胞分泌促炎性细胞因子和趋化因子(如TNF-α、IL-12等),并能清除破坏吞噬肿瘤细胞。M2型巨噬细胞分泌抑炎性细胞因子(如IL-4,IL-8,IL-10等)下调免疫应答[5]。研究表明 TAMs更倾向于M2表型[6]。近来研究发现,巨噬细胞通过炎症反应促进肿瘤发生[7],通过增加血管的生成、免疫抑制、侵袭等促进肿瘤转移[8],且TAMs与乳腺癌、胃癌、卵巢癌等多种癌症的总体低生存率相关[2]。人参炔醇是天然存在的聚乙炔[9],能明显抑制胰腺癌、肺癌[10]以及白血病[11]等多种肿瘤细胞增殖。然而,其对TAMs的作用尚不清楚,本研究旨在探讨人参炔醇对巨噬细胞调控及其对乳腺癌细胞行为学的影响。
1 材料与方法
1.1 材料
人参炔醇(成都瑞芬思生物科技公司);小鼠4T1乳腺癌细胞系和鼠源RAW264.7巨噬细胞系(上海中科院细胞库);RPMI-1640、DMEM和胎牛血清(美国Gibco公司);CCK-8细胞增殖及细胞毒性检测试剂盒(北京索莱宝科技有限公司);RIPA裂解液、结晶紫染液(碧云天生物技术有限公司);兔抗鼠精氨酸酶1(Arg-1)单克隆抗体、兔抗鼠诱导型一氧化氮合酶(iNOS)单克隆抗体、大鼠抗小鼠Bax单克隆抗体、大鼠抗小鼠Bcl-2单克隆抗体、兔抗小鼠caspase3单克隆抗体、兔抗小鼠cleaved-caspase3单克隆抗体、兔抗小鼠β-肌动蛋白单克隆抗体等(美国Immunoway公司);Transwell小室(美国Corning公司);Annexin-V/7-AAD凋亡试剂盒、PE标记的MHCⅡ类分子、CD80单克隆抗体、FITC标记的CD86单克隆抗体(美国 BD公司);Arg-1、iNOS、IL-4、IL-8、IL-10、IL-1β、TNF-α等PCR引物由生工生物公司设计并合成。
1.2 细胞培养
4T1细胞、RAW264.7细胞分别用含10%胎牛血清的RPMI-1640、DMEM培养,置于37℃、5%CO2培养箱中孵育,每24 h换液1次;待细胞状态良好,且生长密度在80%左右时传代;取对数生长期细胞进行实验。
1.3 人参炔醇处理后4T1细胞生物学行为的改变
1.3.1 CCK-8检测4T1细胞增殖 取对数生长期4T1细胞接种于96孔板,5×103/孔;待其稳定贴壁后,以不同浓度人参炔醇(0、8、16μg/mL)分别处理6、12、24 h;弃上清液,PBS洗1遍;每孔加入100μL CCK-8与不含胎牛血清RPMI-1640的混合液(1∶9);设置对照孔(含细胞、培养基和CCK-8溶液)和空白孔(只含培养基和CCK-8溶液),于37℃、5%CO2的细胞培养箱中避光孵育1~4 h;酶标仪测450 nm处D值。细胞增殖率按以下公式计算:细胞增殖率=(实验孔D值-空白D值)/(对照孔D值-空白孔D值)×100%。
1.3.2 流式细胞术检测4T1细胞凋亡比例 取对数生长期4T1细胞种于24孔板,2×105/孔,分别以不同浓度人参炔醇(0、8、16μg/mL)处理24 h;收集各组细胞,500×g离心5 min;弃上清液,用PBS洗涤,并以100μL缓冲液重悬;每组细胞按步骤说明分别加入5μL Annexin-V-APC和10μL 7-AAD,混匀,室温避光染色15 min;加入380μL缓冲液终止反应;15 min内用流式细胞仪检测细胞凋亡情况。
1.3.3 蛋白质印迹法检测4T1细胞凋亡相关蛋白表达 前期处理同“1.3.2”,收集细胞后,加入RIPA裂解液,获得蛋白样本,检测每个样本的蛋白浓度,以保证每组所加蛋白样本内参量相同。蛋白行SDS-PAGE(80 V电泳20~30min,120 V电泳90min);转移至PVDF膜(350 mA恒流转膜90 min);5%牛血清白蛋白室温封闭1 h;将稀释好的Bcl-2、Bax、caspase3、cleaved-caspase3、β-肌动蛋白一抗于4℃孵育过夜;TBST洗涤3次,每次10 min;加入稀释二抗室温孵育1 h;TBST洗涤3次,每次10 min;根据检测试剂盒步骤进行曝光显色。一抗稀释比:Bcl-2、Bax为1∶100,caspase3、cleaved-caspase3为1∶800,β-肌动蛋白为1∶800;二抗稀释比均为1∶2 000。
1.3.4 Transwell检测4T1细胞的迁移及侵袭作用在Transwell小室的下室中分别加入700μL由含10%胎牛血清RPMI-1640稀释的不同浓度人参炔醇(0、8、16μg/mL),4T1细胞种于上室(1×104个/孔,侵袭实验预铺基质胶,基质胶稀释倍数为1∶80),并加入 300μL无血清 RPMI-1640,放入细胞培养箱孵育24 h;用4%低聚甲醛固定10 min;结晶紫染色30 min;于倒置显微镜下观察拍照。
1.4 RAW264.7巨噬细胞分组及相关指标的具体检测
1.4.1 细胞分组 将RAW264.7巨噬细胞分为6组:①对照组,未处理;②脂多糖组,以500 ng/mL脂多糖刺激24 h;③IL-4组,以20 ng/mL IL-4刺激24 h;④CM组,以肿瘤培养上清液(CM)刺激48 h;⑤ CM+8组,以肿瘤培养上清刺激48 h,加8μg/mL人参炔醇处理24 h;⑥CM+16组,以肿瘤培养上清液刺激48 h,加16μg/mL人参炔醇处理24 h。
1.4.2 qRT-PCR检测RAW264.7巨噬细胞中多种mRNA的表达 提取“1.4.1”各组细胞RNA,测定各组RNA浓度,根据试剂说明书将RNA反转录为cDNA。分别加入PCR反应试剂及 Arg-1、iNOS、IL-4、IL-8、IL-10、IL-1β、TNF-α引物,以 β-肌动蛋白为内参,分析比较各组mRNA表达。β-肌动蛋白引物序列:上游5′-GAAGTCCCTCACCCTCCCAA-3′,下游5′-GGCA-TGGACGCGACCA-3′;Arg-1引物序列:上游5′-GAAGAACCCACGGTCTGTGG-3′,下游5′-TCCAAC-TGCCAGACTGTGGTC-3′;iNOS引物序列:上游5′-CCCTGGTGCAGGGAATCTT-3′,下游5′-TAGCTGCCGCTCTCATCCA-3′;IL-1β引物序列:上游5′-GCAGAGCACAAGCCTGTCTTCC-3′,下游5′-ACCTGTCTTGGCCGAGGACTAAG-3′;IL-4引物序列:上游5′-ACAGGAGAAGGGACGCCATG-3′,下游5′-TGGAAGCCCTAGAGACGAGC-3′;IL-8引物序列:上游5′-CTGTTGGCCCAATTACTAACAG-3′,下游5′-TCCCGAATTGGAAAGGGAAATA-3′;IL-10引物序列:上游5′-TTCTTTCAAACAAAGGACCAGC-3′,下游5′-GCAACCCAAGTAACCCTTAAAG-3′;TNF-α引物序列:上游5′-ATGTCTCAGCCTCTTCTCATTC-3′,下游5′-GCTTGTCACTCGAATTTTGAGA-3′。反应条件:95℃预变性10 min;95℃ 15 s,60℃ 30 s,72℃30 s,共40个循环。每组样本设置3个复孔。采用2-△△Ct法计算目的基因相对表达量。
1.4.3 流式细胞术检测巨噬细胞表面抗原递呈相关分子表达 收集各组细胞,分两大组并分别以100μL PBS重悬,第一大组的6管标本加入1μL PE标记的MHCⅡ流式抗体,第二大组的6管标本分别加入1μL PE标记的抗CD80、FITC标记的抗CD86流式抗体;4℃避光孵育30 min;用1 mL PBS洗涤1次;加入200μL PBS重悬;用流式细胞仪检测。
1.4.4 Transwell实验检测4T1细胞迁移与侵袭接种6组细胞于24孔板(2×105/孔,700μL);取对数生长期的4T1细胞种于上室(1×104个/孔,侵袭实验预铺基质胶,基质胶稀释比例为1∶80);加入300μL无血清1640培养液于细胞培养箱孵育。检测方法同“1.3.4”。
1.5 统计学分析
应用GraphPad Prism 5.0软件对所得数据进行统计学分析和制图,多组计量资料比较采用单因素方差分析,进一步两两比较采用t检验,所有实验均重复3次以上,以P<0.05为差异有统计学意义。
2 结果
2.1 人参炔醇直接抑制4T1细胞增殖、迁移、侵袭行为
与0μg/mL组相比,人参炔醇处理组4T1细胞增殖受到明显抑制,呈时间和剂量依赖。与0μg/mL组相比,8μg/mL、16μg/mL组6 h、12 h、24 h细胞增殖率明显降低(P均<0.01,图1);蛋白质印迹检测结果显示,与0μg/mL组相比,8μg/mL、16μg/mL组促凋亡蛋白Bax以及活化的cleaved-caspase3表达升高,而抗凋亡蛋白Bcl-2表达降低(图2);流式细胞术检测结果显示,与0μg/mL组相比,8μg/mL、16μg/mL组细胞凋亡率明显增加(t=51.12,25.37,P均<0.01,图3);Transwell实验结果显示,与0μg/mL组相比,8μg/mL、16μg/mL人参炔醇处理组发生迁移侵袭的肿瘤细胞数量明显减少(图4)。
2.2 人参炔醇调节巨噬细胞 Arg-1,iNOS表达,诱导M2型巨噬细胞向M1型分化
qRT-PCR检测结果显示,CM组巨噬细胞呈现Arg-1(high)iNOS(low)表型。随着人参炔醇浓度的升高,即CM+8组与CM+16组巨噬细胞中Arg-1 mRNA表达较 CM组明显降低(t=7.087,11.51,P<0.01),iNOSmRNA表达明显升高(t=81.80,12.63,P<0.01)。见图5。

图1 不同浓度人参炔醇处理乳腺癌4T1细胞不同时间后的细胞增殖率
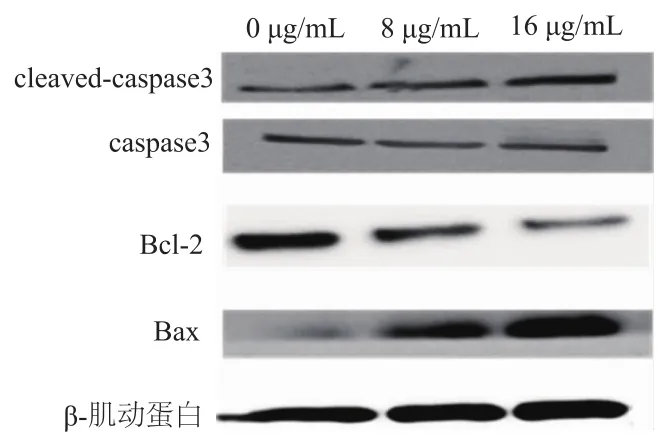
图2 蛋白质印迹检测不同浓度人参炔醇作用后乳腺癌细胞凋亡相关蛋白的表达
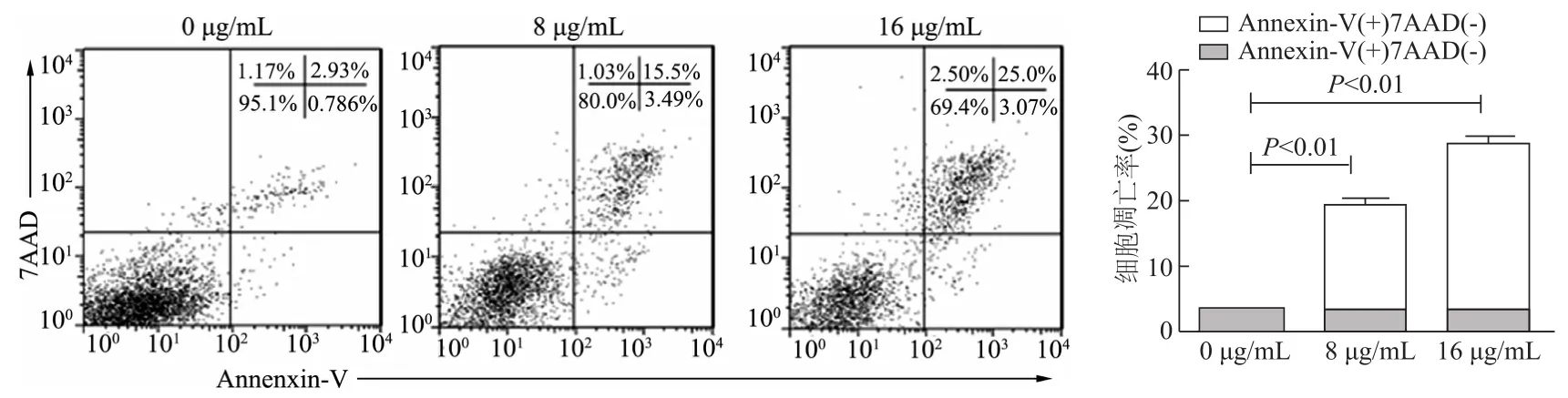
图3 流式细胞术检测不同浓度人参炔醇作用后乳腺癌4T1细胞凋亡比例
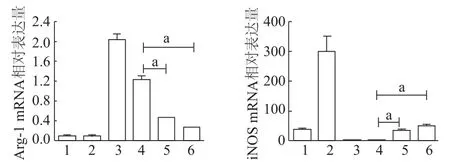
图5 qRT-PCR检测巨噬细胞Arg-1 mRNA和iNOSm RNA表达水平
2.3 人参炔醇上调巨噬细胞表面抗原递呈相关分子,同时改变其分泌谱
2.3.1 人参炔醇上调巨噬细胞表面MHCⅡ类分子、CD80、CD86表达 流式细胞术检测结果显示,与CM组相比,CM+8组与CM+16组巨噬细胞表面抗原递呈相关分子MHCⅡ类分子、CD80、CD86表达升高(图6)。
2.3.2 人参炔醇改变巨噬细胞细胞因子分泌谱qRT-PCR检测结果显示,CM组巨噬细胞分泌谱呈现 TNF-α(low)、IL-1β(low)、IL-4(high)、IL-8(high)、IL-10(high)。与CM组相比,CM+16组 IL-4、IL-8、IL-10等mRNA表达水平明显降低(P均<0.05),IL-1β、TNF-α等mRNA表达水平明显升高(P均<0.05),细胞因子分泌谱转为TNF-α(high)、IL-1β(high)、IL-4(low)、IL-8(low)、IL-10(low)。见图7。
2.4 经人参炔醇处理的巨噬细胞抑制4T1细胞的迁移与侵袭行为
实验结果显示,与对照组相比,CM组巨噬细胞组迁移与侵袭到下室的4T1细胞数量明显增加,随着人参炔醇浓度升高,迁移与侵袭到下室的4T1细胞数量逐渐减少,浓度为16μg/mL时,4T1细胞数量减少量最为明显(图8)。

图6 流式细胞术检测RAW 264.7巨噬细胞抗原递呈相关分子表达

图7 qRT-PCR检测巨噬细胞分泌谱mRNA水平表达
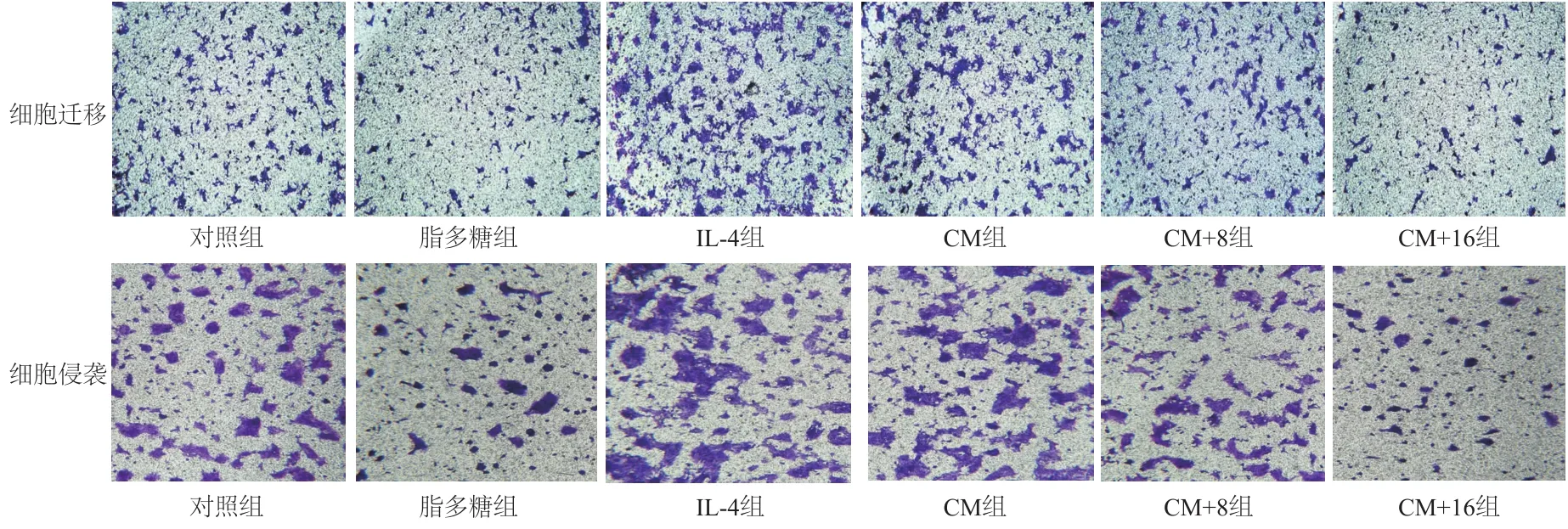
图8 Transwell实验检测各组4T1细胞的迁移与侵袭(100×)
3 讨论
人参炔醇为天然的聚乙炔醇类化合物,可通过阻滞细胞周期、干扰DNA合成抑制多种癌细胞增殖[12]。人参炔醇可通过调控凋亡相关蛋白的表达诱导或加速肿瘤细胞发生凋亡。本研究显示,人参炔醇可以抑制4T1乳腺癌细胞系的增殖活动并触发胞内凋亡程序,在其作用下,促凋亡蛋白 Bax、cleaved-caspase3表达明显上调,抗凋亡蛋白表达显著下降;同时对4T1细胞的迁移侵袭行为也起到明显的抑制作用。由此说明,人参炔醇可经由某种机制参与4T1细胞远处转移及侵袭的负向调节。
肿瘤微环境中,巨噬细胞多以 M2型存在[13],TAMs与肿瘤相互作用,可分泌表皮细胞生长因子、血管内皮细胞生长因子等多种细胞因子和CXCL、CCL趋化因子家族促进肿瘤生长,血管淋巴管生成和转移[14];在肿瘤发展过程中,TAMs又能产生多种降解消化基质的酶,为肿瘤转移创造条件[15]。同时,巨噬细胞可以通过减少抗原递呈,阻碍T细胞增殖,抑制NK细胞的迁移来抑制免疫应答[16]。目前针对巨噬细胞的治疗方式多分为三大类:逆转TAMs表型(如阳离子聚合剂[17])由促肿瘤表型向抗肿瘤表型分化;削弱TAMs对肿瘤的促进作用;杀伤 TAMs(如抗 CSF1R单克隆抗体[2]、氯膦酸盐脂质体[18])。本研究结果显示,人参炔醇对巨噬细胞系本身的活性并无影响,在已用肿瘤培养上清液体外诱导成M2表型的TAMs中加入人参炔醇后,巨噬细胞由 Arg-1(high)iNOS(low)的M2型转化为Arg-1(low)iNOS(high)的M1型,且细胞表面抗原递呈相关分子MHCⅡ类分子CD80、CD86的表达显著升高,细胞因子分泌谱由 TNF-α(low)、IL-1β(low)、IL-4(high)、IL-8(high)、IL-10(high)转 变 为TNF-α(high)、IL-1β(high)、IL-4(low)、IL-8(low)、IL-10(low),均提示巨噬细胞向 M1型巨噬细胞转化。以上结果联合证明,人参炔醇可逆转巨噬细胞表型、调节其抗原递呈功能及细胞因子分泌谱。
综上所述,体外实验证实人参炔醇可直接或通过重塑巨噬细胞表型和功能间接影响乳腺癌细胞各项生物学行为。但人参炔醇在体内是否能发挥相同作用以及具体机制有待进一步研究。
