TACSTD2调控食管鳞癌细胞对顺铂的敏感性
2019-08-14武丹周玲糜磊周月鹏陈德玉
武丹,周玲,糜磊,周月鹏,陈德玉
(1.江苏大学附属医院肿瘤治疗中心,江苏镇江212001;2.常州武进人民医院重症监护室,江苏常州213017)
肿瘤关联钙信号转导因子2(tumor-associated calcium signal transducer 2,TACSTD2)属于细胞跨膜糖蛋白,可与蛋白激酶C、β-连环蛋白等结合,调控肿瘤细胞的生长、侵袭和转移,发挥促癌作用[1-2]。然现有研究表明,TACSTD2表达与食管鳞癌预后、转移以及治疗拮抗之间的联系尚存在较大争议[3-5]。本研究拟检测TACSTD2与多药耐药相关蛋白1(multidrug resistance protein 1,MDR1)表达及其对细胞凋亡水平的影响,揭示TACSTD2在食管鳞癌耐药中的作用机制。
1 材料与方法
1.1 主要材料
MDR1、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、p-MAPK以及 β-肌动蛋白单克隆抗体购自美国Cell Signaling Technology公司;TACSTD2购自美国Santa Cruz公司;顺铂购自上海Selleck公司;HRP标记的山羊抗鼠单克隆抗体,HRP标记的山羊抗兔单克隆抗体购自武汉Proteintech公司;CCK8以及Annexin-V/PI凋亡试剂盒均购自杭州联科生物技术有限公司;脂质体 Lipofectamine 2000、Trizol试剂盒购于美国Invitrogen公司;反转录试剂购于南京诺唯赞生物科技有限公司;相关引物、TACSTD2小干扰及阴性对照均购于上海吉玛制药技术有限公司。食管鳞癌及癌旁组织芯片(Cat No.HEsoS030PG03)购自上海芯超生物科技有限公司。
1.2 组织芯片检测食管鳞癌及癌旁组织中TACSTD2表达
食管鳞癌及癌旁组织芯片制作及标准免疫组织化学染色均由上海芯超生物科技有限公司完成,图像具体分析采用Image J分析软件。TACSTD2蛋白的阳性表达信号为棕黄色颗粒。
1.3 细胞培养及实验分组
将人食管鳞癌ECA 109细胞(中国科学院上海生命科学研究院细胞资源中心)用含10%胎牛血清的RPMI-1640在37℃、5%CO2的细胞培养箱中培养。顺铂耐药株ECA 109/DDP细胞构建参照已有文献[6],简要流程如下:取对数生长期 ECA109细胞,换液加入终浓度为5μmol/L顺铂处理3 d;换为普通培养基后待细胞融合率达到70%~80%再次加入5μmol/L顺铂处理3 d,形成一个诱导周期,持续诱导6周。人食管鳞癌细胞KYSE 30及顺铂耐药株KYSE 30/DDP细胞(江苏大学附属医院朱海涛博士惠赠)用含10%胎牛血清的RPMI-EMEM在37℃、5%CO2的细胞培养箱中培养。本研究以上述4种细胞为研究对象,分别分为空白对照组和(或)阴性对照组及TACSTD2干扰组。
1.4 细胞转染
转染前一天,将细胞按3.5×105个/孔接种于含完全培养基的6孔板中,当细胞达到50%~70%再行转染;取两个EP管,分别为A和B,均加入250μL Opti-MEM;然后在 A、B中分别加入 5μL Lipo2000和5μL siRNA-TACSTD2,轻柔吹打混匀后于室温静置5 min;将A管混合液加入B管中,吹打均匀后室温静置20 min;用PBS冲洗6孔板2次,随后每孔加入1.5 mL Opti-MEM及500μL siRNA-Lipo2000混合液,于培养箱中孵育6 h,弃混合液更换为完全培养基继续培养。其中siRNA序列如下,TACSTD2小干扰:正义链 5′-CGGGAUCGUUUGCAAGUAATT-3′;反义链 5′-UUACUUGCAAACGAUCCCGTT-3′;阴性对照:正义链 5′-UUCUCCGAACGUGUCACGUTT-3′;反义链 5′-ACGUGACACGUUCGGAGAATT-3′。
1.5 荧光定量PCR法检测TACSTD2表达差异及干扰效果验证
对4种细胞均分别行TACSTD2干扰、阴性对照及空白对照处理48 h;提取细胞总RNA,进一步反转录合成cDNA后进行检测;PCR反应体系(20μL)如下:10μL SYBR®Premix ExTaqTM,0.4μL上、下游引物(10μmol/L),0.4μL ROX Reference DyeⅡ,2μL cDNA模版,6.8μL无RNA酶单蒸水;反应条件:95℃预变性5 min;95℃变性15 s,60℃30 s,72℃ 11 s;60℃退火/延伸30 s,共40个循环。以 β-肌动蛋白为内参,用 2-△△Ct法计算 TACSTD2 mRNA相对表达量变化。引物序列如下,TACSTD2上游引物:5′-GCCTACTACTTCGAGAGGGACA-3′,下游引物:5′-CAGTTCCTTGATCTCCACCTTC-3′;β-肌动蛋白上游引物:5′-CCACTGGCATCGTGATGGACTCC-3′,下游引物:5′-GCCGTGGTGGTGAAGCTGTAGC-3′。每组实验重复3次。
1.6 蛋白质印迹法检测TACSTD2干扰效果及TACSTD2干扰前后TACSTD2、MDR1、p-MAPK、MAPK表达
收集食管鳞癌细胞及其对应的顺铂耐药细胞阴性对照组及TACSTD2干扰组细胞,洗涤后加入RIPA细胞裂解液于冰上处理30 min,期间每5 min振荡1次;12 000 r/min离心10 min;收集上清液即为细胞全蛋白,测定蛋白浓度后加入4×上样缓冲液使其稀释成1×上样缓冲液,煮沸10 min变性处理。经SDS-PAGE后,将蛋白电转移至PVDF膜,用5%脱脂奶粉封闭60 min;置于 TACSTD2、MDR1、MAPK及p-MAPK抗体稀释液(均1∶1 000)中4℃孵育过夜;用1×TBST洗膜3次;加入抗鼠或抗兔HRP标记二抗(1∶5 000)室温孵育1 h;清洗加入曝光液显影、拍摄并采用Clinx Image Analysis软件处理分析图像。每组重复3次。
1.7 CCK8检测顺铂IC50值
将4种细胞以(4~5)×103个/孔种于96孔板,每组设6个平行孔,待细胞贴壁后予TACSTD2干扰或者阴性对照处理24 h;按浓度梯度分别加入顺铂(0、1、2、4、8、16、32μg/mL)处理 24 h;每孔加入 10μL CCK8,振荡、孵育2 h;在酶联检测仪450 nm波长处检测光密度(D)值,采用Origin法计算食管鳞癌顺铂IC50值。每组实验重复3次。
1.8 流式细胞术检测细胞凋亡水平
将4种细胞以4×105个/孔密度种于6孔板中,待贴壁后4种细胞均分为4组,分别为阴性对照组、TACSTD2干扰组(TACSTD2 siRNA处理 48 h)、顺铂处理组(1μg/mL顺铂处理48 h)、TACSTD2干扰+顺铂处理组(TACSTD2 siRNA处理24 h后联合1μg/mL顺铂处理24 h);用不含EDTA胰酶消化离心;用预冷PBS洗2次,每管用500μL标记缓冲液重悬;避光先加入5μL Annexin V-FITC,待临上机前15 min加入5μL PI。每组实验重复3次。
1.9 统计分析
采用GraphPad Prism 5.0软件做图及统计分析。计量数据用均数±标准差(±s)表示,两组间均数比较采用两样本t检验;多组均数间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料采用率表示,组间比较采用卡方检验;P<0.05为差异具有统计学意义。
2 结果
2.1 食管鳞癌组织芯片中TACSTD2的表达
组织芯片结果显示(图1),15例食管鳞癌组织中阳性表达率为93.3%,阳性表达见于肿瘤细胞胞质。15例癌旁组织中TACSTD2蛋白阳性表达率为40.2%,TACSTD2阳性细胞主要集中在基底层部分,相对于肿瘤组织而言,分布有规律且结构完整;进一步统计证实,TACSTD2在食管鳞癌组织中表达明显高于癌旁组织(χ2=9.60,P<0.01)。

图1 TACSTD2在食管鳞癌组织及癌旁组织中的表达
2.2 4种细胞TACSTD2表达水平及TACSTD2干扰效果
荧光定量PCR结果显示,食管鳞癌顺铂耐药细胞ECA 109/DDP及KYSE 30/DDP的空白对照组中TACSTD2 mRNA表达明显高于食管鳞癌细胞ECA 109及KYSE 30(P均<0.01);TACSTD2干扰处理后4种细胞TACSTD2 mRNA表达均较阴性对照显著降低(P均<0.01)。进一步蛋白质印迹结果显示,2种食管鳞癌顺铂耐药细胞的空白对照组中TACSTD2表达明显高于对应的食管鳞癌细胞,靶向抑制TACSTD2后4种细胞的TACSTD2蛋白表达显著降低(P均<0.01)。见图2。
2.3 靶向干扰TACSTD2对顺铂IC50值的影响
CCK8结果显示,4种细胞在TACSTD2干扰后顺铂IC50值均显著下调;此外随着顺铂浓度的递增,ECA 109、ECA 109/DDP和KYSE 30、KYSE 30/DDP细胞相对存活率均明显降低(P均<0.01)。在相同的顺铂浓度下,ECA 109/DDP及KYSE 30/DDP细胞存活率均明显高于对应的ECA 109及KYSE 30细胞(P均<0.01)。见图3。

图2 食管鳞癌细胞与顺铂耐药细胞中TACSTD2表达及TACSTD2干扰效果
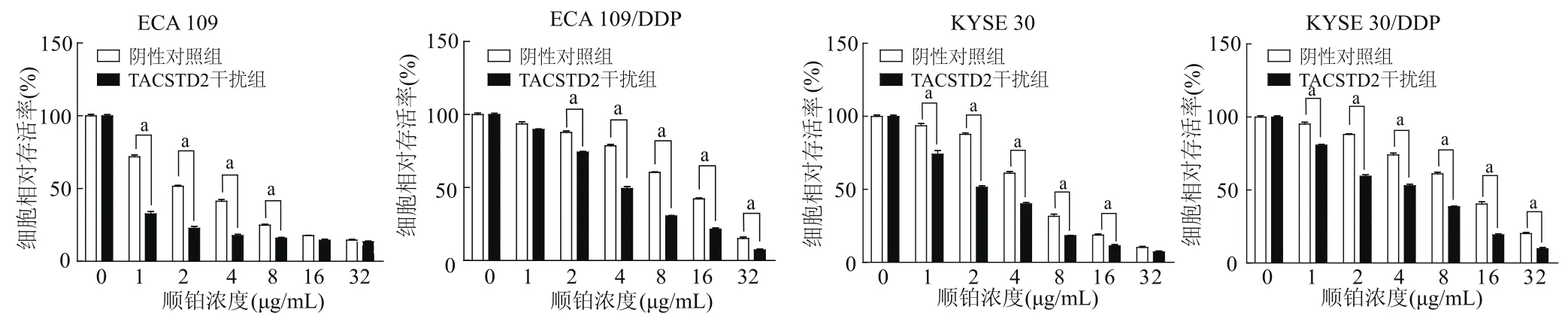
图3 CCK8检测干扰TACSTD2对顺铂IC50值的影响
2.4 TACSTD2表达改变对顺铂杀伤能力的影响
流式细胞术检测结果显示,与食管鳞癌细胞相比,其对应的顺铂耐药细胞在单纯用1μg/mL顺铂处理后细胞凋亡率明显下调(P<0.01);4种细胞在1μg/mL顺铂联合TACSTD2干扰处理后细胞凋亡率均较单独顺铂处理组显著增加(P均<0.01);而4种细胞中TACSTD2干扰单独处理均对细胞凋亡水平无显著影响。见图4。
2.5 TACSTD2干扰后MAPK和MDR1蛋白的表达
如图5所示,食管鳞癌顺铂耐药细胞ECA 109/DDP及KYSE 30/DDP的阴性对照组中MDR1表达强度明显高于对应的食管鳞癌细胞ECA 109及KYSE 30(P均<0.01);靶向下调TACSTD2后可见上述4种细胞中MDR1、p-MAPK表达均显著降低(P均<0.01),由此表明TACSTD2可能参与MAPK信号通路活化以及调控MDR1蛋白的表达进而影响食管鳞癌细胞的顺铂敏感性。
3 讨论
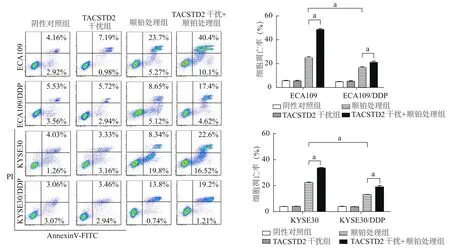
图4 流式细胞术检测TACSTD2干扰后细胞凋亡情况

图5 干扰TACSTD2对MAPK信号及MDR1表达的影响
顺铂作为细胞周期非特异性化疗药物,通过与DNA结合抑制肿瘤细胞复制起到广谱抗癌作用[7];同时顺铂也是食管鳞癌一线治疗的常用药物,但肿瘤耐药以及治疗后复发成为临床实际疗效提高的主要障碍[8]。
TACSTD2作为TACSTD家族成员之一,其异常高表达与多种恶性肿瘤远处转移及不良预后密切相关。例如,在胃癌细胞中,TACSTD2通过与β-连环蛋白直接结合促进上皮间质转化发生,参与肿瘤细胞侵袭及转移等[2];在胶质瘤细胞中,TACSTD通过活化JAK2/STAT3信号促进肿瘤细胞增殖和转移[9];在头颈部肿瘤中,TACSTD2单抗结合表皮生长因子受体3抗体可发挥显著的协同抗肿瘤作用[10]。本研究发现,食管鳞癌组织中 TACSTD2表达明显高于癌旁组织,同时瘤体内TACSTD2强阳性肿瘤细胞常伴随侵袭、浸润等行为发生;但在癌旁组织部分区域内细胞亦有较高表达,同时在肿瘤组织中也有低表达甚至阴性样本,由此揭示TACSTD2存在较为明显的个体表达强度差异,这也可能是食管癌中TACSTD2蛋白表达强度与其功能尚存较大争议的原因之一。本研究通过对比顺铂耐药株ECA 109/DDP细胞和ECA 109细胞,KYSE 30/DDP及KYSE 30细胞发现,TACSTD2持续显著高表达可能与食管鳞癌化疗敏感性调控密切相关。
有研究指出,TACSTD2可与多种耐药形成相关分子存在相互作用,直接参与化疗敏感性调节,如在肺癌细胞中下调TACSTD2表达可以抑制MAPK信号通路活化及抗凋亡蛋白髓细胞白血病基因1表达[11];在结肠癌移植瘤模型中上调切除修复交叉互补基因1的表达,经奥沙利铂处理后反而促进瘤体快速增长,而TACSTD2可能参与该进程[12]。本研究中,靶向下调食管鳞癌细胞及诱导形成的耐药株中TACSTD2表达可有效调低IC50值,提高肿瘤细胞对顺铂杀伤的敏感性。进一步通过流式细胞术检测凋亡细胞数发现,siRNA-TACSTD2处理可促进顺铂对 ECA 109、ECA 109/DDP、KYSE 30及 KYSE 30/DDP细胞的杀伤作用。MDR1作为获得性耐药形成中重要一员,主要通过能量消耗逆浓度梯度将化疗药物泵出细胞膜以降低胞内药物有效浓度,从而促使肿瘤细胞产生耐药性[8]。本研究结果显示,siRNA-TACSTD2处理组细胞中MDR1蛋白表达水平低于阴性对照组,表明 TACSTD2表达下调可抑制MDR1表达,提示TACSTD2可能通过促进转运蛋白MDR1表达从而增强食管鳞癌细胞对顺铂的耐药性。研究表明,在肺癌细胞及多药耐药细胞株中,NF-κB及MAPK信号通路活化以及Y-box结合蛋白核转位调控MDR1表达[13];同样,在乳腺癌细胞中PD-1/PD-L1结合致MAPK信号活化进而促进MDR1表达上调[14]。siRNA靶向下调 TACSTD2表达,在 ECA 109、ECA 109/DDP、KYSE 30及 KYSE 30/DDP细胞中均可见p-MAPK蛋白活化抑制。上述结果表明,食管鳞癌中TACSTD2可能影响MAPK信号活化及MDR1表达调控。
综上所述,干扰TACSTD2表达可增强食管鳞癌化疗敏感性,其作用机制可能与MAPK信号以及MDR1表达抑制有关。
