S1PR1基因慢病毒转染对EAE小鼠调节性T细胞及IL-17、IFN-γ水平的影响
2019-08-14李作孝
张 瑶 李作孝
(西南医科大学附属医院,泸州646000)
多发性硬化症(Multiple sclerosis,MS)是一种中枢神经系统(Central nervous system,CNS)自身免疫性炎症性疾病,其病理特征为慢性炎性脱髓鞘,星型胶质细胞反应性增殖,常伴有不同程度的轴突受损,目前MS的病因及发病机制尚未明确,研究表明MS可能是由遗传因素和环境因素相互作用引发的免疫失调引起[1]。临床上常用于MS的治疗药物包括大剂量甲泼尼龙冲剂治疗,免疫调节治疗(如β-干扰素、芬戈莫德)等,其中芬戈莫徳(FTY-720)在2010年9月成为首个被美国食品与药品管理局(FDA)批准用于治疗复发型多发性硬化症(Relapsing-remitting multiple sclerosis,RRMS)的口服免疫抑制剂,FTY-720在MS的治疗中的主要机制是在体内磷酸化后,作为1-磷酸鞘氨醇(Sphingosine-1-phosphate,S1P)受体调节剂,通过与T淋巴细胞表达的鞘氨醇-1-磷酸1型受体(Sphingosine-1-phosphate receptor 1)结合,促使外周循环中T淋巴细胞归巢,以减少T淋巴细胞在中枢神经系统(CNS)中的破坏性浸润[2]。大量研究表明S1P/S1PR1信号通路在T淋巴细胞成熟、归巢以及迁移中具有核心作用[3]。因此以S1P/S1PR1信号通路上下游为靶向目标的药物研究也是目前的热点。本实验选用病理特征、生化指标、临床症状与MS相似的实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)小鼠作为动物模型[4],经外周转染携带目的基因S1PR1的慢病毒(LV-S1PR1),通过观察小鼠临床症状、脾脏中调节性T细胞比例及脊髓组织中炎症因子表达的水平,探讨外周转染LV-S1PR1对EAE小鼠发病的影响及产生该影响可能的机制,期望为S1P/S1PR1信号通路中靶向药物的研发提供实验依据及新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康雌性C57BL/6小鼠30只,购自重庆腾鑫生物技术有限公司,生产许可证号为SCXK(渝)2018-0003,周龄介于6~8周,体重16~20 g,所有小鼠饲养于温度22~26℃,相对湿度 40%~80%,明暗交替12 h的环境中,以洁净饮水和标准饲料自由饮食,实验过程符合《实验室动物饲养和操作条例》。
1.1.2 实验试剂及仪器 髓鞘少突胶质细胞糖蛋白35-55(MOG35-55)(上海吉尔生化公司),完全弗氏佐剂(CFA)、百日咳毒素(PTX)(美国Sigma公司),卡介苗(Dfico公司),S1PR1基因慢病毒(LV-S1PR1)(上海吉凯基因化学技术公司,合同编号GCPL0142868),兔抗鼠S1PR1抗体、兔抗鼠GAPDH抗体(英国Abcam公司),辣根过氧化物酶(HRP)标记山羊抗兔抗体(美国KPL公司),S1P、IFN-γ、IL-17 ELISA检测试剂盒(武汉科鹿生物科技有限责任公司),APC-CD3、PE-CD4(美国Biolegend公司);台式离心机(上海安亭科学仪器厂),恒温培养箱(上海精宏实验设备有限公司),流式细胞仪(湖南湘仪实验室仪器开发有限公司)等。
1.2 方法
1.2.1 实验分组、EAE模型建立及LV-S1PR1转染方法 将30只C57BL/6雌性小鼠随机分为空白对照组、EAE模型组及LV-S1PR1转染组,每组各10只。EAE模型组及LV-S1PR1转染组小鼠采用MOG35-55多肽免疫法制备EAE模型,用PBS(0.01 mol/ml,pH7.2)将抗原MOG35-55稀释为3 mg/ml,加入等体积完全弗氏佐剂(CFA),其中卡介苗的浓度为10 g/ml,用注射器于冰上持续抽打乳化至油包水状态,在小鼠脊柱两侧、颈部、蹊部四个点皮下注射抗原乳剂0.2 ml/只,免疫后0 h及48 h腹腔注射百日咳毒素(PTX)500 ng/只,对照组注射同等体积生理盐水。以免疫当天为第0天,免疫后第3天LV-S1PR1转染组10只小鼠通过尾静脉注射LV-S1PR1,病毒滴度为8×108TU/ml,10 μl/只,空白对照组及EAE模型组尾静脉注射同等体积的生理盐水。
1.2.2 神经功能缺损评分 第0天开始至第28天每日同一时间(上午10:00)由同一人观察各组小鼠的摄食情况、临床症状,并采用双盲法进行各组小鼠神经功能缺损评分,0分:不发病,无临床症状;1分:尾部张力降低;2分:尾部麻痹拖地、双后肢轻微无力;3分:双后肢严重无力;4分:四肢瘫痪;5分:濒死状态或发病后死亡。
1.2.3 各组小鼠外周血中S1PR1表达的检测 第28天,用10%水合氯醛麻醉小鼠后行眼球取血,使血液自然流出以防止凝血,加入冷却的PBS缓冲液低速离心收集细胞沉淀,依次加入蛋白酶抑制剂、细胞总蛋白提取试剂后冰浴30 min,再次离心收集上清,完成外周血悬浮细胞总蛋白提取,使用BCA蛋白质浓度测定试剂盒测定蛋白质样品的浓度,进行SDS-PAGE电泳,电泳后转移到PVDF膜上,将转好的膜加入封闭液室温封闭1 h后加入1∶1 000稀释的一抗(兔抗鼠S1PR1)4℃过夜,回收稀释的一抗并用TBST洗3次,加入1∶5 000稀释的二抗(HRP标记的山羊抗兔IgG),室温孵育30 min后用TBST在摇床上洗4次,将新鲜配制的ECL混合溶液滴在膜的蛋白面侧,于暗室中曝光,进行化学发光和成像,用 Alpha Ease FC 软件处理系统分析目标带的光密度值。使用GAPDA作为内参,蛋白的相对表达量用目的蛋白S1PR1 OD/GAPDH OD表示。
1.2.4 各组小鼠外周血中S1P水平的检测 用1.5 ml 灭菌EP管收集1.2.3中各组小鼠血液样本,室温放置1 h待血液凝固后,4℃ 12 000 r/min离心15 min,收集上层血清,-20℃保存备用。按照ELISA试剂盒说明书的操作检测各组小鼠外周血中S1P的水平。
1.2.5 各组小鼠脊髓组织中IL-17、IFN-γ水平的检测 完成眼球取血后的小鼠立即断头处死,在冰盘上快速分离脊髓组织,将分离得到的脊髓组织冻于液氮保存、备用。按照ELISA试剂盒说明书的操作检测各组小鼠脊髓组织中IL-17、IFN-γ水平。
1.2.6 各组小鼠脾脏中调节性T细胞的比例测定 分离取出小鼠脾脏,于细胞筛上碾碎、研磨,离心后制成单细胞悬液,每个流式样管中收集1×106个细胞,加入APC-CD3、PE-CD4抗体标记细胞,4℃避光保存孵育30 min后向管中加入200 μl PBS后上机,用流式细胞仪进行检测,并用FlowJo软件分析数据。
2 结果
2.1 各组小鼠神经功能缺损症状评价 如图1所示,正常对照组小鼠未发病,饮食活动正常,体重持续增加。EAE模型组和LV-S1PR1转染组小鼠均不同程度的发病,免疫后10 d开始,EAE组和LV-S1PR1转染组小鼠开始出现体重减轻、精神萎靡、活动减少;12 d开始,EAE组和LV-S1PR1转染组小鼠陆续发病,主要表现为尾部张力下降、单侧后肢无力,以上症状在15~26 d加重,逐渐开始出现尾部拖地、一侧肢体瘫痪或四肢瘫痪,甚至出现濒死状态;而LV-S1PR1转染组小鼠在18~24 d上述神经功能缺损症状评分较EAE组下降,EAE模型组和LV-S1PR1转染组小鼠发病的潜伏期、进展期的比较以及发病高峰期神经功能缺损评分结果见表1。
2.2 各组小鼠外周血中S1PR1表达水平的比较 使用GAPDA作为内参,空白对照组、EAE模型组、LV-S1PR1转染组小鼠外周血中S1PR1的相对表达量S1PR1/GAPDH分别为0.57±0.07、0.08±0.01、0.32±0.08。EAE模型组小鼠外周血中S1PR1蛋白相对表达量低于空白对照组(P<0.05),低于LV-S1PR1转染组(P<0.05);LV-S1PR1转染组小鼠外周血中S1PR1蛋白相对表达量低于空白对照组(P<0.05),高于EAE模型组(P<0.05)。见图2。
2.3 各组小鼠外周血中S1P水平的比较 空白对照组、 EAE模型组、LV-S1PR1转染组小鼠外周血中S1P的水平分别为(26.62±6.15)、(90.77±11.3)、(55.31±7.87)ng/ml。EAE模型组小鼠外周血中S1P的水平高于空白对照组(P<0.05),高于LV-S1PR1转染组(P<0.05);LV-S1PR1转染组小鼠外周血中S1P的水平高于空白对照组(P<0.05),低于EAE模型组(P<0.05)。
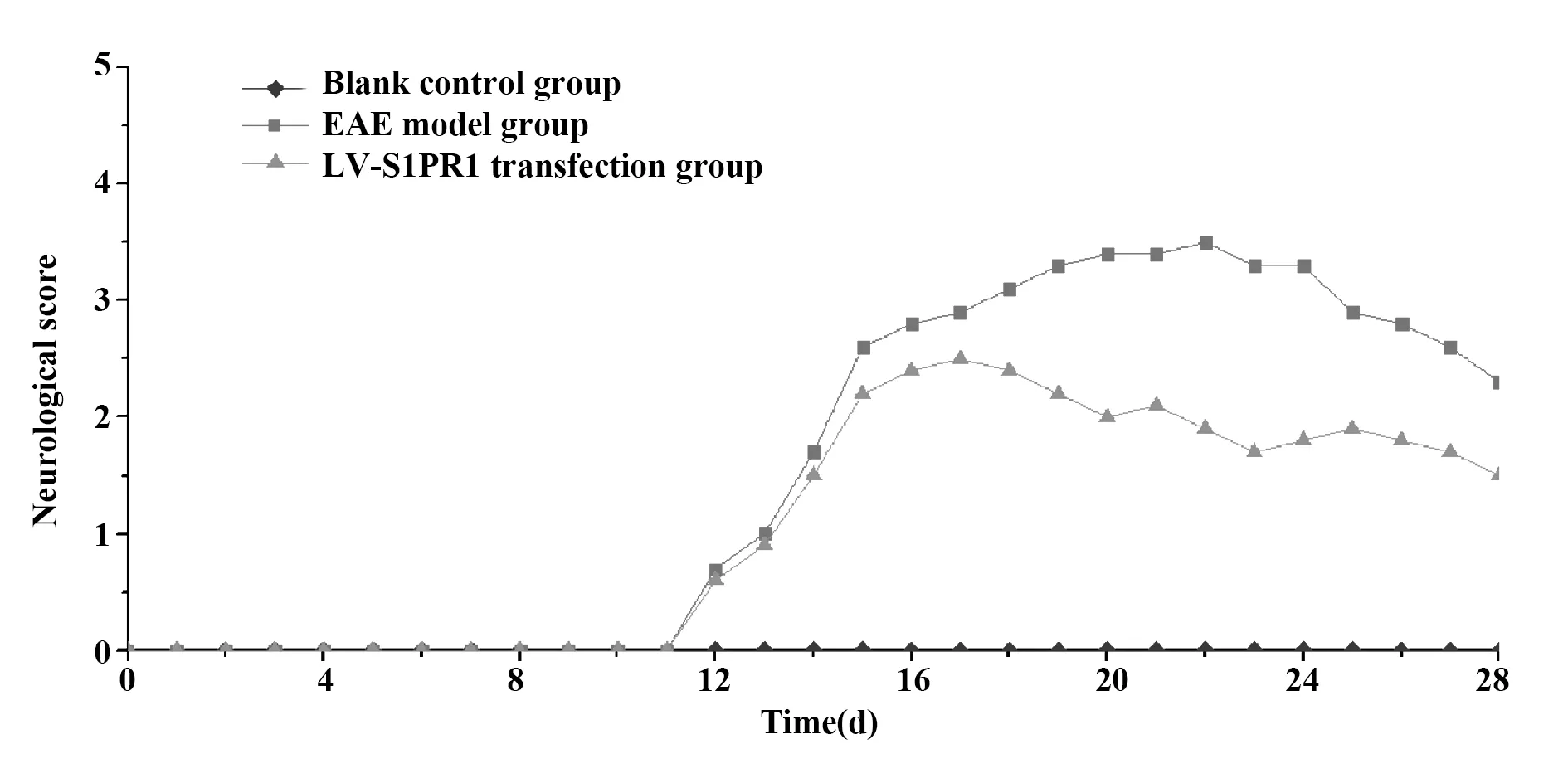
图1 神经功能缺损评分变化示意图Fig.1 Schematic diagram of changes in neurological deficit scores
2.4 各组小鼠脊髓组织中IL-17、IFN-γ水平的比较 如表2所示,EAE模型组小鼠脊髓组织中炎症因子IL-17、IFN-γ水平均高于空白对照组(P<0.05),高于LV-S1PR1转染组(P<0.05);LV-S1PR1转染组小鼠脊髓组织中IL-17、IFN-γ水平均高于空白对照组(P<0.05),低于EAE模型组(P<0.05)。
2.5 各组小鼠脾脏中调节性T淋巴细胞比例的检测 空白对照组、EAE模型组、LV-S1PR1转染组小鼠脾脏中调节性T淋巴细胞所占比例分别为(44.03±2.45)%、(64.87±2.81)%、(53.13±2.94)%。EAE模型组小鼠脾脏中的调节性T淋巴细胞比例高于空白对照组(P<0.05)和LV-S1PR1转染组(P<0.05);LV-S1PR1转染组小鼠脾脏中的调节性T细胞比例高于空白对照组(P<0.05),低于EAE模型组(P<0.05)。见图3。

GroupsIncubationperiod(d)Progressperiod(d)Neurologicaldeficit scores inpeak onset periodEAE model group10.10±1.2010.00±1.163.13±0.33LV-S1PR1 transfection group15.80±1.691)7.50±1.431)2.03±0.311)
Note:Compared with EAE model group,1)P<0.01.
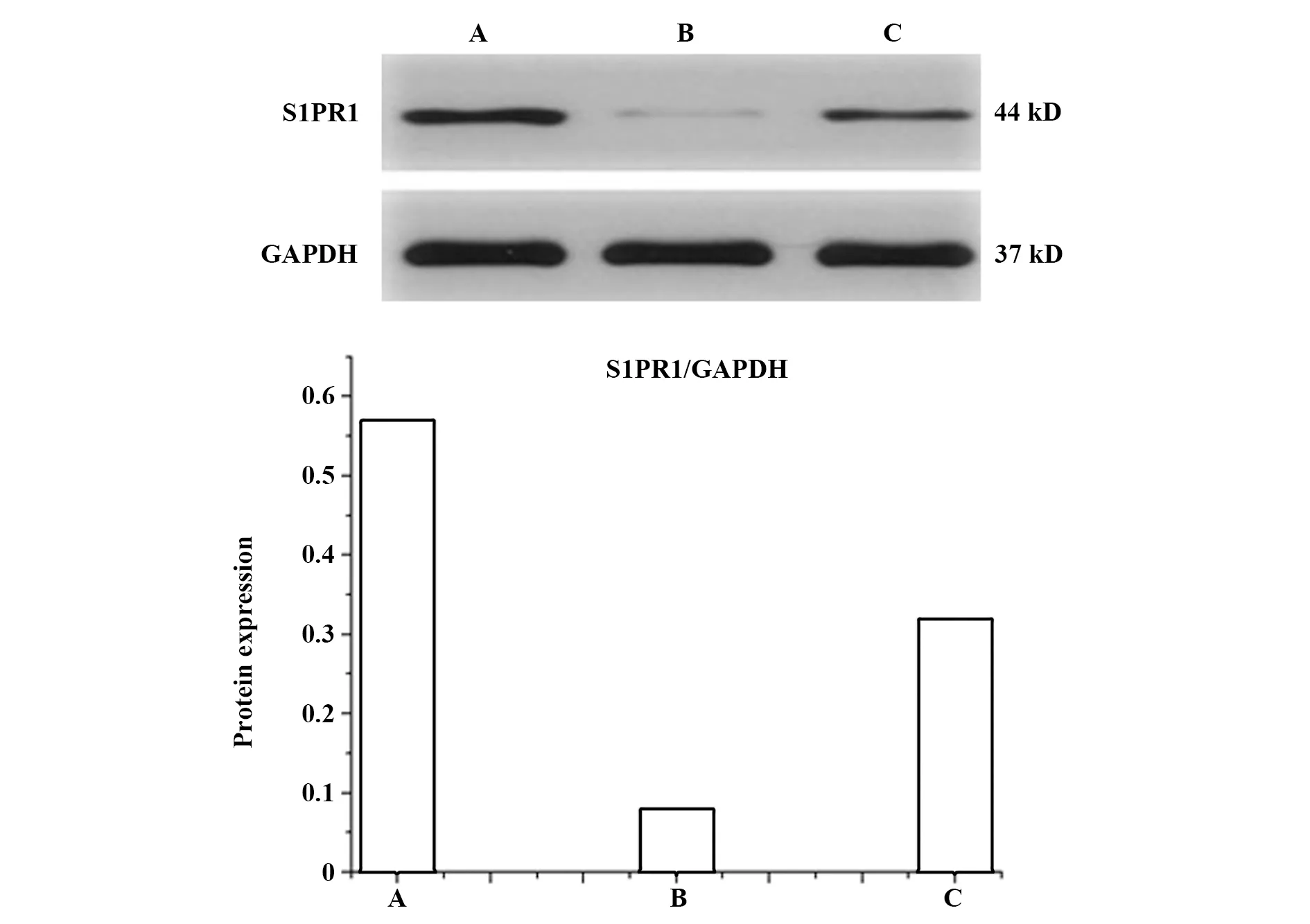
图2 各组小鼠外周血中S1PR1表达水平的比较Fig.2 Comparison of S1PR1 expression levels in peripheral blood of mice in each groupNote: A.Blank control group;B.EAE model group;C.LV-S1PR1 transfection group.
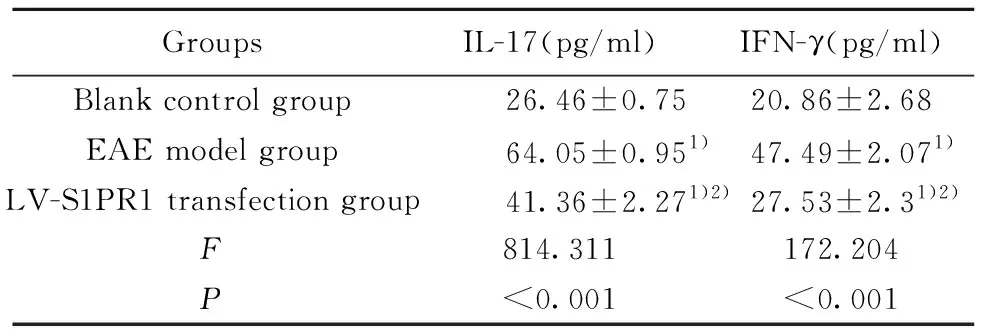
GroupsIL-17(pg/ml)IFN-γ(pg/ml)Blank control group26.46±0.7520.86±2.68EAE model group64.05±0.951)47.49±2.071)LV-S1PR1 transfection group41.36±2.271)2)27.53±2.31)2)F814.311172.204P<0.001<0.001
Note:Compared with blank control group,1)P<0.05;Compared with EAE model group,2)P<0.05.
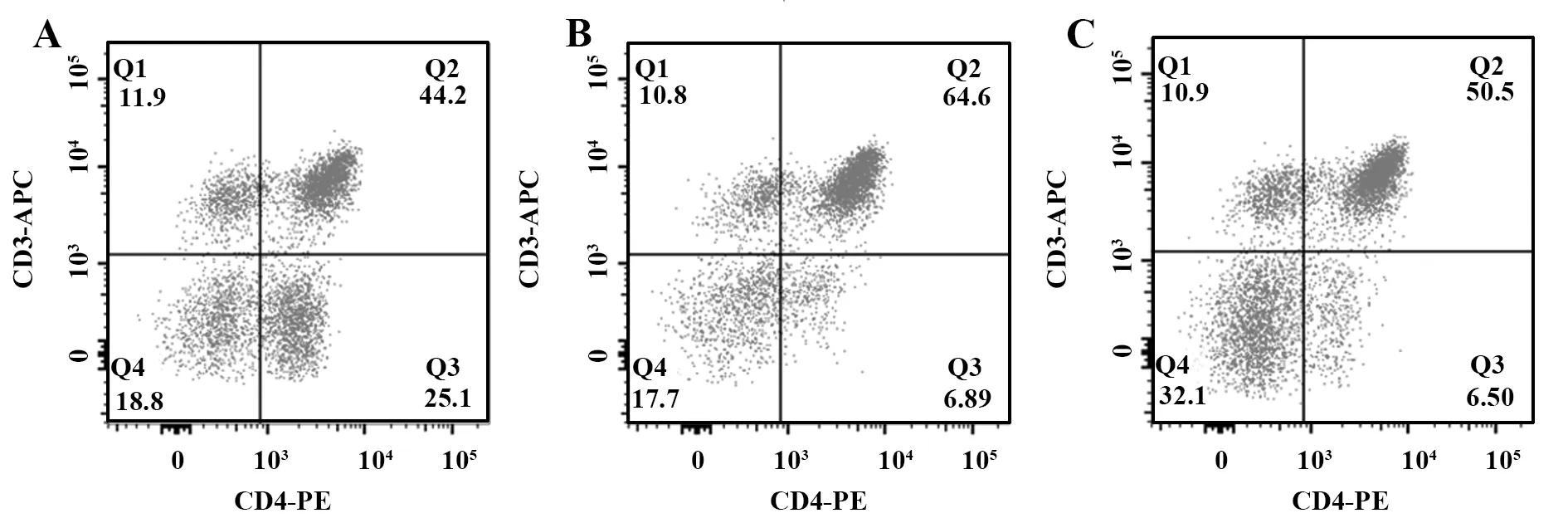
图3 各组小鼠脾脏中调节性T淋巴细胞流式细胞图Fig.3 Flow cytometry of regulatory T lymphocytes in spleens of mice in each groupNote: A.Blank control group;B.EAE model group;C.LV-S1PR1 transfection group.
3 讨论
MS的病因及具体发病机制至今尚未明确,但大量的研究已经证实,在T淋巴细胞介导下中枢神经系统(Central nervous system,CNS)发生慢性炎性脱髓鞘改变是MS的主要发病机制[5]。随着进一步研究,发现T淋巴细胞从淋巴器官、外周循环逐级迁移至CNS,最终介导CNS炎症反应发生,这一复杂过程中,S1P浓度梯度以及S1P/S1PR1之间的相互作用发挥着核心作用[3]。S1P是一种重要的内源性磷脂分子[6],在体内经鞘氨醇激酶1~2(Sphingosine kinase 1-2,SPHK1-2)磷酸化后生成,S1P通过与五种G蛋白偶联受体(S1PR1~S1PR5)结合,在免疫系统、中枢神经系统和心血管系统的正常生理和相关疾病发展过程中具有重要的调节功能[7-11],而S1PR1表达于内皮细胞、淋巴细胞、星型胶质细胞等。由于外周循环中的细胞缺乏1-磷酸鞘氨醇磷酸酶(S1P phosphatase,S1Pase)和1-磷酸鞘氨醇裂解酶(S1P lyase)两种降低S1P浓度水平的酶,因此外周循环中有着较高的S1P水平,造成胸腺、脾脏以及其他次级淋巴器官与外周循环之间存在着S1P水平梯度[12]。在MS的发病过程中,T淋巴细胞表面表达的S1PR1受到外周循环中高浓度水平的S1P吸引,由淋巴组织向外周循环逐渐迁移至CNS,最终介导炎症反应的发生。由于S1P/S1PR1信号通路在免疫系统疾病中发挥着重要生物学效应,目前选择性S1PR1调节剂、SPHK抑制剂和 S1P裂解酶抑制剂等多种以S1P/S1PR1信号通路上下游为靶向目标的药物正在研发过程中,以S1PR1调节剂的研究较为多见,而对于外周循环中总细胞S1PR1表达上调对EAE小鼠发病的影响及其作用机制的研究尚无报道,本实验经EAE小鼠尾静脉转染携带目的基因S1PR1的慢病毒,通过观察EAE小鼠的临床症状、脾脏调节性T细胞的比例及脊髓组织炎症因子的表达水平,初步探讨S1PR1基因转染对EAE小鼠发病的影响及其可能的机制。
本实验结果显示,LV-S1PR1转染组小鼠与EAE模型组小鼠相比较,LV-S1PR1转染组小鼠发病的潜伏期延长,进展期缩短,LV-S1PR1转染组小鼠发病高峰期时神经功能缺损评分较EAE模型组降低,提示外周转染LV-S1PR1对EAE小鼠的发病有防治作用。已有实验表明,在SPHK缺陷小鼠的血中不能检测到S1P的存在,外周血与胸腺之间的S1P浓度梯度改变,T淋巴细胞从胸腺迁出的过程严重受阻,当SPHK缺陷小鼠获得野生型小鼠骨髓后,外周血中S1P水平恢复,T淋巴细胞重新获得迁出胸腺的能力[13]。虽然目前T淋巴细胞从胸腺以及脾脏迁出的具体动力学过程尚未明确,但基于已有的实验结果可知外周血与淋巴器官之间的S1P浓度差是T淋巴细胞向外周迁移的必要条件。本实验观察到,LV-S1PR1转染组小鼠外周循环中S1PR1表达高于EAE模型组,而LV-S1PR1转染组小鼠外周血中S1P水平较EAE模型组小鼠降低,其机制可能是由于LV-S1PR1转染组上调了外周循环中S1PR1的表达,S1PR1与S1P结合,从而使S1P水平下降。同时,LV-S1PR1转染组小鼠脾脏中调节性T细胞比例较EAE模型组降低,其主要机制可能是LV-S1PR1转染组小鼠外周血S1P水平较EAE模型组降低,使外周循环与淋巴器官之间S1P浓度差减小,导致T淋巴细胞迁出胸腺向外周循环迁移的过程受阻,最终LV-S1PR1转染组小鼠脾脏中调节性T细胞比例下降。而调节性T淋巴细胞中CD4+T细胞在炎症反应及自身免疫疾病中发挥重要的生物学效应,CD4+T细胞可以分化为Th1、Th17细胞,而Th1、Th17细胞可以分泌IL-17、IFN-γ等炎症因子,上述炎症因子在CNS中可以激活周围的星型胶质细胞等神经胶质细胞分泌促炎症因子和趋化因子,使更多的炎症细胞经血脑屏障进入CNS导致慢性脱髓鞘的发生[14]。已有研究发现,Th17细胞可以直接入侵CNS,主要机制是Th17细胞作用于内皮细胞及小胶质细胞后加速了血脑屏障的破坏[15]。本实验中,LV-S1PR1转染组小鼠脊髓组织中炎症因子IL-17、IFN-γ水平均低于EAE模型组,可能与LV-S1PR1转染组T淋巴细胞迁移受阻、脾脏调节性T淋巴细胞比例下降,最终减少了IL-17、IFN-γ的释放有关。
在本实验中我们观察到,各组小鼠的神经缺损症状的严重程度、脊髓组织中炎症因子的表达水平以及脾脏中调节性T细胞所占比例,都与外周血S1P的水平相关,EAE模型组和LV-S1PR1转染组小鼠外周血中S1P水平均较正常对照组增高,不同程度地出现神经功能缺损的临床症状,脊髓组织中炎症因子表达以及脾脏中调节性T细胞比例增高;LV-S1PR1转染组小鼠外周血中S1P水平较EAE模型组下降,上述观察指标均有一定程度的改善。此外,有研究发现MS患者脑脊液中S1P水平较正常人增高,提出S1P可能具有较强的促炎活性以及促进星型胶质细胞增生的作用[16]。本实验中,LV-S1PR1转染组小鼠S1P水平较EAE组下降,通过减轻LV-S1PR1转染组小鼠CNS中炎症反应以及星型胶质细胞反应性增生,最终减轻CNS损伤,可能是外周转染LV-S1PR1改善EAE小鼠发病的一个重要机制。在T淋巴细胞从胸腺向外周循环、CNS迁移的过程中,T细胞S1PR1的表达以及S1P浓度梯度为两个必不可少的条件,本实验通过外周转染LV-S1PR1,上调外周循环中各细胞S1PR1的表达,一方面,外周中的T细胞S1PR1表达上调,将促进T细胞向CNS迁移,加重CNS炎症反应;另一方面,外周循环中各细胞增加表达的S1PR1与S1P结合,使循环中S1P水平下降,破坏T细胞向外周循环迁移的初始动力,使T细胞受困于胸腺等淋巴器官,将减轻炎症细胞在CNS的破坏性浸润,改善EAE小鼠的临床症状。从本实验的结果可以得出,在T细胞的迁移过程中,S1P的浓度梯度比T细胞表达S1PR1上调可能发挥更核心的作用,其具体机制有待进一步研究。
综上所述,经外周转染LV-S1PR1后EAE小鼠神经功能缺损症状改善,对EAE小鼠的发病具有防治作用,其主要机制可能是通过上调外周循环中S1PR1的表达,结合S1P后使S1P水平下降,打破淋巴器官与外周循环之间S1P浓度差,使T淋巴细胞向外周循环迁移的初始动力减弱、迁移受阻,最终减轻CNS炎症反应。本实验观察到S1P水平在EAE发病过程中的重要生物学效应,使其在MS以及其他自身免疫性疾病中可能成为一种具有巨大潜力的治疗靶点,更有望成为评估疾病活动程度、治疗进展的一种生物标志物,对S1P/S1PR1信号通路中靶向药物的研发提供新的思路。
