IL-1β表达水平与广西肝癌家族聚集性的相关性①
2019-08-12彭金林李国坚吴继周吴健林席玉梅
彭金林 李国坚 吴继周 吴健林 席玉梅 黄 斌 王 磊
(广西医科大学第一附属医院感染性疾病科,南宁530021)
原发性肝细胞癌(Hepatocellular carcinoma,HCC)简称肝癌是临床上最常见的一类高度恶性肿瘤,具备侵袭转移早、病程发展快、容易复发、预后极差等特征性临床表现。全球肝癌病死率最高的区域为非洲、东南亚国家和中国等发展中国家[1]。我国的肝癌发病人数约占世界范围内肝癌患者总数的半数以上(约为55%)。既往流行病学调查数据表明,肝癌的发病呈地区性分布不均匀特征,我国的肝癌高病死率地域主要分布于江苏、广东、广西等东南沿海一带[2]。本课题组前期研究发现,在广西肝癌流行地区中,肝癌家族性发病的情况屡见不鲜[3]。已有研究表明,肝癌是一种炎症相关性疾病,肝癌的发生和演变与肝癌细胞赖以生存的肿瘤免疫微环境密切相关。肿瘤微环境主要是由肿瘤细胞、炎症免疫细胞、炎性因子、趋化因子、细胞因子、细胞外基质成分等相互作用而形成的复杂免疫调控网络,该肿瘤免疫微环境在帮助肿瘤细胞逃避免疫系统破坏、诱导血管生成、抗凋亡、加速肿瘤增殖、侵袭浸润和转移等方面起着重要作用[4]。IL-1β作为炎症微环境中促炎性细胞因子的重要成员,该因子也参与介导肝癌的形成和侵袭转移过程[5]。但目前尚未见有文章报道研究该免疫因子与肝癌家族性发病的关联性。本研究旨在探讨机体免疫系统促炎因子IL-1β与广西的壮、瑶族人群肝癌家族聚集性的关系,发现肝癌临床诊治新的潜在靶标。
1 资料与方法
1.1 一般资料 在广西肝癌高流行地域选择来源于18个肝癌高发家系(有血缘关系的直系亲属人群中发现不少于2名肝癌患者的家系成员)成员(n=120)作为实验组。先证者的概念为肝癌高发家系中被确诊为肝癌患者的个体。年龄2~78岁,平均(31.5±17.5)岁,其中男62例、女58例;年龄≤25岁51例,>25岁69例;瑶族28例,壮族92例;HBsAg阳性36例,阴性84例;高发家族成员包括肝癌患者的直系一级亲属(父母、同胞、子女)成员44例,直系二级亲属(祖父母、姑伯叔、姨舅、外祖父母)成员23例,直系三级亲属(表、堂姐妹,表、堂兄弟等)成员13例,直系四级亲属成员40例。高发家族成员中有2~3个肝癌病例为35例,有4个及以上肝癌病例85例。以近似相同生活背景、HBsAg、民族、性别、年龄相距±5岁且与高发人群没有血缘关系作为匹配条件。选择无癌家系(有血缘关系的直系亲属人群中的家系成员均无任何癌症病史)成员(n=120)作为对照组,年龄4~80岁,平均(32.2±17.4)岁。全部入选人员均未感染丙型肝炎病毒(HCV)。
1.2 方法
1.2.1 样本采集及处理方法 于清晨时采集每位受检者空腹外周静脉血液标本3 ml注入干燥试管中,常温下静置1 h,室温下3 000 r/min离心5 min分离血清,用移液枪抽吸上层血清20 ml,放置于冻存管内进行分装、编号,加盖密封,于-80℃超低温冰箱冰冻保存待测。
1.2.2 IL-1β表达水平检测方法 应用酶联免疫吸附试验(ELISA)技术测定所有受检标本外周血IL-1β含量。严格ELISA试剂盒(上海酶联生物技术有限公司)使用操作方法进行操作,运用美国伯乐Bio-Rad i Mark全自动酶标仪测定被检测标本吸光度(OD)值。
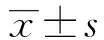
2 结果
2.1 两组血清IL-1β总体含量的比较 实验组与对照组血清IL-1β总体含量分别为21.495(15.275,36.040)、14.745(10.115,19.075)pg/ml,两组间相比较,实验组血清IL-1β含量明显高于对照组,差异有统计学意义(Z=-4.777,P=0.000<0.05)。
2.2 两组血清IL-1β含量一般人口学特征的比较 从不同人口学特征(性别、年龄、民族及HBsAg感染情况)分层对比实验组与对照组血清IL-1β含量,结果显示实验组血清IL-1β测定结果均高于对照组,差异具有统计学意义(P均<0.05)。见表1。
2.3 实验组中先证者的各级亲属成员血清IL-1β含量的比较 实验组中先证者各级亲属家族成员之间血清IL-1β含量相比较,经统计学分析,各组间含量差异无统计学意义(Z=1.648,P=0.642>0.05)。见表2。
2.4 实验组中先证者例数与血清IL-1β含量的关系 实验组中有2~3个先证者、4个及以上先证者的家族成员血清IL-1β含量分别为20.150(11.300,40.450)、21.900(16.962,33.850) pg/ml,经统计学对比实验结果差异无统计学意义(Z=-1.331,P=0.183>0.05)。
表1 两组受检者血清IL-1β表达分层比较[M(P25,P75),pg/ml]
Tab.1 Hierarchical comparison of serum IL-1β expression between two groups[M(P25,P75),pg/ml]
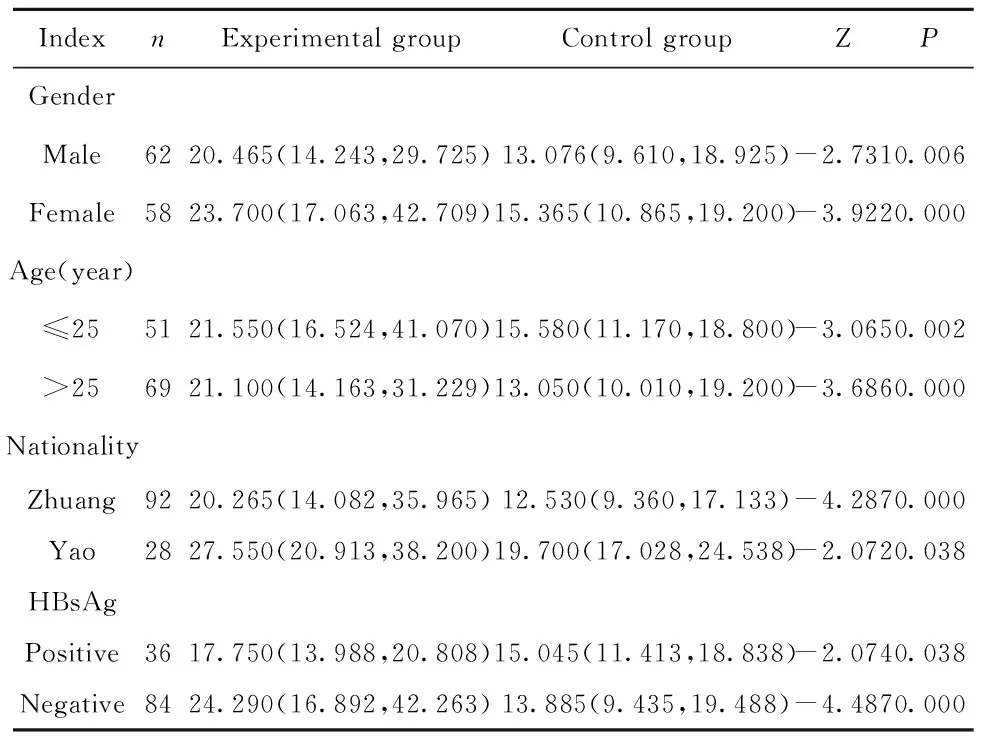
IndexnExperimental groupControl groupZPGenderMale6220.465(14.243,29.725)13.076(9.610,18.925)-2.7310.006Female5823.700(17.063,42.709)15.365(10.865,19.200)-3.9220.000Age(year)≤255121.550(16.524,41.070)15.580(11.170,18.800)-3.0650.002>256921.100(14.163,31.229)13.050(10.010,19.200)-3.6860.000NationalityZhuang9220.265(14.082,35.965)12.530(9.360,17.133)-4.2870.000Yao2827.550(20.913,38.200)19.700(17.028,24.538)-2.0720.038HBsAgPositive3617.750(13.988,20.808)15.045(11.413,18.838)-2.0740.038Negative8424.290(16.892,42.263)13.885(9.435,19.488)-4.4870.000
表2 实验组先证者各级亲属血清IL-1β表达的比较[M(P25,P75),pg/ml]
Tab.2 Comparison of serum IL-1β expression among relatives of probands in experimental group[M(P25,P75),pg/ml]

GradenIL-1βFirst-degree relatives4420.683(14.001,30.568)Second-degree relatives2320.575(15.563,40.955)Third-degree relatives1321.550(20.380,52.100)Fourth-degree relatives4021.925(15.223,39.913)Z1.648P0.642
表3 实验组血清IL-1β表达水平的影响因素
Tab.3 Influencing factors of serum IL-1β expression in experimental group
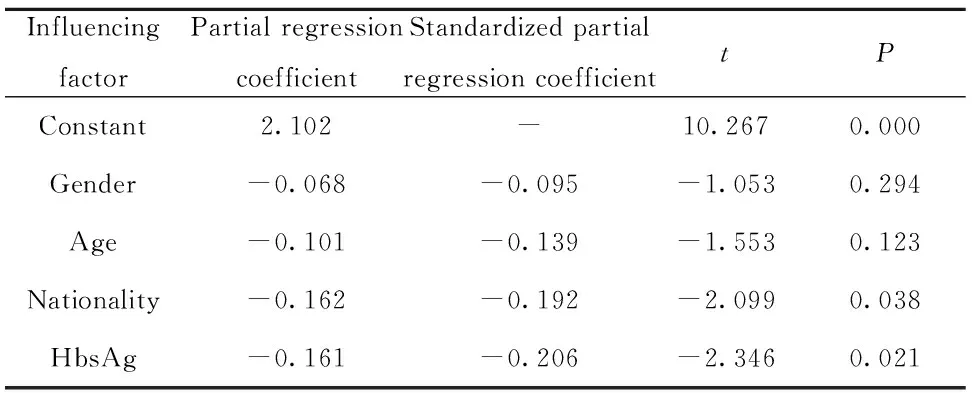
InfluencingfactorPartial regressioncoefficientStandardized partialregression coefficienttPConstant2.102-10.2670.000Gender-0.068-0.095-1.0530.294Age-0.101-0.139-1.5530.123Nationality-0.162-0.192-2.0990.038HbsAg-0.161-0.206-2.3460.021
Note:αin=0.05,αout=0.1.
2.5 实验组中先证者性别比较 实验组研究对象共选自18个肝癌高发家系,其家族中先证者共有60例,其中男46例,女14例,男性、女性发病率分别为76.667%、23.333%,肝癌病发率男性远高于女性。
2.6 实验组血清IL-1β水平的影响因素分析 将实验组血清IL-1β表达水平的对数值设为因变量,将单因素分析中有统计学意义的影响因素(包括民族、性别、年龄、HbsAg携带情况)分别设为自变量,采用进入法引入多元线性回归分析模型,回归模型有统计学意义(F=3.782,P=0.006)。结果显示:民族、HBsAg携带情况对血清IL-1β表达水平的影响具有统计学意义(P<0.05),提示在肝癌高发家族中瑶族成员与壮族成员相比较,IL-1β因子表达水平更高;HBsAg阴性人员与HBV携带者相比较,IL-1β因子测定结果更高。见表3。
3 讨论
肝癌是全球多见的一类消化系统恶性程度极高的肿瘤,癌症相关死因中高居世界第三位,仅次于肺癌和胃癌,全球病死率呈现出逐步上升的流行趋向。机体内肝脏存在着非常复杂的免疫系统,肝癌的发病与演化是多因素相互作用介导的分阶段复杂病理过程,近年来,随着对肝癌病因与发病机制认识的逐步深入,人们发现免疫因素与肝癌关系极为密切。肿瘤微环境可通过促进恶性病变细胞增殖、破坏获得性免疫应答,使肿瘤细胞逃逸固有免疫应答的监视等一系列过程影响着肿瘤的发生发展。
IL-1细胞因子家族包括IL-1β、IL-1α和IL-1Ra,其中因子IL-1β与肿瘤的发病与演化关系最为密切。IL-1β作为IL-1细胞因子家族的重要组成成员之一,主要由炎症状态下或者免疫反应中激活的单核细胞、巨噬细胞分泌并释放的重要高反应促炎性细胞因子,其生物学功能呈现出多效性,是机体调控免疫应答与炎症反应的关键因子。一方面,可通过协同作用刺激特异性T淋巴细胞活化,激活NK细胞,在介导和调节天然和获得性免疫应答过程中发挥重要作用,行使清除恶变细胞和抵御病原体感染的功能,促进受损组织的修复。另一方面,IL-1β作为白介素类因子作用最强的炎性介质之一,可通过诱导其他炎症介质、促炎性细胞因子和趋化因子的释放,在各种急慢性炎症反应中发挥关键作用,致使炎症组织损伤和组织破坏的扩大,是进而导致肿瘤发生和生物学行为恶化的重要因素[6]。近年来多项研究报道发现,促炎性细胞因子IL-1β作为肿瘤免疫微环境的重要成员之一,该因子在肝癌、胃癌、肺癌、乳腺癌、恶性黑色素瘤、结肠癌等多种恶性肿瘤环境中高水平表达[5,7-11],提示细胞因子IL-1β可能通过启动抗凋亡、肿瘤增殖、血管生成、免疫逃避和侵袭转移等系列过程参与多种肿瘤性疾病的发生发展。因此,炎症相关因子IL-1β作为重要的促癌因素存在于肝癌免疫微环境中,是引起肝脏肿瘤的重要诱因,但国内外尚未有报道研究该因子表达与肝癌家族性聚集高发的关联性。
本实验研究结果显示,肝癌高发家系成员外周血IL-1β因子测定含量明显高于无癌家系成员,深入分层分析发现,肝癌高发家族成员从一般人口学特征的不同层面(包括性别、年龄、民族、HBV感染情况)上分别进行对比,检测结果均明显高于无癌家族成员(P均<0.05),提示血清IL-1β过量表达与广西壮、瑶族家系肝癌聚集发病紧密相关,据此推测在癌变发生前,肝癌高发家系未患癌成员体内免疫自稳状态已轻微失衡,究其缘由可能与遗传效应、基因变异等因素相关,仍需深层次探究。有学者发现肝癌患者体内血清IL-1β高表达,促炎因子IL-1β通过IL-1β/IRAK-1信号通路,促使肝癌的产生与演变[5]。另有研究报道认为IL-1β31T/C基因多态性与肝细胞癌发生发展紧密相关[12]。由此提示IL-1β是诱发肝癌罹患阈值降低的危险性因子。对于IL-1β促肿瘤效应的调节机制有多种观点。相关医学研究资料证明,机体内丰富的NK细胞聚集存在于肝脏组织中,数量约占肝脏淋巴细胞总量的30%~45%左右,肝脏天然免疫细胞(包括NK细胞)作为抗肿瘤免疫防御的第一道防线,还肩负启动适应性免疫应答的重任,是影响肿瘤生长和免疫逃逸的关键因素[13]。促炎性因子IL-1β主要通过抑制机体内固有免疫NK细胞的杀伤活性来发挥促肿瘤效应,导致肿瘤细胞发生免疫逃逸,促进肝癌细胞的生长繁殖[14],靶向阻断IL-1β作用可加强NK细胞对HCC细胞的免疫杀伤敏感性[15],另有研究报道指出,IL-1β可介导下游促炎因子如IL-6,IL-8等表达,致使细胞因子发生级联瀑布反应,介导炎症级联反应失衡,间接为肿瘤的生存和进展提供条件[16]。同时,也有越来越多研究认为炎症因子IL-1β可通过介导活化的PI3K、JAK/STAT、P38MAPK通路及NF-κB等重要信号转导通路直接或间接致癌[17]。提示肝癌高发家族成员体内IL-1β高表达会干扰机体抗肿瘤免疫应答功能,促进家族聚集性肝癌的发病。推测IL-1β高表达可能增加易罹患肝癌风险,但仍需考虑若干未知的不明确混杂因素的影响导致肝癌高发家族成员IL-1β过量表达。
已知肝炎病毒感染(特别是HBV和HCV感染)是肝癌发病的首要危险因素[18]。本研究比较两组HBsAg阳性和阴性成员IL-1β表达水平,结果发现高发家族均显著高于无癌家族成员;同时多因素分析显示,高发家族中HBsAg阴性成员较HBsAg阳性成员IL-1β表达水平更高。由此结果提示,感染HBV病毒对IL-1β表达无显著影响。在癌变发生前,机体内的肿瘤相关免疫微环境稳态已经被打破,提示可能是因遗传物质的先天易感性致使肝癌高发家族成员在癌变发生前免疫微环境失衡进而易形成家系肝癌聚集发病,而非HBV感染导致肝癌高发家族成员免疫状态失衡进而导致家系肝癌聚集发病,由此推测IL-1β因子与家系肝癌聚集发病的关系与HBV病毒感染情况无直接关联。研究结果显示,肝癌高发家族先证者不同级别亲属与血清IL-1β表达水平无明显相关(P>0.05);同时也显示,肝癌高发家族出现2~3例先证者成员的血清IL-1β含量与肝癌高发家族出现4例及以上先证者成员的血清IL-1β表达水平亦无明显差异(P>0.05),结果提示肝癌家庭聚集性可能与高发家系中先证者亲属级别、先证者个数无关,但还需扩大样本量或者扩展至基因分子水平继续深入研究才能得出结论。本实验研究中共有先证者60例(选自18个肝癌高发家系),男性肝癌病发的几率远远超过女性,与国内的研究报道相一致[19],提示男性体内免疫微环境细胞因子改变可能相对女性更显著。
综上所述,由本实验结果分析可以看出,肝癌高发家系人群外周血IL-1β表达明显高于无癌家系人群,提示IL-1β在机体内过量表达可能与广西壮、瑶族家系肝癌聚集发病存在一定程度的关联,推测在癌前状态时,高发家族成员的免疫自稳状态已失衡,而并非在肝脏细胞癌变后缓慢发生的,癌变前存在的免疫环境异常增加了高发家系成员罹患肝癌的易感性,但具体的免疫调控机制仍需更深入的研究。
