miR-21调控TIMP-3影响LPS诱导下RAW264.7细胞中MMP-2和MMP-9表达①
2019-08-12龙春艺廖品琥
陈 翔 黄 莹 龙春艺 廖品琥
(右江民族医学院附属医院呼吸科,百色533000)
脓毒症是感染引起的全身性炎症反应综合征,其发病率高,病死率高,已成为重症加强病房面临的首要问题[1]。脓毒症的主要机制为过度激活的炎症反应及伴随的免疫功能抑制。目前缺乏有效治疗脓毒症的手段,因此人们尝试以免疫调节方式治疗脓毒症。
巨噬细胞通过趋化、迁移,到达受损部位并释放炎症介质参与调节脓毒症免疫反应[2],其具体机制尚未完全阐明。基质金属蛋白酶(Matrix metallopro-teinase,MMPs)是一类可以降解细胞外基质(Extra-cellular matrix,ECM)的金属蛋白酶,其中MMP-2、MMP-9可以通过分解ECM的主要成分Ⅳ型胶原参与ECM重塑,并进一步影响巨噬细胞趋化、迁移和免疫功能的调节,但具体机制尚未阐明[3]。miRNA是一类非编码调控RNA,其中miR-21可以通过调控ECM相关基因参与脓毒症心脏损伤,然而miR-21在巨噬细胞ECM重塑中的作用和潜在机制尚不清楚[4]。
迄今为止,尚无关于miR-21和MMP-2、MMP-9在巨噬细胞中表达水平及机制的明确报道。本研究通过探讨miR-21对LPS刺激下RAW264.7细胞中MMP-2、MMP-9表达的影响,进一步研究miR-21的可能调控机制,为临床诊断和治疗脓毒症提供新策略。
1 材料与方法
1.1 材料 RAW264.7细胞从上海中国科学院细胞库购买。超微量紫外分光光度器(德国 Beckman 公司),实时荧光定量聚合酶链反应仪、Western电泳仪、Western转膜仪(美国 Bio-Rad公司),酶标仪(Thermo fisher scientific公司),全自动凝胶成像系统 JS-680B(上海培清科技有限公司)。MMP-2、MMP-9 ELISA试剂盒(美国R&D公司),IL-6、TNF-α ELISA试剂盒(南京建成公司),PCR引物、miRNA提取试剂盒、反转录试剂盒和荧光定量试剂盒(北京天根科技公司),抑制剂、模拟物和对照物(上海吉码公司),MMP-2、MMP-9和TIMP-3一抗(美国Abcam公司)。
1.2 方法
1.2.1 细胞培养 将RAW264.7细胞种于含10%胎牛血清的高糖DMEM 培养基中,置于37℃、5%CO2恒温培养箱中,每2 d换液1次,根据细胞生长情况进行传代。
1.2.2 细胞模型建立及转染 RAW264.7细胞使用含10%FBS DMEM培养基在37℃、5%CO2条件下进行培养。将密度为1.0×105个/ml的RAW264.7细胞接种于6孔板中过夜,再加入10 μg/ml LPS刺激24 h构建脓毒症模型。在含有细胞的1 500 μl培养基的培养孔中加入miR-21-mimic/inhibitor与lipo 2000混合液混匀;培养6 h后,将含混合液的培养基移去,更换新鲜培养基,加入10 μg/ml LPS,将培养板置于37℃培养箱中培养24 h。
1.2.3 ELISA检测MMP-2、MMP-9、IL-6和TNF-α蛋白表达 按照ELISA试剂盒说明书检测各组MMP-2、MMP-9、IL-6和TNF-α表达水平。
1.2.4 qRT-PCR 取传3~8代的RAW264.7 细胞按 6×105个/孔数量接种于6孔板中,37℃、5%CO2恒温孵箱中培养 12 h后,去掉培养基。LPS组加入10 μg/ml LPS,对照组加入等量PBS,刺激6 h后用离心柱法提取总RNA,再严格按照反转录和荧光试剂盒说明进行逆转录和荧光。以U6为内参,数据采用2-ΔΔCt法进行分析。
1.2.5 Western blot检测蛋白表达 取对照组LPS刺激后24 h的各组细胞,加入细胞裂解液后提取蛋白,并用BCA法检测蛋白浓度,取50 μg蛋白样品进行SDS-PAGE电泳,电泳结束后转膜至PVDF膜,室温封闭1 h,加入MMP-2、MMP-9和TIMP3一抗4℃孵育过夜,TBST清洗3次,每次10 min。加入二抗室温孵育1 h,TBST清洗3次,每次10 min。洗膜结束后用凝胶成像系统进行显影。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参(稀释比例:一抗MMP-2为1∶1 000,MMP-9为1∶1 000,TIMP-3为1∶1 000,GAPDH为1∶5 000,二抗为1∶5 000)。
2 结果
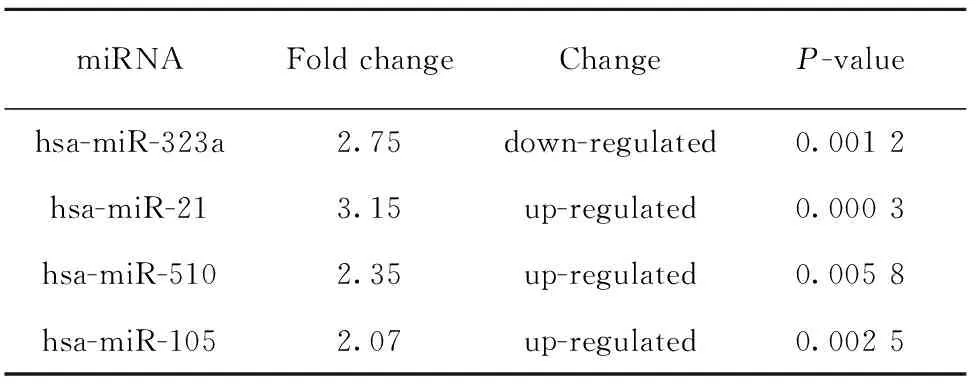
2.1 脓毒症相关miRNA生物信息学分析 本研究通过在 GEO 数据库中检索关键词“sepsis”、“sepsis microRNAs”并补充检索了Google Scholar和百度学术,不同时间分别检索2次,没有语言限制,最终入选的数据集为GSE94717。标本分别来自健康人和脓毒症患者,应用3例健康人和6例脓毒症患者样本的标准化表达数据,根据是否有统计学意义(P<0.05)及差异倍数(>2)进行分析筛选,符合条件的差异表达 miRNA 共有165个,部分差异miRNA(根据差异倍数大小和改变趋势筛选)表达情况见表1。结合前期研究基础和文献分析结果选取miR-21作为研究对象。
2.2 miR-21对IL-6和TNF-α表达的影响 为了研究miR-21对IL-6和TNF-α表达的影响,LPS刺激下的RAW264.7细胞分别经miR-21 mimic、miR-21 inhibitor和对照处理,ELISA检测细胞上清中IL-6和TNF-α表达,见表2。通过miR-21 inhibitor抑制miR-21表达,IL-6和TNF-α表达升高;通过miR-21 mimic外源性上调miR-21,IL-6和TNF-α表达降低,差异具有统计学意义(P<0.05)。表明miR-21可以影响IL-6和TNF-α表达。
2.3 各组miR-21和MMP-2、MMP-9表达及相关性分析 与对照组相比, 10 μg/ml LPS组RAW264.7细胞MMP-2、MMP-9表达升高,差异有统计学意义(P<0.05),见表3、图1;LPS组miR-21的表达水平比对照组明显升高,差异有统计学意义(P<0.05),见表3。经Pearson相关性分析显示,LPS组中miR-21与MMP-2、MMP-9的表达呈正相关(r=0.462,r=0.643,P<0.05), 见图2、3结果提示miR-21和MMP-2、MMP-9表达相关,且二者之间可能存在表达调控关系。
表1 GSE94717中部分差异表达的miRNA
Tab.1 Differentially expressed miRNA in GSE94717
miRNAFold changeChangeP-valuehsa-miR-323a2.75down-regulated0.001 2hsa-miR-213.15up-regulated0.000 3hsa-miR-5102.35up-regulated0.005 8hsa-miR-1052.07up-regulated0.002 5
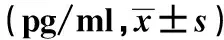


Inflammatory factorNCLPSLPS+mimic controlLPS+miR-21 mimic LPS+inhibitor controlLPS+miR-21 inhibitorIL-639.51±10.05113.68±34.56124.52±27.6695.04±10.231)118.92±20.97145.78±48.721)TNF-α84.90±32.90346.51±39.032)235.26±51.00308.62±711.141)2)340.27±51.55517.18±55.331)3)
Note:Compared with the negative control group,1)P<0.05;compared with the LPS+mimic control group,2)P<0.05;compared with the LPS+inhibitor control group,3)P<0.05.
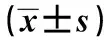
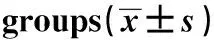

GroupsmiR-21(2-ΔΔCt)MMP-2(ng/ml)MMP-9(ng/ml)NC1.00±0.0036.90±6.8281.43±17.94LPS2.89±0.441)97.03±6.141)345.20±94.651)
Note:Compared with the negative control group,1)P<0.05.
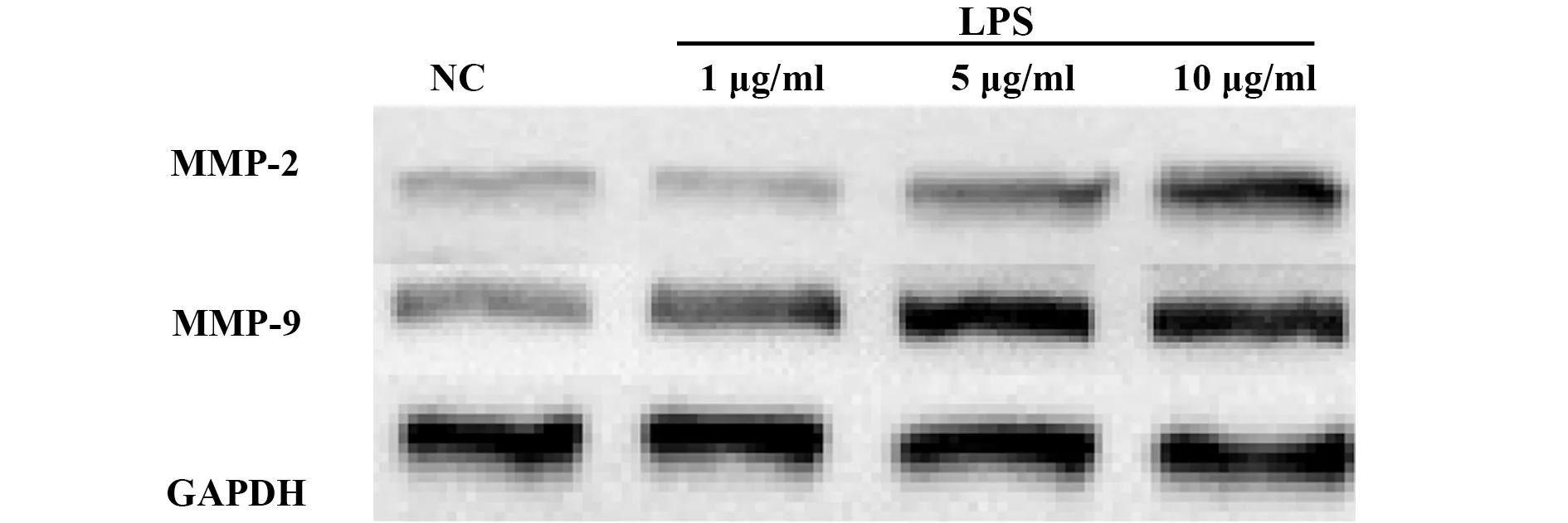
图1 不同剂量LPS对RAW264.7细胞 MMP-2、MMP-9表达的影响Fig.1 Effects of different doses of LPS on expression of MMP-2 and MMP-9 in RAW264.7 cells
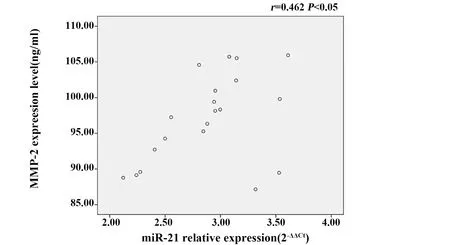
图2 LPS组miR-21与MMP-2表达相关性分析Fig.2 Correlation analysis between miR-21 and MMP-2 expression in LPS group
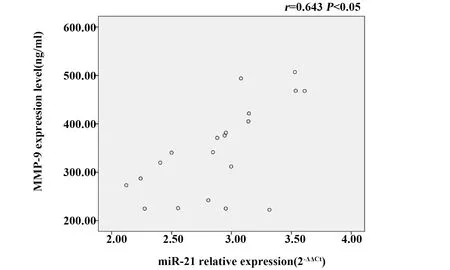
图3 LPS组miR-21与MMP-9表达相关性分析Fig.3 Correlation analysis between miR-21 and MMP-9 expression in LPS group

图5 生物信息学分析预测结果Fig.5 Bioinformatics analysis prediction results
2.4 miR-21促进LPS刺激下RAW264.7细胞MMP-2、MMP-9表达 为了研究miR-21和MMP-2、MM-9之间的调控关系,LPS刺激下的RAW264.7细胞分别经miR-21 mimic、miR-21 inhibitor和对照处理,Western blot检测MMP-2、MMP-9蛋白表达,结果见图4。通过miR-21 inhibitor抑制miR-21表达,MMP-2、MMP-9蛋白表达下降;通过miR-21 mimic外源性上调miR-21,MMP-2、MMP-9蛋白表达升高,差异具有统计学意义(P<0.05)。表明miR-21可以调控MMP-2、MMP-9蛋白的表达。
2.5miR-21调控 TIMP-3促进LPS刺激下RAW 264.7细胞MMP-2和MMP-9表达 为了探索miR-21调控MMP-2、MMP-9表达的机制,利用miRanda和TargetScan进行miR-21靶基因分析,结果显示miR-21与MMP-2、MMP-9的抑制物TIMP-3序列高度互补,TIMP-3可能为miR-21的靶基因,见图5。LPS刺激下RAW264.7细胞分别经miR-21 mimic、miR-21 inhibitor和对照处理,Western blot检测TIMP-3表达,见图4。抑制miR-21表达,TIMP-3表达上升;miR-21表达升高,TIMP-3表达降低,差异具有统计学意义(P<0.05)。而TIMP-3是MMP-2、MMP-9的内源性抑制物,提示miR-21可能通过调控TIMP-3参与LPS刺激下RAW264.7细胞MMP-2、MMP-9蛋白的表达。
3 讨论
脓毒症后期免疫抑制是导致脓毒症患者死亡的主要原因,由于缺乏有效的救治手段,因此免疫调节成为脓毒症治疗的新策略。本研究探讨miR-21对脓毒症RAW264.7巨噬细胞模型中MMP-2、MMP-9表达的影响,并进一步探索miR-21的免疫调控机制,探索脓毒症治疗新策略。
首先,LPS刺激下MMP-2、MMP-9的表达升高。MMP-2、MMP-9可以分解ECM的主要成分Ⅳ型胶原,被认为是一种具有潜在诊断价值的脓毒症标志物,然而MMP-2、MMP-9在脓毒症巨噬细胞模型中的表达水平尚不清楚。通过构建脓毒症巨噬细胞模型,在LPS刺激下,RAW264.7细胞中MMP-2、MMP-9蛋白表达上升,提示MMP-2、MMP-9可能参与脓毒症中巨噬细胞ECM重塑,同时MMP-2、MMP-9表达随LPS浓度上升而升高,提示MMP-2、MMP-9的表达水平可能与脓毒症中巨噬细胞的免疫功能有关。这与既往研究结果一致,既往研究结果发现,与血清MMP-2、MMP-9低水平的脓毒症患者相比,高水平MMP-2、MMP-9提示患者预后不良[5],且发生多器官功能障碍综合征的可能性升高[6,7]。
其次,LPS诱导MMP-2、MMP-9表达升高的同时,也介导miR-21表达上升。miR-21通过抑制其靶基因的表达参与调控免疫反应,但其在脓毒症免疫反应与损伤过程中所发挥的具体作用仍然需要深入研究。通过基因芯片分析,我们发现miR-21在脓毒症患者中差异表达,然而miR-21在巨噬细胞中的表达变化和具体作用尚不清楚。通过构建脓毒症巨噬细胞模型,我们发现LPS刺激下的RAW264.7细胞miR-21表达上调,这与生物信息学分析的结果一致。然而,此结果与先前的一项结果有所相悖。该研究观察到使用LPS刺激后,miR-21随时间改变而动态变化,6 h内miR-21表达改变无统计学意义[8]。导致本研究结果与该项研究相悖的原因有以下可能:①使用不同类型的细胞进行研究:巨噬细胞的功能会因为来源、组织特异性和激活方式的不同而不同,且LPS的促炎症作用具有细胞特异性,本研究使用的是RAW264.7细胞,而该研究使用的是肺泡巨噬细胞NR8383。②LPS干预剂量差异:LPS的促炎症作用具有剂量依赖性,不同剂量的LPS具有不同的生物学作用,低剂量LPS主要是促进细胞增殖,而高剂量LPS则可诱导炎症反应,本研究依据课题组前期研究基础选取10 μg/ml的LPS,而该研究采用的LPS浓度为1 μg/ml。
miR-21通过抑制靶基因表达参与脓毒症炎症反应,然而其在炎症反应中的具体作用尚属未知。通过外源性干扰改变miR-21表达,结果发现外源性升高miR-21表达抑制IL-6和TNF-α的表达。相反,抑制miR-21表达则升高IL-6和TNF-α的表达。然而此结果与先前的一项结果相悖。该研究观察到在脓毒症小鼠模型中,miR-21可通过抑制IL-35的表达发挥促炎作用[9]。导致本研究结果与该研究相悖的原因有以下可能:①使用不同类型的脓毒症模型进行研究,该研究选取脓毒症小鼠模型作为研究对象,而本研选取脓毒症细胞模型作为研究对象。动物实验干扰因素较多,而本实验选取LPS干预体外细胞,干扰因素较少。②miR-21作用的多样性,脓毒症的发生发展是多因素调控结果,miR-21可通过结合不同的靶基因在脓毒症中产生不同的效应。而miR-21与何种靶基因结合发挥促炎或抗炎效应,则依赖于脓毒症的进程与微环境变化。
再次,LPS诱导miR-21和MMP-2、MMP-9表达上升,且两者之间呈正相关,但两者之间是否存在调控关系尚不清楚。在本研究中,通过外源性干扰改变miR-21表达,结果发现外源性升高miR-21促进MMP-2、MMP-9的表达。相反,抑制miR-21则降低MMP-2、MMP-9的表达。这与既往研究结果一致,既往研究观察到在人骨肉瘤U20S细胞中,miR-21能通过升高MMP-2、MMP-9表达促进U20S侵袭[10]。同时在大鼠心肌纤维化模型中,miR-21通过促进MMP-2表达减少ECM生成[11]。这些结果表明miR-21可以调控MMP-2、MMP-9表达,但调控机制尚不明确。
最后,为了进一步研究miR-21调控MMP-2、MMP-9表达的机制。通过生物信息学分析发现,miR-21与TIMP-3序列高度互补,TIMP-3可能是miR-21的直接靶标。而TIMP-3是MMP-2、MMP-9的内源性抑制剂,主要通过抑制MMPs表达调节ECM重塑。在本研究中,miR-21可以抑制TIMP-3表达并促进MMP-2和MMP-9的表达。这与既往研究一致,既往研究观察到,上调miR-21通过抑制其靶基因TIMP-3的表达,降低了对MMP-9的拮抗作用,降解ECM导致血管内皮通透性增大[12]。这些结果意味着miR-21可能通过抑制TIMP-3促进RAW264.7 细胞中的MMP-2、MMP-9表达。然而,miR-21与TIMP-3之间的相互作用仅通过生物信息学和Western blot进行验证,仅能证明miR-21能够调控TIMP-3,但无法分辨是直接调控还是间接调控。仍需借助双荧光素酶实验并同时设计TIMP-33'UTR的突变体作为对照验证,以进一步验证miR-21是否靶向抑制TIMP-3。
综上,这些实验结果表明miR-21、MMP-2和MMP-9与脓毒症的发生发展密切相关,miR-21可以通过调控TIMP-3提高 MMP-2、MMP-9表达,提示及早对脓毒症患者进行以miR-21为靶点的干预治疗可能取得较好效果,然而miR-21是否通过靶向抑制TIMP-3在治疗脓毒症中发挥作用,仍需要进一步的动物实验加以验证。LPS调控miR-21的具体机制尚未阐明,目前已知ROS能上调miR-21,而LPS会引起TLR4通路的活化产生ROS[13],LPS是否通过LPS/TLR4/ROS途径调节miR-21表达参与脓毒症发展仍需进一步的研究。
