Cortactin在应力诱导的气道黏液分泌过程中的介导作用①
2019-08-12吴海丰JuliyPerelmanVictorKolosovAndreiShpakou周向东
吴海丰 李 琪 Juliy M Perelman Victor P Kolosov Andrei Shpakou 周向东
(海南医学院第一附属医院呼吸内科,海口570102)
慢性气道炎性疾病常伴有气道阻塞,气道机械作用力亦有改变,其中剪应力的改变尤为突出,异常升高的应力可诱导气道黏液高分泌[1]。过量的黏稠液体不但影响气道上皮纤毛的正常摆动、削弱气道廓清能力、降低气道防御功能,还有助于病原微生物的寄殖,使呼吸道炎症趋于恶化。皮层肌动蛋白结合肽(Cortactin)是大多数极化上皮细胞皮层区域中的一种肌动蛋白交联蛋白[2],其在气道黏液出胞分泌过程中发挥关键作用[3],但目前Cortactin参与该过程的确切机制尚未明了。故本实验以剪应力作为刺激因素,分别转染Cortactin定点突变体,比较剪应力作用后各组细胞中不同位点p-Cortactin蛋白水平及细胞培养上清液中MUC5AC含量的差别,推断出Cortactin介导MUC5AC分泌的关键位点,为慢性气道炎性疾病的治疗提供新的启示。
1 材料与方法
1.1 主要试剂与材料 气道上皮细胞Beas-2B(美国ATCC);10%小牛血清、0.25%胰蛋白酶(Hyclone公司);各型Cortactin突变体及野生型Cortactin重组真核表达载体(重医刘春漪博士馈赠);MUC5AC单克隆抗体(Chemico公司);鼠抗人 Cortactin及p-Cortactin单克隆抗体、小鼠抗β-actin单克隆抗体(Abcam公司);Lipofectamine 2000转染试剂盒、引物(上海生科公司);剪应力装置(重庆医科大学生命科学院实验室提供)。
1.2 方法
1.2.1 细胞的培养及处理 将Beas-2B细胞于含10%胎牛血清的DMEM培养液中孵育,当细胞融合约达80%时,用PBS冲洗2遍,并予细胞分组:空白对照组:仅予等体积的培养液继续培养,未予其他特殊处理。SS组:仅予剪应力刺激,30 r/min,30 min。SS+野生型Cortactin组:转染野生型Cortactin后予剪应力刺激30 min。SS+pcDNA3-Cortactin421-MU组:转染pcDNA3-Cortactin421-MU后予剪应力刺激细胞30 min。SS+pcDNA3-Cortactin466-MU组:转染pcDNA3-Cortactin466-MU后予剪应力刺激细胞30 min。SS+pcDNA3-Cortactin482-MU组:转染pcDNA3-Cortactin482-MU后予剪应力刺激细胞30 min。将上述各组细胞置于37℃、5%CO2孵育箱继续孵育,24 h 后取细胞及其培养上清液行相关检测。
1.2.2 细胞转染 将Beas-2B细胞密度调整至5×105/孔并接种于6孔板中,细胞融合度达80%左右时将各型表达载体转染细胞,按LipofeetamineTM2000说明书操作。转染后PBS液洗涤3次,加入含有10%FBS+DMEM的培养液,置于37℃、5%CO2湿度的培养箱继续孵育,每5 h换液1次,24 h后对各组细胞进行转染鉴定。
1.2.3 剪应力处理 旋转装置的周期性变速过程等效于气道气体流动时产生的剪应力(SS)。该装置在周期性变速旋转过程中,细胞与表面液体将产生相对运动,即可产生剪应力。为模拟气道上皮细胞黏液高分泌的病理状态,我们将剪应力的大小设置在4~6 dynes/cm2之间,即旋转参数为30 r/min,30 min。
1.2.4 Western blot法检测各组细胞Cortactin、p-Cortactin水平 收集各组细胞,PBS液洗涤,加入细胞裂解液裂解后离心,12 000 r/min,4℃,20 min,取上清液经8%聚丙烯酰胺凝胶电泳分离,转膜后室温下封闭2 h,分别加入鼠抗人Cortactin 单克隆抗体(1∶1 000)、鼠抗p-Cortactin单克隆抗体(1∶1 000);室温孵育2 h,分别加入山羊抗小鼠 IgG-HRP,室温孵育2 h。TBST液洗膜后于ECL溶液显色5 min,结果与内参照β-actin产物条带相比较,两者的比值作为Cortactin、p-Cortactin的相对含量。
1.2.5 RT-PCR法检测各组细胞MUC5AC mRNA表达水平 Trizol 法分别提取各组细胞总RNA,2%琼脂糖凝胶电泳鉴定,测定RNA在260 nm和280 nm的A 值,样品A260/A280均介于1.8~2.0。两步法行RT-PCR。参照逆转录试剂盒说明操作。MUC5AC引物:上游5′-TCCGGCCTCATCTTCTCC-3′,下游5′-ACTTGGGCACTGGTGCTG-3′;GAPDH引物序列:上游5′-TAATCATGATATGGGAGAGTAGT-3′,下游5′-TGTATATGTCACTCCACATATAC-3′。PCR完成后,产物经2%琼脂糖凝胶电泳鉴定,结果经吸光度面积积分分析,以与GAPDH mRNA(管家基因)的比值作为相对值。
1.2.6 ELISA法检测各组细胞分泌的MUC5AC蛋白相对含量 吸取各组样品50 μl,包被于96孔酶标板,4℃下过夜,晾干,PBS液漂洗3次,2%BSA室温封闭1 h。PBS再次洗板3次,加入1∶200的小鼠抗人MUC5AC单克隆抗体45 μl,用PBS(含 0.05%Tween-20)稀释至50 μl,室温孵育1 h。PBS液再次洗板3次,加入45 μl用HRP标记的羊抗小鼠二抗(1∶500),室温孵育1 h。弃二抗,PBS液再次洗板3次,加入四甲基联苯胺过氧化物酶显色,反应结束后,测定各孔样品吸光度值(A450 nm),与标准样品比较,所得比值即为各组MUC5AC蛋白的相对含量。
2 结果
2.1 Cortactin转染Beas-2B细胞转染结果 各组细胞内Cortactin蛋白的相对表达量用Western blot法检测,分析发现空白对照组的Cortactin蛋白相对含量明显低于转染野生型Cortactin组、pcDNA3-Cortactin421-MU组、SS+pcDNA3-Cortactin466-MU组、SS+pcDNA3-Cortactin482-MU组(P值均<0.01),说明转染成功(表1、图1)。
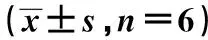
n=6)

GroupsCortactinControl0.444±0.031Wild-Cortactin0.729±0.0411)pcDNA3-Cortactin421-MU0.731±0.0361)pcDNA3-Cortactin466-MU0.718±0.0251)pcDNA3-Cortactin482-MU0.745±0.0291)
Note:1)P<0.01 compared with control group.
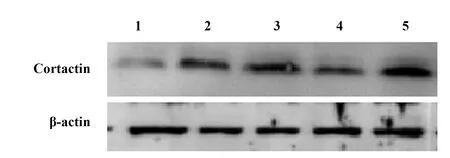
图1 各组细胞Cortactin的相对表达水平Fig.1 Relative level of Cortactin in each groupNote: 1.Control group;2.Wild-Cortactin group;3.pcDNA3-Cortactin421-MU group;4.pcDNA3-Cortactin466-MU group;5.pcDNA3-Cortactin482-MU group.
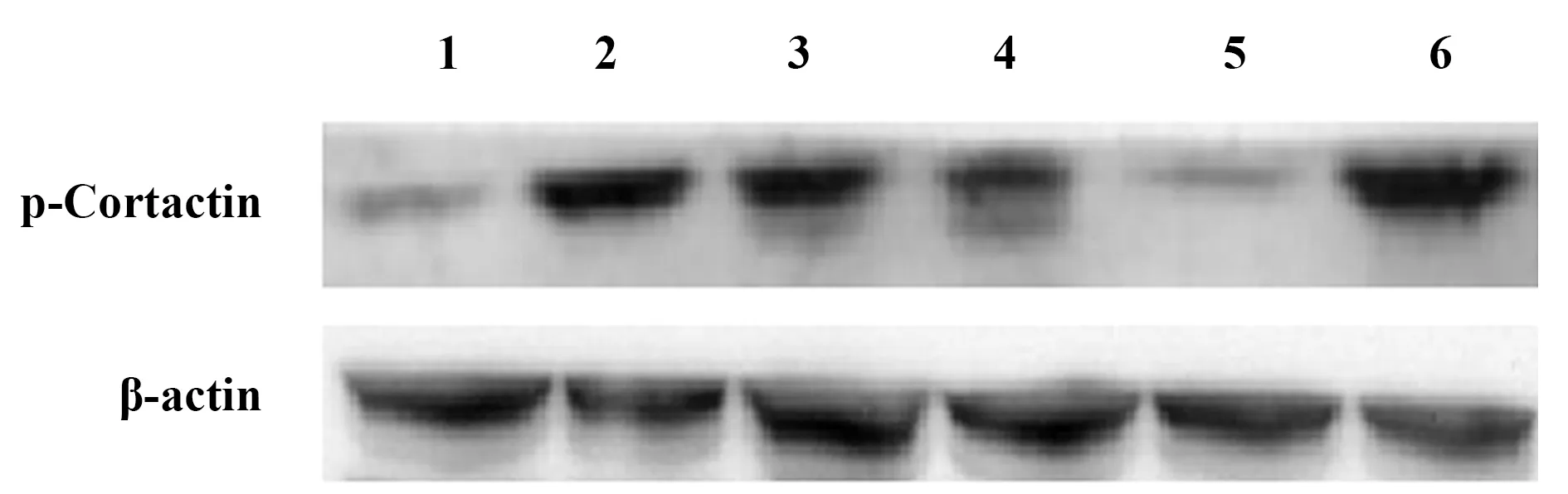
图2 各组细胞p-Cortactin的表达水平Fig.2 Relative level of p-Cortactin in each groupNote: 1.Control group;2.SS+wild-Cortactin group;3.SS+pcDNA3-Cortactin421-MU group;4.SS;5.SS+pcDNA3-Cortactin466-MU group;6.SS+pcDNA3-Cortactin482-MU group.
2.2 各组细胞p-Cortactin水平表达情况 Western印迹法检测各组细胞p-Cortactin水平,单纯剪应力(SS)刺激下,p-Cortactin表达量较空白对照组显著升高(P<0.01),说明气道剪应力可促进Cortactin蛋白磷酸化;与单纯SS刺激组相比,转染野生型Cortactin后,再予SS刺激,p-Cortactin蛋白表达明显增加(P<0.01);与SS+野生型Cortactin组相比,SS+pcDNA3-Cortactin-MU组的p-Cortactin蛋白水平显著下降(P<0.01),而SS+pcDNA3-Cortactin421-MU组和SS+pcDNA3-Cortactin482-MU组的p-Cortactin蛋白水平则无明显变化(P>0.05),表明当酪氨酸磷酸化位点Y466突变后,Cortactin磷酸化功能将随之降低(图2,表2)。
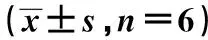
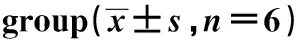
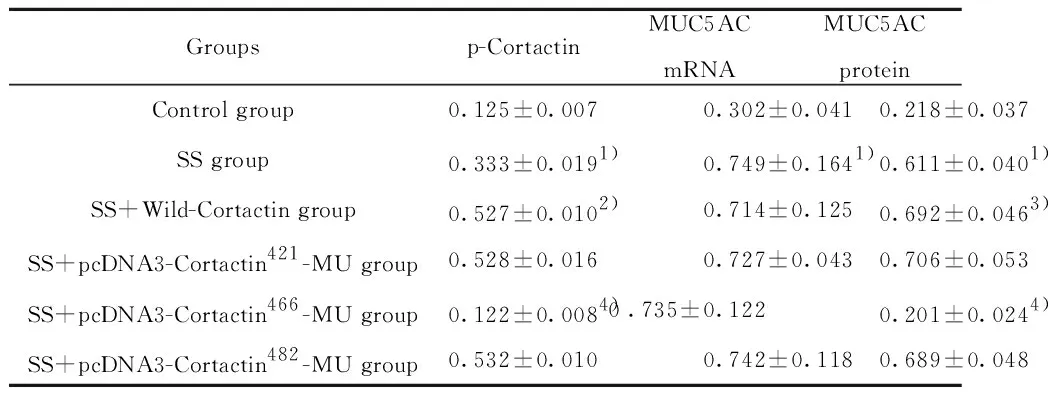
Groupsp-Cortactin MUC5ACmRNA MUC5ACproteinControl group0.125±0.0070.302±0.041 0.218±0.037SS group0.333±0.0191)0.749±0.1641) 0.611±0.0401)SS+Wild-Cortactin group0.527±0.0102)0.714±0.125 0.692±0.0463)SS+pcDNA3-Cortactin421-MU group0.528±0.0160.727±0.043 0.706±0.053SS+pcDNA3-Cortactin466-MU group0.122±0.0084)0 .735±0.122 0.201±0.0244)SS+pcDNA3-Cortactin482-MU group0.532±0.0100.742±0.118 0.689±0.048
Note:Compared with control group,1)P<0.01;compared with SS group,2)P<0.01;compared with SS group,3)P<0.05;compared with SS+ wild-Cortactin group 4)P<0.01.
2.3 转染Cortactin对细胞MUC5AC表达及分泌的影响 经RT-PCR法和ELISA法检测后发现,与空白对照组相比,SS组的细胞MUC5AC mRNA及蛋白的相对含量显著升高(P<0.01),说明了剪应力(SS)能诱Beas-2B细胞MUC5AC的过量表达和分泌。与单纯SS刺激组相比,SS+野生型Cortactin组的MUC5AC蛋白相对含量明显升高(P<0.05),但MUC5AC mRNA转录水平无明显变化(P>0.05),说明Cortactin可促进MUC5AC的胞外分泌,但对MUC5AC基因的表达无明显影响。与SS+野生型Cortactin组相比,SS+pcDNA3-Cortactin421-MU组、SS+pcDNA3-Cortactin482-MU组细胞培养上清液的MUC5AC蛋白相对含量变化不明显,差异无统计学意义(P>0.05),而SS+pcDNA3-Cortactin466-MU组的MUC5AC蛋白显著下调,差异有统计学意义(P<0.01),但各转染组间的MUC5AC mRNA水平明显变化(P>0.05),见表2。
3 讨论
病原微生物的繁殖和炎症细胞的趋化是慢性气道炎性疾病的关键因素,而淤积的痰液则是病原体寄殖的良好培养基。过多的气道黏液不但无物理屏障作用,还会减弱气道上皮的清除功能,诱发炎症细胞的聚集和炎症因子的释放,而某些炎症因子又可诱导黏液的合成与分泌,加重原有的气道炎症[4]。慢性气道炎性疾病急性发病时黏液的产生常导致气道阻塞,加之原有的气道重构,故呼吸时气道所受机械作用力明显上升,其中以剪应力的改变尤为显著,是刺激气道黏液分泌常见的维持性因素。另外,临床中使用机械通气时,气道上皮受到明显的应力作用,过强的通气压力将诱发气道黏液分泌,蓄积的黏液增加气道阻塞,形成恶性循环。
Cortactin作为酪氨酸蛋白激酶Src的作用底物而首次被发现,多研究表明,Cortactin是细胞肌动蛋白骨架组装和去组装过程中的重要调控者,在细胞伪足的形成、细胞迁移、膜流动性、胞吞等过程中担当重要角色[5-7]。近年来研究发现,Cortactin还参与气道黏液分泌[3]。Cortactin作为介导性因子,一方面介导MARCKS和F-actin的连接,将黏蛋白的分泌颗粒向质膜的方向极向迁移;另一方面通过调节细胞骨架蛋白的组装,增加了细胞膜的流动性及黏蛋白的出胞位点,促进MUC5AC囊泡的胞外分泌。本研究以剪应力为刺激因素,成功构建气道黏液高分泌模型。进一步实验研究证实,Cortactin可在剪应力的作用下发生磷酸化,p-Cortactin可促进气道MUC5AC分泌,而对MUC5AC基因的转录基本无影响。
Cortactin参与细胞运动、细胞信号转导、胞吐及胞吞等活动与其磷酸化状态密切相关。Cortactin主要有4个功能区域,分别为N末端酸性结构域(NTA)、串联重复区域、C-端富含脯氨酸区域及SH3区域。其中C-端含有3个Src磷酸化位点—Y421、Y466、Y482[8-10]。研究表明,Cortactin磷酸化位点发生突变后,其对细胞骨架重塑的调控作用也随之丧失[11]。虽前期研究已阐明p-Cortactin能促进气道黏蛋白的出胞运动,但目前国内外关于Cortactin介导黏蛋白分泌的关键作用位点尚无报道。本实验研究发现,当转染定点突变体 Cortactin466-MU后再予剪应力处理,细胞p-Cortactin及细胞培养上清液MUC5AC水平显著降低,但细胞MUC5ACmRNA含量无明显变化。故我们推断,在剪应力刺激诱导的MUC5AC高分泌过程中,Cortactin具有重要的调控功能,并且其酪氨酸磷酸化位点Y466为其介导该过程中的关键作用位点。即当酪氨酸磷酸化位点Y466发生磷酸化后,可诱导F-actin的聚合和收缩运动,促进黏蛋白的分泌出胞。
本研究证实了Cortactin在参与剪应力诱导的气道MUC5AC分泌过程中的关键作用位点。启示抑制Cortactin的表达或功能可降低应力诱导的气道黏液高分泌,有利于气道物理屏障功能的维持,减轻气道炎症,为慢性气道炎性疾病的治疗提供新的干预靶点,同时还为临床中机械通气压力参数的选择提供了理论基础。
