MAPK4敲除对内毒素诱导小鼠急性肺损伤的影响①
2019-08-12刘士明褚风云
冒 灵 胡 琳 刘士明 褚风云 贾 力 陈 超 徐 林
(遵义医科大学免疫学教研室暨贵州省基因检测与治疗特色重点实验室,遵义563000)
急性肺损伤(Acute lung injury,ALI)/急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)是以肺部急性炎症为特征的一种严重的炎症疾病,是败血症、出血性休克、严重创伤等危重疾病的并发症[1-3]。尽管多种治疗策略如干细胞治疗、细胞因子治疗和激素类治疗被应用于ALI的临床研究中,但近年来ALI的发生率和死亡率仍居高不下[4-6]。这些治疗策略在临床上应用效果受限的一个主要原因就是我们对ALI发生的分子病理机制仍未明确了解。近年来研究发现,丝裂原活化蛋白激酶4(Mitogen-activated protein kinase 4,MAPK4)作为非典型MAPK家族分子的成员之一,参与机体多种生理、病理过程,如免疫应答、肿瘤生成[7-9]。然而,MAPK4是否参与肺部疾病(如ALI)的病理发生进程还未有文献报道。因此,本研究拟利用MAPK4-/-小鼠,建立LPS(脂多糖)诱导的小鼠ALI模型,观察MAPK4敲除对小鼠ALI病理损伤的可能影响,并探讨其可能机制,为后续临床治疗新策略的提出提供重要的前期实验依据。
1 材料与方法
1.1 材料 7~10周C57BL/6背景的SPF级WT和MAPK4-/-小鼠;LPS(Sigma);显微镜(Olympus);C1000 Thermal cycler荧光定量PCR仪、S1000 Thermal cycler PCR仪、Western blot电泳仪、Bio-Rad ChemiDocTMMP imaging System(Bio-Rad);RNAiso Plus、Prime Script RT Reagent Kit、SYBR Premix Ex TaqⅡ(×2)(TaKaRa);4%多聚甲醛、三氯甲烷、异丙醇(重庆川东化工公司);PCR引物(生工生物工程有限公司),见表1;兔抗鼠AKT、p-AKT、ERK1/2、p-ERK1/2、GAPDH一抗(Cell Signaling Technol-ogy),兔抗鼠MAPK4一抗(Abcam);HRP标记的羊抗兔IgG二抗(碧云天生物技术有限公司);全蛋白提取试剂盒(凯基生物技术有限公司);BCA蛋白定量试剂盒、抗体稀释液(Solarbio);PVDF膜(Millipore)。
1.2 方法
1.2.1 对小鼠进行生存分析 按照15 mg/kg LPS的剂量对小鼠进行腹腔注射,观察并记录两组小鼠生存情况。
1.2.2 建立小鼠ALI模型 按照10 mg/kg LPS的剂量对小鼠进行腹腔注射,诱导小鼠ALI模型。24 h 后,记录两组小鼠体重变化,观察肺脏炎性情况,剂量参考文献[10]。
1.2.3 HE染色观察肺脏组织的病理学变化 取WT和MAPK4-/-小鼠的肺脏组织,置于4%多聚甲醛中固定24 h以上,然后用石蜡包埋,制成5 μm切片并进行HE(苏木精-伊红)染色, 最后在倒置显微镜下观察肺脏组织的病理学变化。
表1 Real-time PCR引物序列
Tab.1 Primer sequences of real-time PCR

NameSequences(5'-3')Length(bp)IL-1βSenseTGCCACCTTTTGACAGTGATG220AntisenseAAGGTCCACGGGAAAGACACTNF-αSenseCAGGGGCCACCACGCTCTTC121AntisenseTTTGTGAGTGTGAGGGTCTGGTGF-βSenseGGCGGTGCTCGCTTTGTA201AntisenseTCCCGAATGTCTGACGTATTGAGAPDHSenseGAGCCAAACGGGTCATCATCT232AntisenseGAGGGGCCATCCACAGTCTT
1.2.4 Real-time PCR 检测肺脏组织中炎性因子的mRNA表达水平 分别提取ALI模型下的WT和MAPK4-/-小鼠的肺脏组织RNA,逆转录为cDNA,进行Real-time PCR检测。Real-time PCR检测体系为20 μl,其中SRBR Premix Ex Taq Ⅱ(2×)10 μl,cDNA 2 μl,上下游引物混合液1 μl,高压的三蒸水7 μl。反应条件:95℃ 30 s,95℃ 5 s,58℃ 20 s,72℃ 10 s,重复40个循环。每个反应设置3个复孔,复孔间Cq值差异不超过0.5者用于数据分析。
1.2.5 Western blot检测肺脏组织中相关信号通路分子的蛋白表达水平 称取约0.025 g的ALI模型下的WT和MAPK4-/-小鼠肺脏组织,加入300 μl含蛋白酶抑制剂和磷酸酶抑制剂的Lysis裂解液,组织破碎仪70 Hz破碎10 s。4℃裂解30 min,12 000 r/min 4℃离心15 min,取上清用于BCA法测蛋白浓度,加入5× loading buffer,98℃变性10 min。经10%SDS-PAGE分离,250 mA湿转60 min后,用5%脱脂奶粉封闭1 h,一抗4℃孵育过夜,二抗室温孵育 1 h,利用Bio-Rad ChemiDocTMMP imaging System检测分析蛋白表达。
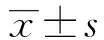
2 结果
2.1 ALI模型下小鼠的生存情况 生存分析结果显示,LPS 腹腔注射后,与WT小鼠相比,MAPK4-/-小鼠的生存时间明显延长(图1,P<0.05)。
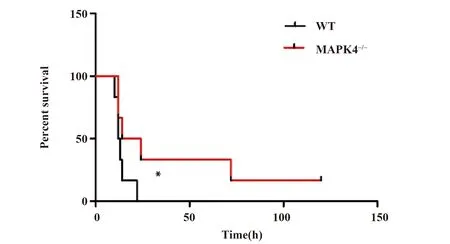
图1 15 mg/kg LPS 腹腔注射后,WT和MAPK4-/-小鼠的生存情况(n=6)Fig.1 Survival curve of WT mice and MAPK4-/- mice treated with i.p.15 mg/kg LPS(n=6)Note:*.P<0.05.
2.2 ALI模型下小鼠的体重指数和肺脏脏器指数变化 如图2所示,与WT小鼠相比,MAPK4-/-小鼠的肺脏充血明显减少(图2A)。然而两组小鼠体重指数和肺脏脏器指数均未发现明显差异(图2B、C,P>0.05)。
2.3 ALI模型下小鼠肺脏组织的病理学变化 HE结果显示,与WT小鼠相比,MAPK4-/-小鼠的肺泡间质增厚明显减轻,炎性细胞浸润明显减少(图3)。
2.4 观察ALI模型下小鼠肺脏组织中炎性因子的mRNA表达水平 Real-time PCR结果显示,与WT小鼠相比,MAPK4-/-小鼠的促炎因子IL-1β和TNF-α的mRNA表达水平明显降低,而抑炎因子TGF-β的mRNA表达水平明显增高(图4,P<0.05)。
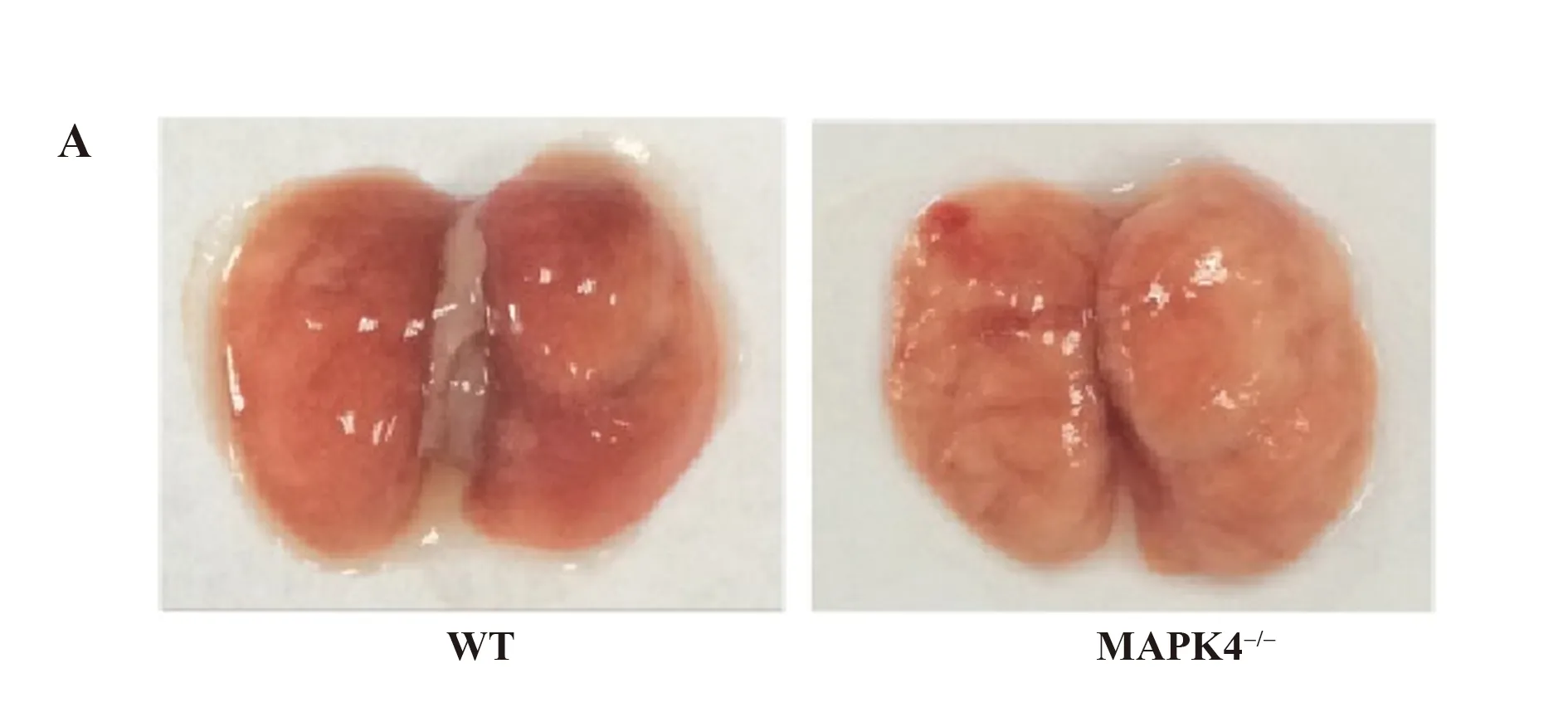
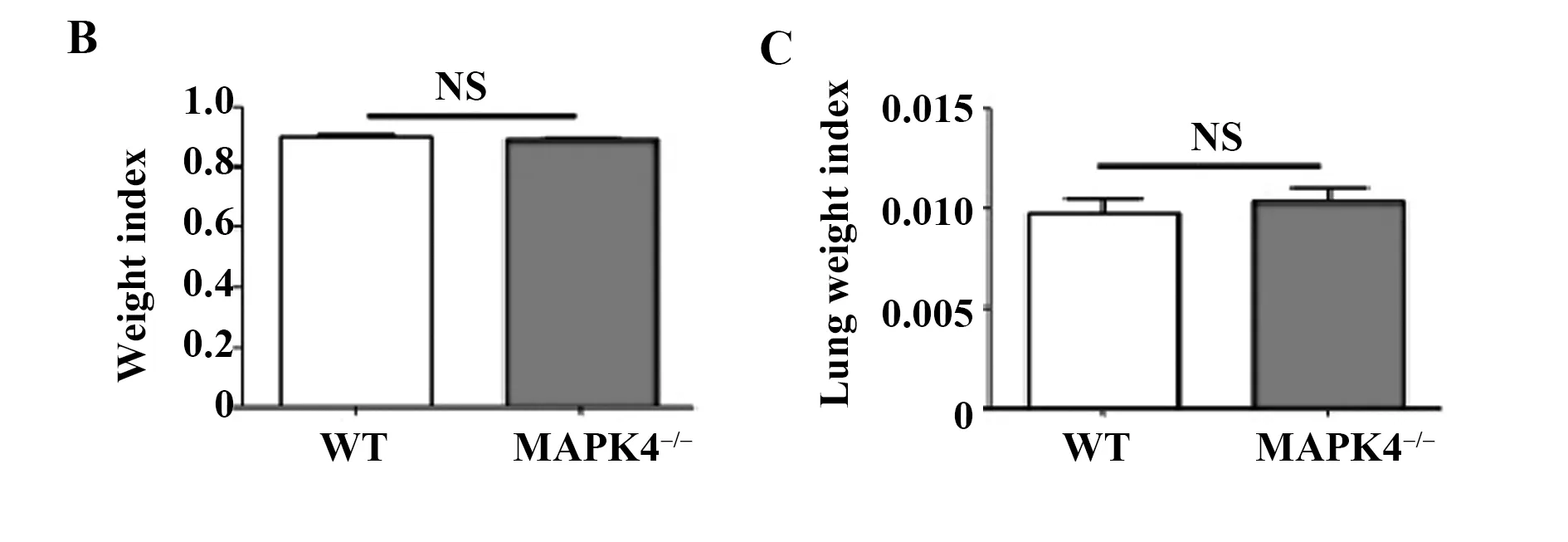
图2 10 mg/kg LPS腹腔注射后的WT和MAPK4-/-小鼠的体重变化和肺脏脏器指数变化(n=6)
Fig.2 Change of weight and lung weight index in WT mice and MAPK4-/-mice treated with i.p.10 mg/kg LPS (n=6)
Note: A.The picture of lung in WT or MAPK4-/-mice;B.The change of lung weight in WT or MAPK4-/-mice;C.The change of lung weight in WT or MAPK4-/-mice.NS.No significant change.
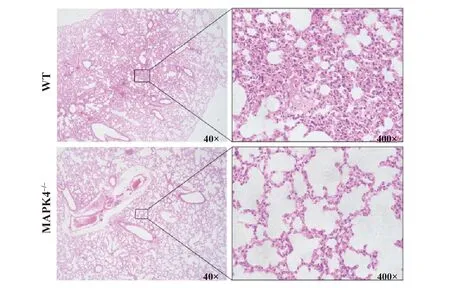
图3 10 mg/kg LPS腹腔注射后的WT和MAPK4-/-小鼠的肺脏组织病理学变化(HE染色)Fig.3 Lung pathology in WT mice and MAPK4-/- mice treated with i.p.10 mg/kg LPS(HE staining)
2.5 MAPK4敲除对ALI模型相关信号途径传递的影响 Western blot检测结果显示,与WT小鼠相比,MAPK4-/-小鼠肺脏组织中AKT和ERK变化不显著(图5,P>0.05),但p-AKT和p-JNK的蛋白表达明显降低(图5,P<0.01)。
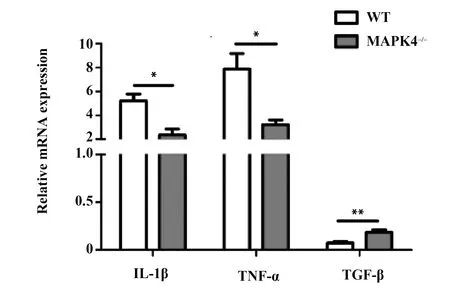
图4 10 mg/kg LPS腹腔注射后的WT和MAPK4-/-小鼠肺脏组织中相关炎性细胞因子的mRNA表达水平变化(n=6)Fig.4 Relative mRNA expression of cytokines in lung tissues of WT mice and MAPK4-/- mice treated with i.p.10 mg/kg LPS(n=6)Note:*.P<0.05.**.P<0.01.
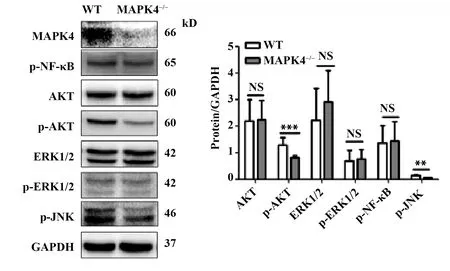
图5 10 mg/kg LPS腹腔注射后的MAPK4敲除对相关信号通路转导的影响(n=6)Fig.5 Change of related signaling pathways in WT mice and MAPK4-/- mice treated with i.p.10 mg/kg LPS(n=6)Note:The expression levels of p-NF-κB,AKT,p-AKT,ERK1/2,p-ERK1/2 and p-JNK in lung tissues were determined with Western blot and calculated.**.P<0.01,***.P<0.001.
3 讨论
近年来,丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)家族被证实参与机体多种生理病理过程[11-13]。如Schuh等[14]研究发现,抑制典型MAPK分子ERK1/2可保护LPS诱导的肺损伤;Li等[15]也发现 LPS可通过激活p38/MAPK使内皮通透性增加,从而调节ALI。这些研究提示深入探讨特定MAPK分子在ALI发生中的作用及其相关机制不仅是对ALI发生机理的认识,且对于ALI的临床预防和治疗均具有重要意义。
MAPK4作为非典型MAPK家族的成员之一,调节免疫应答、参与肿瘤生成[8,9]。重要的是,有研究报道,与MAPK4有着高度同源结构的ERK3在小鼠肺部发育中有着重要作用,ERK3的缺失会使小鼠肺部发育不全,甚至会使小鼠因为严重的呼吸障碍在出生后数分钟内死亡[16];然而,MAPK4的缺失并不会影响小鼠肺部发育[17]。但MAPK4在包括ALI在内的肺部疾病中是否存在重要作用还没有文献报道。因此,在本研究中,我们利用MAPK4-/-小鼠,首次建立LPS诱导的ALI模型。值得注意的是,MAPK4-/-小鼠诱导ALI模型后生存时间明显延长;同时,经HE染色后发现MAPK4-/-小鼠的肺部炎性损伤明显减轻;Real-time PCR结果进一步发现,MAPK4-/-小鼠的肺脏组织中,促炎因子IL-β和TNF-α的mRNA表达水平明显降低,抑炎因子TGF-β的mRNA表达水平明显增高。这些研究结果提示MAPK4敲除后可减轻模型小鼠肺部炎症。此外,已有研究显示多种免疫细胞,如巨噬细胞、中性粒细胞等,也参与了ALI的发生过程[18-20]。因此,MAPK4是否可通过调节免疫细胞的功能,参与ALI的病理发生过程还需要进一步深入研究阐明。
现有的研究证实,多条信号通路,如AKT、JNK参与ALI的病理进程[21-23]。如,Wang等[24]研究发现上调p-AKT的表达,可明显改善ALI的病理发生过程;此外,Xu等[25]也发现高分子透明质酸可以通过抑制p-ASK1及其下游分子p-p38和p-JNK缓解ALI。本研究中,我们发现,MAPK4敲除后,模型小鼠肺组织中p-NF-κB、AKT、ERK1/2和p-ERK1/2的蛋白表达水平没有明显变化;然而p-AKT和p-JNK的蛋白表达水平在MAPK4-/-小鼠中明显减少,提示MAPK4敲除对ALI发生的影响可能与AKT和JNK信号途径传递有关。类似的,Wu等[26]发现ERK/AKT的激活与胃癌的耐药性有关。此外,Salmerón等[27]报道光动力疗法治疗恶性肿瘤时,p38 MAPK的激活引起细胞凋亡,而JNK促进细胞存活。因此,这些研究提示了MAPKs信号途径、AKT信号途径等之间的复杂联系,然而,其确切的分子机制还有待深入研究。
综上所述,本研究中我们首次发现MAKP4敲除后可显著减轻小鼠ALI模型的肺损伤,为后续深入研究MAPK4在肺部疾病发生中的作用以及临床治疗策略的开发提供了重要的前期实验依据。
