超早期肠内营养对老年急性重症胰腺炎的炎症介质和氧化应激的影响
2019-08-12朱建宇
杨 琳, 朱建宇
上海中医药大学附属曙光医院营养二科,上海 200021
急性重症胰腺炎(seveve acute pancreatitis, SAP)是临床上的常见危重急诊,其病死率为36%~50%,后期如果合并感染者病死率更高[1]。SAP的发病机制较为复杂,与肠道屏障功能受损、细菌移位和内毒素血症有关,导致胰腺组织和其他器官继发性感染及全身炎症反应综合征[2]。而炎症反应加重患者肠道黏膜屏障的破坏,加上SAP病情较长,体内代谢亢进,蛋白分解加速,极易导致营养不良,临床上常采用早期营养支持来改善患者的功能状态。现有研究表明,早期肠内营养能够明显改善肠道黏膜屏障功能,可以降低并发症发生率,提高机体免疫力,缩短患者住院时间,促进患者康复[3]。随着对肠内营养的研究深入,在患者入院24 h内开始超早期的肠内营养与早期肠内营养相比,能够明显降低机体的菌群失调和感染的发生率[4]。本组研究采用超早期肠内营养治疗SAP,并观察其对机体的炎症价值和氧化应激的影响,现报道如下。
1 资料与方法
1.1 临床资料选取2015年1月至2017年12月在我院就诊的老年SAP患者106例,根据随机数字方法,将患者分为观察组和对照组,每组各53例。观察组:男36例,女17例,年龄(68.39±3.39)岁(60~79岁),体质量指数(BMI)(28.64±1.29)kg/m2,病因:胆源性33例,暴饮暴食12例,酒精性7例,其他1例。对照组:男34例,女19例,年龄(68.65±4.15)岁(60~79岁),BMI为(28.18±2.18)kg/m2,病因:胆源性32例,暴饮暴食13例,酒精性6例,其他2例。纳入标准:所有患者均符合AP的诊断标准;均知情同意,并经医院伦理委员会通过。排除标准:既往有胰腺炎病史者;已行手术治疗的患者;心、肝、肾等重要脏器功能不全者;肝炎、结核和急性肺炎等其他疾病引起急慢性感染者;恶性肿瘤;免疫性和血液系统疾病;精神性疾病和智力障碍者。两组在年龄(t=0.353)、性别(χ2=0.838)、BMI(t=1.323)和病因(u=0.466)等一般资料相比,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 治疗方法:观察组予以超早期肠内营养治疗,对照组予以早期肠内营养治疗。两组入院后均予以禁食,胃肠减压,维持电解质平衡,抑酸抑酶和抗感染治疗。观察组在入院后禁食24 h后在内镜下将鼻空肠管放置在Treitz韧带下30~40 cm处,先用生理盐水500~1 000 ml试滴后无明显反应后改为24 h均速滴入多种营养素强化蛋白粉[商品名:清流素,玛士撒拉(上海)医疗科技有限公司生产],次日加量减少肠外营养,直至全肠外营养支持治疗,每天按照30 kcal/kg,含氮为0.25 g/kg。对照组在入院禁食72 h后予以肠内营养,方法、步骤与观察组一致。在肠内营养过程中,根据具体情况调整剂量和滴速,遵循从小到大,浓度由低到高,并根据血尿淀粉酶降至正常,经B超和CT提示胰腺周围炎症渗出吸收后,逐步开放饮食,直至停用肠内营养支持。
1.2.2 APACHE Ⅱ和Ranson评分[5]:急性生理与慢性健康评分(APACHE)Ⅱ:主要由急性生理评分(12项生理指标组成)、年龄评分和慢性健康评分三部分组成。分数为0~71分,分数越高,病情越严重。Ranson评分:常用于SAP的评价指标,根据入院时5项临床指标和48 h的6项指标各1分,共11分,分数越高,越严重。
1.2.3 血液指标的检测:患者入院时取患者肘静脉血约10 ml,离心率2 500 r/min,离心半径6 cm,离心10 min,分离出上清液放置在-80 ℃的冰箱中保存。采用双抗体夹心化学发光法检测白介素(IL)-6、IL-8、肿瘤坏死因子(TNF)-α、高敏C反应蛋白(hs-CRP)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)和晚期氧化蛋白产物(AOPP)水平,用生物素化单克隆特异性抗体与血清混合,形成抗原抗体复合物,然后加入链霉素磁珠微粒进行二次孵育,通过生物素和链霉素亲和素作用结合,通过电磁效应将磁珠吸附在电极表面,通过电极的电压促进复合物化学发光,测定发光强度,采用Elecsys软件自动通过定标曲线计算出IL-8、IL-6、TNF-α、hs-CRP、MDA、GSH-Px、AOPP和SOD水平含量。
1.2.4 观察指标:观察两组治疗前后症状、体征、血尿淀粉酶、APACHE Ⅱ、Ranson评分、炎症因子和氧化应激水平的变化。

2 结果
2.1 两组治疗后症状和体征改善情况的比较从表1可知,观察组的腹痛缓解时间、腹胀缓解时间、肠鸣音恢复时间、恶心呕吐消失时间、排便排气恢复时间、发热消失时间和血象恢复时间明显短于对照组(P<0.01)。

表1 两组治疗后症状和体征改善情况的比较Tab 1 Comparison of symptoms and signs after treatment between two groups d
2.2 两组治疗前后血尿淀粉酶、APACHE Ⅱ和Ranson评分比较从表2可知,两组治疗前血淀粉酶、尿淀粉酶、APACHE Ⅱ和Ranson评分比较,差异无统计学意义(P>0.05);治疗后两组均较治疗前明显降低(P<0.01),而观察组的降低水平较对照组更加明显(P<0.01)。

表2 两组治疗前后血尿淀粉酶、APACHE Ⅱ和Ranson评分比较Tab 2 Comparison of blood urease amylase, APACHE Ⅱ and Ranson scores before and after treatment between two groups
注:与治疗前比较,aP<0.01。
2.3 两组治疗前后炎症因子的变化从表3可知,两组治疗前IL-8、IL-6、TNF-α和hs-CRP水平比较,差异无统计学意义(P>0.05);两组治疗后均较治疗前明显降低(P<0.01),而观察组的降低水平较对照组更加明显(P<0.01)。
2.4 两组治疗前后氧化应激水平的影响从表4可知,两组治疗前MDA、GSH-Px、AOPP和SOD水平比较,差异无统计学意义(P>0.05);治疗后两组的MDA和AOPP水平较治疗前明显降低(P<0.01),而GSH-Px和SOD水平较治疗前明显升高(P<0.01),且观察组的降低或升高水平较对照组更为明显(P<0.01)。
2.5 两组治疗后并发症的比较从表5可知,观察组的腹腔感染、胆道感染、败血症、院内感染和消化道出血方面明显低于对照组,差异有统计学意义(P<0.05),而肺部感染和病死率两组比较,差异无统计学意义(P>0.05)。

表3 两组治疗前后炎症因子的变化Tab 3 Changes in inflammatory factors before and after treatment in two groups
注:与治疗前比较,aP<0.01。

表4 两组治疗前后氧化应激水平的影响Tab 4 Effects of oxidative stress levels before and after treatment in two groups
注:与治疗前比较,aP<0.01。
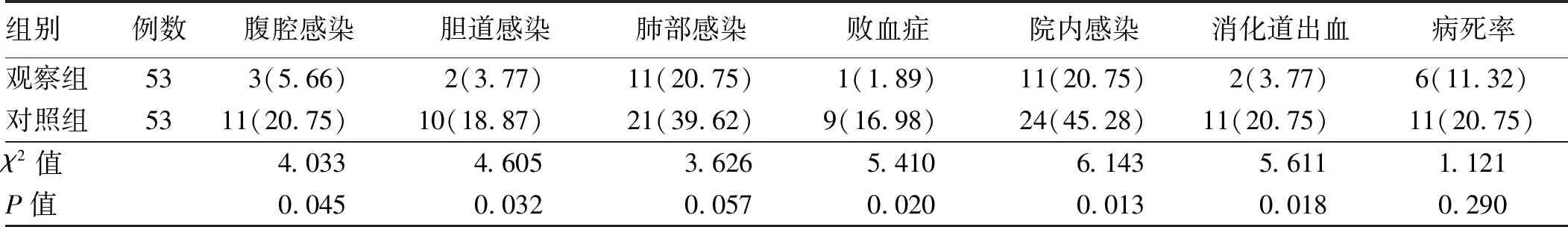
表5 两组治疗后并发症的比较Tab 5 Comparison of postoperative complications between two groups 比例/%
3 讨论
SAP是消化系统中常见需要紧急入院的疾病,该病的发病原因复杂,其肠道屏障功能障碍是导致SAP发展的重要原因。基础实验证实SAP在发病后3 h内出现肠道上皮细胞凋亡,6 h开始通透性增加,8~18 h出现肠道细菌异位,故早期干预肠道屏障功能的继发性损伤显得尤其重要。肠内营养的时间一直存在争议[6-7],肠内营养从发病24 h到SAP相对较晚予以肠内营养均有报道,有研究报道,在患者入院24 h予以肠内营养,患者有较好的疗效,在肠内营养过程中未出现病情恶化;而另一些学者实施肠内营养在48 h后的时机最佳。另一项多中心研究表明,通过随机对照组研究发现,入院24 h内肠内营养较入院72 h肠内营养能够明显降低病死率和并发症发生率。超早期营养在入院24 h内将鼻肠营养管置入空肠,先予以500~1 000 ml生理盐水后无明显不良反应后,予以营养液根据由少到多,浓度由低到高循序渐进的原则进行,本组研究发现,超早期肠内营养在改善SAP症状和体征方面明显优于早期营养患者,且发现血淀粉酶、尿淀粉酶、APACHE Ⅱ和Ranson评分方面超早期肠内营养明显具有优势,同时发现超早期肠内营养对SAP的腹腔感染、胆道感染、败血症、院内感染、消化道出血和病死率方面具有较明显的优势,与文献报道超早期肠内营养能够明显改善SAP临床症状和体征,对SAP并发症具有明显的降低作用一致[8]。说明超早期肠内营养有利于修复肠道黏膜,抑制肠道内细菌过度繁殖,降低内毒素血症,肠道细菌移位,减少肠源性感染。同时超早期肠内营养能够促进维持肠道黏膜的完整性,调节生理机能,促进胃肠动力功能恢复,尽快达到生理功能状态,有利于物质的吸收,提高机体的免疫功能。
SAP的发生、发展与疾病发生、发展中产生的大量炎症介质和细胞因子密切相关,由于SAP中胰酶异常激活的胰腺组织的网状内皮系统引起大量的炎症因子释放如IL-6、IL-8和TNF-α等呈级联瀑布反应,出现全身炎症反应综合征,如果不及时阻断类似炎症反应,极易发展成多脏器功能衰竭,甚至死亡。IL-6通过激活丝裂原活化蛋白激酶信号通路,参与炎症反应,促进胰腺细胞凋亡,同时对血管内皮细胞具有一定的损伤作用,引起全身症状[9];IL-8是中性粒细胞和单核细胞等多种细胞产生的多肽蛋白,对免疫细胞具有强烈的趋化作用,能够促进多种生物活性物质的释放,包括组胺等,产生局部炎症反应,导致血管通透性增加,诱导白细胞在外伤部位聚集,加剧组织损伤[10];TNF-α是引起蛋白激酶C和酪氨酸激酶-2的激活,导致肌动蛋白的细胞骨架出现破坏,引起胰腺细胞死亡[11];CRP是反应机体炎症程度的重要指标,由IL-6对其进行调控,并由肝脏合成释放入血的急性时相蛋白,是判断SAP炎症程度的重要指标[12-13]。本组研究发现,超早期肠内营养与早期肠内营养比较,机体的IL-8、IL-6、TNF-α和hs-CRP水平出现明显降低,说明超早期肠内营养能够明显降低机体炎症介质的释放,从而对肠道黏膜的功能障碍起到明显的缓解作用。
SAP与机体的抗氧化体系功能降低,导致大量的氧自由基堆积,进而损伤毛细血管和血管内皮细胞,引起血管通透性增加,加重胰腺组织微循环障碍,此外,氧自由基能够激活白细胞,氧化应激能够对腺泡细胞的损伤。血清中的MDA和AOPP水平反映机体的自由基生成量和氧化应激的程度[14],而GSH-Px和SOD水平反映机体抗氧化能力[15-16]。本组研究发现,超早期肠内营养与早期肠内营养比较,能够更加明显降低MDA和AOPP水平,升高GSH-Px和SOD水平,说明超早期肠内营养能够明显提高机体的抗氧化能力,提高机体对自由基的清除能力,这种超早期的肠内营养能够促使机体的肠道黏膜的功能恢复和全身炎症反应的降低,从而进一步抑制氧化应激反应。同时由于超早期的肠内营养能够纠正机体的营养状态,提高机体的免疫力,改善肠道功能,从而达到增强机体抵抗氧化应激,改善机体的免疫状态。
总之,超早期肠内营养较早期肠内营养对老年SAP的疗效更加显著,具有恢复快,并发症少,对机体的炎症和氧化应激具有缓解作用。
