垂体催乳素细胞分化发育的研究进展
2019-08-12章卫平曹冬梅
苏 凯 章卫平 曹冬梅
垂体是人体重要的内分泌器官,主要由5种内分泌细胞组成:生长激素细胞、催乳素细胞、促甲状腺素细胞、促性腺激素细胞和促肾上腺皮质激素细胞,功能涉及维持内环境稳定、生长发育、物质代谢、生殖和哺乳等。其中,生长激素细胞和催乳素细胞占腺垂体内分泌细胞数量的半数以上,两者在分化上关系密切,在生物学功能上部分重叠,而它们分化命运决定的分子机制至今尚不完全清楚。由于出生后垂体中的催乳素细胞数量仍有很大可塑性,因此催乳素瘤也是临床上最常见的垂体瘤类型之一。近年来,笔者所在实验室报道了以垂体催乳素细胞群单一性缺失为表型的基因敲除小鼠,这为催乳素细胞分化命运决定的分子机制研究提供了很好的模型,也使人们对催乳素细胞分化发育的特异性调控机制有了更深入的理解,并可能为垂体相关疾病的防治提供新的靶点。本文就该领域的研究进展做一综述。
一、垂体催乳素细胞的分化发育过程
1.胚胎期催乳素细胞的分化起源:胚胎期垂体催乳素细胞、生长激素细胞和促甲状腺素细胞共同起源于同一群以转录因子Pit-1(Pou1f1)为标志分子的前体细胞。小鼠胚胎第13.5天(E13.5),上述3群内分泌细胞开始分化。小鼠胚胎第14.5天促甲状腺素细胞分化成熟,其标志是在前叶中的部分细胞表达促甲状腺素(thyroid stimulating hormone β subunit,TSHβ)。小鼠胚胎第15.5天,生长激素(growth hormone,GH)和催乳素(prolactin,PRL)的表达标志着生长激素细胞和催乳素细胞的分化成熟。随后,生长激素细胞数量急速增加并延伸至整个前叶的中央和侧面,而催乳素细胞则分布于前叶腹侧面的中央。
在这3群共同起源于Pit-1阳性前体细胞的内分泌细胞中,PRL谱系和GH谱系的分化过程关系最为密切。传统观点认为,催乳素细胞的分化成熟过程中会经历一个PRL/GH共表达的过渡阶段,即一部分Pit1阳性前体细胞先分化为PRL/GH双阳性的催乳素生长激素细胞(somatolactotropes),再分化成PRL单阳性的成熟催乳素细胞。但也有不同意见认为,PRL/GH双阳性前体细胞并不是催乳素细胞分化的必经阶段,在成年垂体中只有10%的催乳素细胞经PRL/GH双阳性途径分化,而另90%的催乳素细胞由Pit-1阳性前体细胞直接分化而来,甚至有研究认为胚胎期垂体中根本就没有PRL/GH双阳性细胞的存在。笔者所在实验室通过免疫组化的双标记检测结果显示,小鼠胚胎第18.5天之前的PRL阳性细胞均为PRL/GH双阳性表达,且这群双阳性细胞在出生前并不增殖。从出生后第3天(P3)开始,腺垂体中的催乳素细胞数量扩增,出生后第4天时PRL/GH双阳性细胞占催乳素细胞总数的25%,至出生后第14天时PRL/GH双阳性细胞仅占催乳素细胞总数的5%[1]。以上结果说明,催乳素细胞的分化包括Pit1阳性细胞直接分化途径和经PRL/GH双阳性细胞途径两种方式。经PRL/GH双阳性细胞途径是小鼠胚胎第18.5天之前催乳素细胞分化的主要方式,但这种方式分化而来的催乳素细胞数量十分有限。催乳素细胞数量的大幅扩增主要发生在出生后,此时经PRL/GH双阳性细胞分化不是催乳素细胞数量增加的主要方式。至于这两种分化途径在催乳素细胞分化过程中的具体占比,有待于进一步研究。PRL/GH双阳性途径的存在也提示PRL谱系与GH谱系的分化过程关系密切,彼此之间很可能存在相互影响。
2.出生后催乳素细胞的数量调节:催乳素细胞约占成年垂体内分泌细胞的20%~30%,在妊娠和哺乳期母鼠垂体中催乳素细胞大量扩增,占比甚至可以超过50%。正是由于成年垂体中催乳素细胞具有很大的增殖潜力和可塑性,临床上催乳素瘤是垂体肿瘤的最常见类型之一。成年垂体中催乳素细胞的数量增加主要有两条途径:一是通过催乳素细胞的自身增殖,这一过程受局部和全身分泌的各种释放因子和抑制因子调控;另一条途径是通过垂体组织中干细胞的增殖和分化。近年来,对成年垂体干细胞的研究有很大进展。目前认为,出生后的垂体中仍存在大量干细胞,主要位于垂体前叶和中叶交界处的边缘区,它们不仅参与了垂体形态的维持,还在垂体损伤后修复的过程中发挥重要作用[2]。但目前尚无一种可靠的标志物能鉴定出所有成年垂体干细胞。一项以SOX2为干细胞标志和另一项以Nestin为干细胞标志的研究显示了相似的结果,腺垂体中干细胞在出生后7天时增殖最活跃,体外分离培养的垂体干细胞具有进一步分化为所有类型内分泌细胞的能力。虽然SOX2是一种比较公认的干细胞标志物,但仍不能代表所有的垂体干细胞,文献已报道的成年垂体中具有干细胞特性的细胞群有“侧群细胞(side population)”、“SOX2阳性细胞”和“nestin阳性细胞”。笔者所在实验室的研究显示,成年垂体中也存在少量PRL/GH双阳性前体细胞,这可能是干细胞向催乳素细胞分化的中间过程。
二、催乳素细胞分化的分子调控
1.催乳素系前体细胞的分化调控机制:胚胎第8.5天,在间脑腹侧神经外胚层上皮分泌的骨形态生成蛋白4(bone morphogenetic proteins 4,BMP4)和Wnt/β-catenin等信号通路调控下,转录因子Pitx2开始表达,标志着垂体基板的分化出现。胚胎第9.5天,间脑腹侧分泌的成纤维细胞生长因子8(fibroblast growth factor 8,FGF8)和音猬因子(sonic hedgehog,Shh)信号通路共同作用诱导Lhx3表达,颅颊囊(rathke′s pouch,RP)分化出现,形成了早期腺垂体的雏形。胚胎第11.5天开始表达的PROP1转录因子可以通过激活Zeb2等基因来启动垂体干细胞的上皮间充质转化过程,使垂体干细胞变为过渡期细胞。在这一过程中,干细胞标志物SOX2的表达随之减少,细胞间的钙黏蛋白、紧密连接蛋白减少,基质金属蛋白酶表达增多,以便进行下一步的细胞特异性分化[3]。胚胎第13.5天PROP1阳性干细胞中的一部分开始表达Pit-1。接下来Pit-1阳性细胞中的一小部分在胚胎第14.5天分化为促甲状腺素细胞,其余的在胚胎第15.5天分化出生长激素细胞和催乳素细胞(图1)。
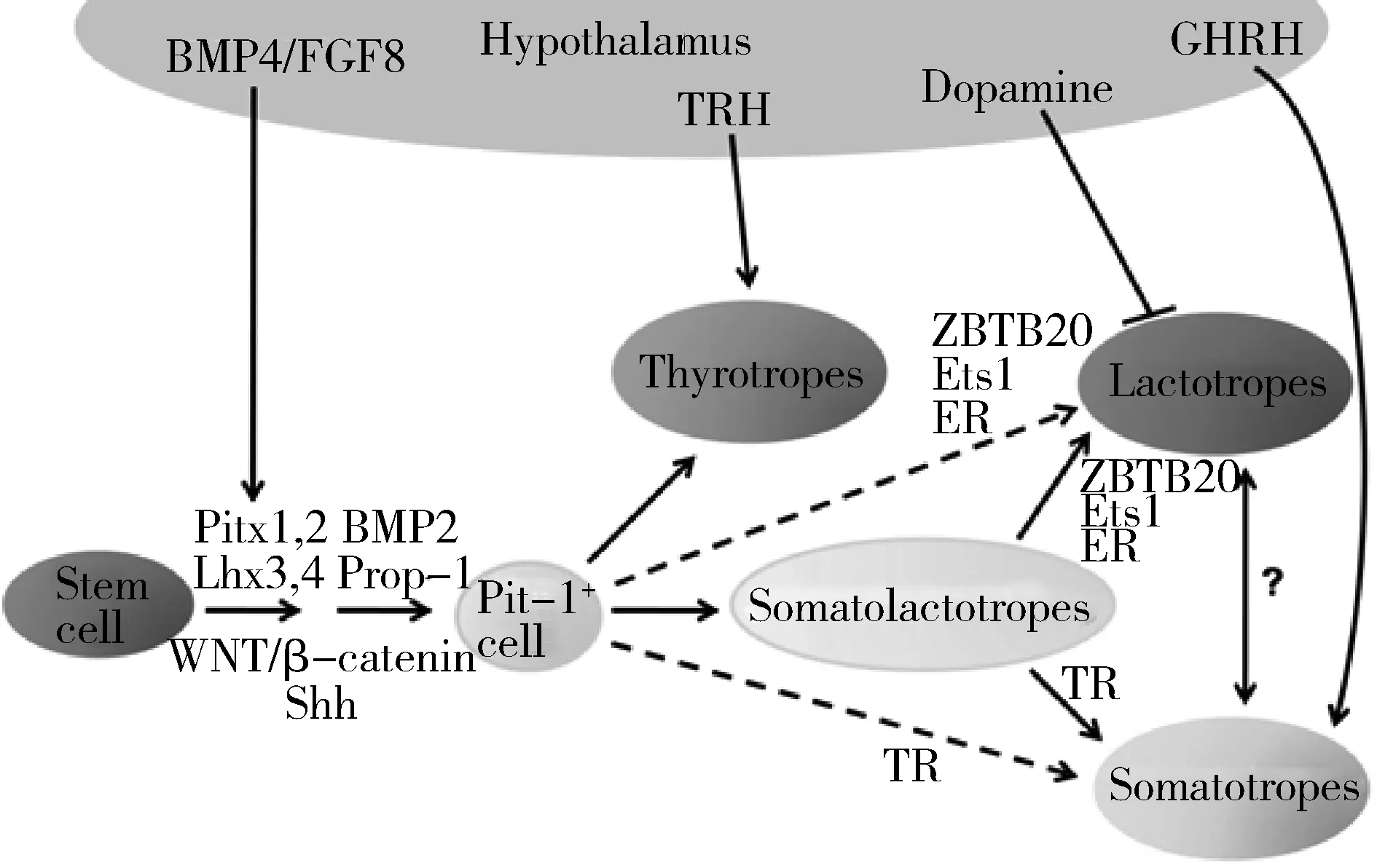
图1 腺垂体Pit-1阳性细胞谱系的分化过程
在催乳素细胞分化命运决定方面,Pit-1一直以来被认为是调控其分化发育的特异性和关键性分子。胚胎第13.5天,Wnt/β-catenin信号和转录因子Prop1、Atbf1开始诱导Pit-1表达,胚胎第16.5天Pit-1与自身基因启动子区结合,通过正反馈作用维持表达,直到围产期Pit-1的表达才减少至消失。然而,由于Pit-1的靶基因除Prl外,还包括Gh、Tshβ和Ghrhr,因此在调控催乳素细胞分化上并不特异。该基因缺失小鼠表现为GH、PRL和TSH的联合缺失,临床上Pit-1突变患者大多也表现为GH和PRL的联合缺失,伴或不伴有TSH缺失。近年来笔者所在实验室发现并报道了转录因子ZBTB20可能是决定催乳素细胞分化特异性的关键分子[1]。ZBTB20起始表达于胚胎第14.5天的RP,该基因全身敲除小鼠表现出以催乳素细胞群特异性缺失为特征的垂体发育不良,这是目前为止发现的唯一一个缺失后只影响催乳素细胞单谱系分化发育的基因。ZBTB20可能作用于Pit-1阳性前体细胞向催乳素细胞直接分化以及PRL/GH双阳性过渡细胞向催乳素细胞终末分化的过程。
2.出生后催乳素细胞数量的调控机制:出生后垂体催乳素细胞的分化和增殖主要受体内激素和来自下丘脑信号的共同调节,其中雌激素和PRL释放因子促进PRL的合成释放及催乳素细胞的增殖,而多巴胺和PRL抑制因子则抑制PRL的合成释放及催乳素细胞的增殖。参与调节的信号通路包括cAMP和PKA信号通路、MAPK信号通路、PI3K信号通路、TGF信号通路、Hippo信号通路和CK2信号通路[4]。在ZBTB20基因敲除小鼠中研究发现,ZBTB20分子可促进垂体生长激素细胞的增殖,其在成年垂体中对催乳素细胞的增殖以及干细胞向催乳素细胞分化的影响有待于进一步研究[1]。
三、PRL的生理功能和表达调控
催乳素细胞分化成熟的标志是产生和分泌PRL,PRL入血后作为重要的信使分子参与靶器官的发育和功能调节。PRL和GH以及胎盘催乳激素(placental lactogen,PL)三者同属于一个激素家族。人垂体PRL基因编码产物为227个氨基酸的激素前体,包含28个氨基酸的信号肽和199个氨基酸的成熟PRL。大小鼠的成熟PRL蛋白则由197个氨基酸构成。经典的PRL功能包括参与生殖腺和乳腺发育、调节泌乳过程和维持内环境稳定。最早报道的PRL全身敲除小鼠主要表现为雌性小鼠不育和乳腺发育不全,以及泌乳期母性行为的改变。然而,随后的研究发现乳腺、卵巢、前列腺、睾丸、淋巴细胞、脑和脂肪等多种外周组织也可表达PRL[5, 6]。目前已知,PRL的功能涉及免疫调节、离子转运、血小板聚集、脂肪细胞分化和胰岛功能调节等生理学过程,以及肿瘤生长和围产期心肌病等病理过程[7~9]。
垂体外PRL和垂体PRL虽然在蛋白序列、构象和功能上完全一致,但它们的表达调控机制完全不同。两者有着不同的转录起始位点,使得垂体外PRL mRNA的5′端多了150bp的非编码外显子(exon 1a)。由于垂体PRL是催乳素细胞分化成熟的标志物,因此多年来,研究者试图通过阐明垂体PRL的转录调控机制来揭示催乳素细胞和生长激素细胞分化差异的分子开关。利用转基因小鼠模型分析PRL基因近端(垂体)启动子区发现,其5′端3kb序列足以调控垂体PRL的表达。该序列包含一个近端启动子区(-422~+33bp)和一个远端增强子区(-1.8~-1.5kb)(图2)。近端启动子区含有Pit-1、Ets-1和Pitx的结合位点,介导各种刺激对PRL的转录调节。其中,Pit-1和Ets-1相互作用介导FGF和促甲状腺素释放激素(thyrotropin-releasing hormone,TRH)经Ras/MAPK通路诱导的PRL表达。Pit-1还能与Pitx1、Pitx2和C/EBP相互作用介导PRL表达[10]。但上述转录因子和共作用分子的缺失往往影响多群内分泌细胞的分化。PRL基因的远端增强子区含若干个Pit-1结合位点(PRL-1P)和一个雌激素受体反应元件(estrogen receptor element,ERE),Pit-1和雌激素受体(estrogen receptor,ER)相互作用可特异性介导雌激素诱导的PRL转录。除了正调节因子外,PRL的表达还受一些负调节因子的影响。最经典的通路是,下丘脑分泌的多巴胺与催乳素细胞表面的多巴胺D2受体(dopamine receptor D2,DRD2)结合,DRD2与抑制型G蛋白偶联,下调胞内的cAMP和钙,并募集共抑制因子组蛋白去乙酰化酶(histone deacetylase,HDAC),从而抑制PRL的表达。此外,还有文献报道,在大鼠垂体瘤细胞系中C/EBP可与Pit-1蛋白竞争性结合PRL基因上游的Pit-1结合位点,从而抑制PRL表达[10]。但是,无论ER还是DRD2的敲除都不影响催乳素细胞的分化出现。
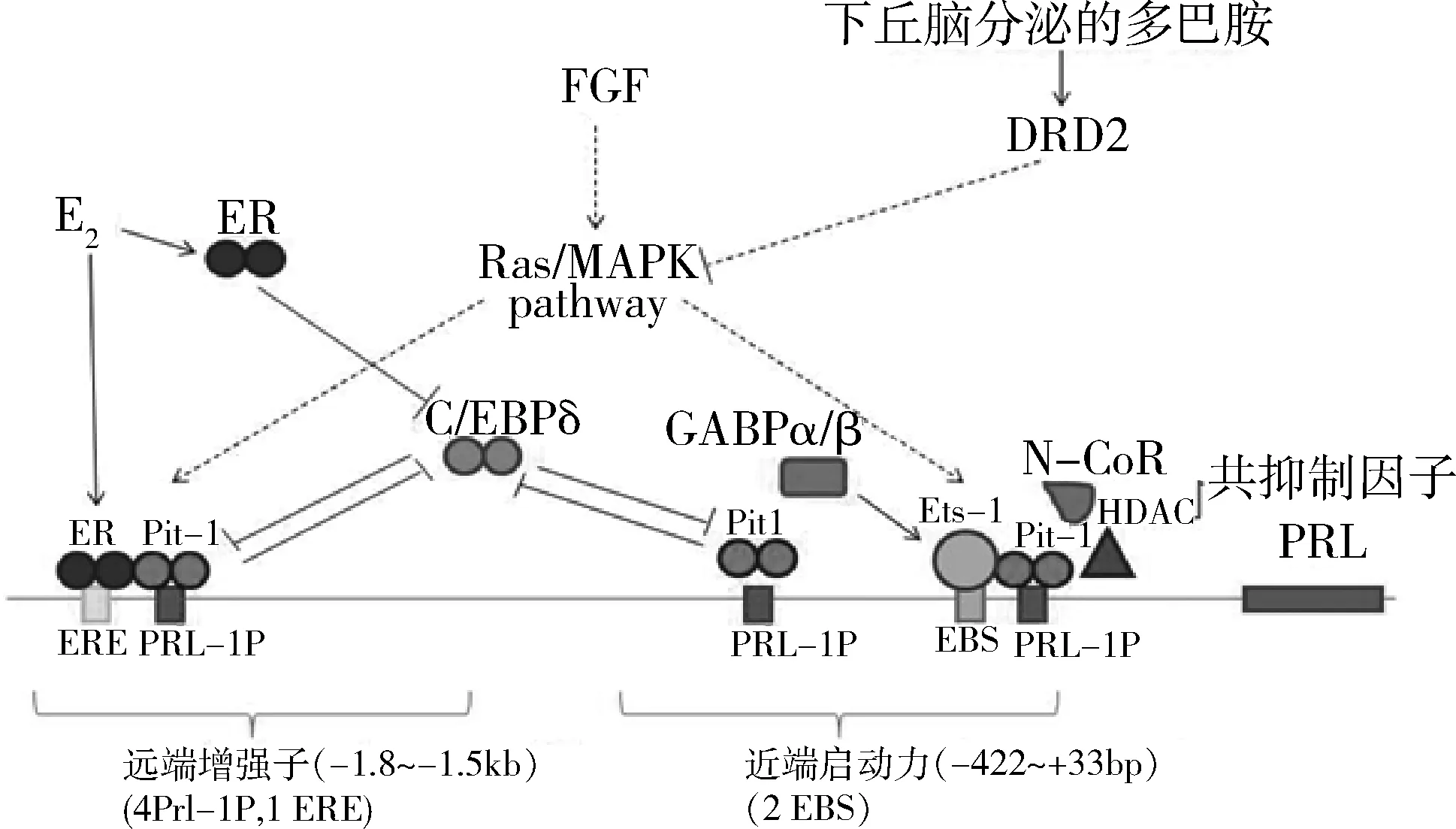
图2 垂体PRL基因的转录调节模式图
在参与催乳素细胞分化发育调控的众多转录因子中,ZBTB20是目前已知的特异性最高的调控分子。ZBTB20是笔者所在实验室率先发现并报道的BTB锌指蛋白家族成员,由741个编码氨基酸组成。ZBTB20的生物学功能广泛,已报道的包括参与体内糖脂代谢、海马发育、免疫调节、疼痛和伤害感受调节、肝细胞再生、软骨发育、垂体发育、昼夜节律调节以及肝癌发生等[1,11~19]。ZBTB20基因敲除小鼠的垂体表现为催乳素细胞群的完全缺失,而其他内分泌细胞的分化不受影响,这也是目前唯一的以垂体催乳素细胞单一性缺失为表型的基因敲除小鼠模型。在其他组织中,ZBTB20既可以作为转录激活因子也可以作为转录抑制因子发挥作用[15,17,20]。而ZBTB20调控垂体PRL表达的分子机制尚未完全阐明,目前已知垂体ZBTB20通过与PRL基因启动子直接结合从而激活其转录,但其具体结合的位点和可能的共作用因子有待进一步研究[1]。
四、展 望
尽管人们对于垂体内分泌细胞的分化发育过程已有相当多研究,但是精细的调控机制尚未完全阐明,尤其是有着共同分化起源的生长激素细胞和催乳素细胞的分化命运决定机制依旧存在许多的未知有待进一步探索。近年来,笔者所在实验室发现,锌指蛋白转录因子ZBTB20可能是决定催乳素细胞分化特异性的重要分子,这为阐明催乳素细胞分化发育的机制提供了很好的研究方向。当然,有关催乳素细胞的分化发育过程以及ZBTB20发挥作用的具体机制方面仍有以下很多问题值得研究:①明确经PRL/GH双阳性细胞分化或由Pit-1阳性前体细胞直接分化这两种分化方式在成熟催乳素细胞中的所占比例,从而评价这两种分化方式在催乳素细胞分化过程中的重要性;②ZBTB20调控PRL表达的具体机制,及与已知的信号分子和转录因子间的相互作用;③成年期垂体ZBTB20在细胞分化和增殖中的作用,及与垂体瘤之间的关系。
综上所述,由于垂体发育及其相关疾病具有多样性和复杂性,关于垂体内分泌细胞发育机制,信号的调控、干细胞医疗仍然具有许多值得探索开拓的领域。这也是为未来可能出现的基因疗法、胚胎治疗、早期阻断等先进的诊疗手段提供准确的理论基础。
