载VEGF和BMP-2的PDLLA涂层螺钉治疗股骨颈骨折的实验研究
2019-08-12刘小翠丁佳骏刘圣珺梁素萍徐佳依李增春
韩 宁 刘小翠 丁佳骏 刘圣珺 梁素萍 徐佳依 李增春
股骨颈骨折约占全部骨折总数的3.58%,且发生率日益增高,预计到2025年,全球股骨颈骨折数量将突破400万例[1]。而股骨颈骨折临床治疗中的骨折不愈合和股骨头缺血坏死,常导致患者病残[2,3]。
目前,解剖复位股骨颈骨折并加压固定骨折端已经形成共识[1]。早期骨折复位有助于恢复因骨折而扭曲的残存股骨头血供;牢固的内固定可避免骨折端再次移位造成血供破坏,为微血管的再生爬行提供良好环境[4,5]。但股骨颈骨折术后骨折不愈合发生率仍高达10%~30%,股骨头缺血性坏死发生率约为15%~30%[6]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种特异性促血管内皮细胞增生及血管生成因子,对血管再生起着关键性作用[7,8]。骨形成蛋白2(bone morphogenetic protein 2,BMP-2)被认为是活性最强的唯一能单独诱导成骨的因子,在骨的生长和损伤修复中发挥重要作用[8]。因此,笔者在内固定表面制备具有生物活性的BMP-2和VEGF涂层,诱导股骨颈骨折端和股骨头内微血管和新骨形成,促进股骨颈骨折愈合避免股骨头缺血坏死。
材料与方法
1.材料:新西兰大白兔和昆明小鼠由同济大学动物中心提供。高糖DMEM培养基购自美国Gibco公司,胎牛血清购自以色列Beit Haemek有限公司,含0.02%EDTA的0.25%胰蛋白酶(美国Gibco公司),人重组VEGF和人重组BMP-2标准品(美国Sigma公司),培养瓶,24孔板(美国Corning公司),紫外光分光光度仪(德国Eppendoff公司)。
2.PDLLA涂层的体外释放检测:聚消旋乳酸[poly(D,L-lactide),PDLLA]以50mg/ml的浓度在室温下溶解在有机溶剂乙酸乙酯中。100μg人重组VEGF和100μg人重组BMP-2标准品分别混匀于5ml PDLLA溶液中,充分浸泡无菌直径3.5mm不同长度的钛合金螺钉并在无菌层流条件下风干,此过程重复两次。60Co辐照灭菌,无菌包装备用。
配制VEGF和BMP-2对照品液,以磷酸盐缓冲液(PBS)为空白,紫外分光光度计在200~700nm范围内分别确定VEGF和BMP-2的最大吸收波长。分别精密称取VEGF和BMP-2对照品0.05g置100ml容量瓶中,以PBS定容,得到500μg/ml的溶液,然后分别稀释,得到浓度分别为400、300、200、100、50、20、10μg/ml一系列标准溶液。分别用紫外分光光度计测定吸光度值,制备标准曲线。
将载VEGF和BMP-2的PDLLA涂层钛合金螺钉,浸入含20ml磷酸盐缓冲液(PBS,pH值=7.4)的培养瓶中,于37℃恒温振荡(60r/min)水浴中,在预定的时间间隔点(1h、4h、8h、12h、1天、14天、28天、56天、84天)各取出100μl。用紫外分光光度计测定释放液吸光度,对照标准曲线,计算VEGF和BMP-2的含量。每个样品分别测定3次。
3.载VEGF和BMP-2的PDLLA涂层螺钉的生物相容性:DMEM高糖培养液(含10%小牛血清)浸提VEGF和BMP-2的PDLLA涂层钛合金螺钉(依照GB/T 16886和ISO 10993,材料质量与浸提介质体积比1g∶5ml),浸提条件为37℃,72h,后以1200r/min离心5min,吸取上清液并经0.22μm微孔滤膜过滤除菌,即得实验用样品的浸提液备用。
4.体内全身急性毒性检测、热原反应和溶血实验:依据GB/T 16886和ISO 10993医疗器械生物学评价规定,进行体内全身急性毒性检测、热原反应和溶血实验。
(1)全身急性毒性检测:选用健康昆明小鼠12只,6周龄,雌雄各半,体质量15~26g。将小鼠随机分实验组和对照组两组,每组6只。实验组小鼠腹腔注射样品浸提液,每只小鼠注射剂量为50ml/kg;对照组腹腔注射无菌0.9%NaCl注射液50ml/kg,于注射后即刻及24、48、72h观察和记录实验组和对照组动物一般状态、毒性表现和死亡动物数。于注射前及注射后24、48、72h称重并记录两组动物的体质量变化。
(2)热原反应:选用健康成熟新西兰大白兔12只,雌雄不限,体质量2.2~2.5kg,随机分实验组和对照组2组,每组6只。自实验组新西兰大白兔耳缘静脉静脉注射温度为38℃的样品浸提液(10ml/kg),对照组耳缘静脉注射温度为38℃的含10%胎牛血清的DMEM培养液(10ml/kg)。注射后每隔1h测量体温1次(测体温时用精确肛温计插入新西兰大白兔肛门约6cm左右,测温时间1.5min),共3次,3次体温中最高的1次减去注射前体温即为体温升高值。若体温升高<1.4℃说明没有致热源物质存在。
(3)溶血实验:选用新西兰大白兔6只,雌雄不限,体质量2.2~2.5kg。抽取健康新西兰大白兔静脉血10ml,加入2%草酸钾0.5ml,以0.9%生理盐水10ml稀释制备新鲜稀释兔血。将实验组(样品浸提液)、阴性对照组(生理盐水)、阳性对照组(双蒸水)各组试液10ml分别置于50ml三角瓶中,37℃水浴30min。加入新鲜稀释兔血0.2ml摇匀,37℃水浴60min,以2000r/min离心5min取上清,紫外分光光度计于波长545nm测吸光度,实验组和对照组吸光度均取3瓶平均值。溶血程度用溶血率(%)表示,为[(实验样品的吸光度值-阴性对照的吸光度值)/(阳性对照的吸光度值-阴性对照的吸光度值)]×100%。若实验组溶血率>5%为阳性反应,表示有溶血现象。
5.体外细胞毒性实验:(1)骨髓间充质干细胞培养及传代扩增:密度梯度离心联合差速贴壁法分离新西兰大白兔的骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSC)。于新西兰大白兔髂骨穿刺获得骨髓重悬于DMEM高糖完全培养液(含10%胎牛血清,100U/ml青霉素和100μg/ml链霉素),充分混匀后叠加到10ml percoll分离液(d=1.073g/ml)上层液面,900×g离心20min。PBS洗涤中间单核细胞层两次,单细胞悬液以5×108/ml接种于25cm2培养瓶。置37℃、相对体积分数为5%CO2、饱和湿度的细胞孵箱培养48~72h后全量换液,弃去未贴壁细胞,以后每2~3天换液1次。生长至80%融合后以含0.02%EDTA的0.25%的胰蛋白酶消化传代。取2×104个/毫升第3代BMSC细胞悬液备用。(2)细胞毒性实验:96孔板内设实验组、阳性对照组和阴性对照组,每组6复孔。每孔接种100μl第3代BMSC细胞悬液后,置于37℃、5%CO2细胞培养箱中培养,24h后弃去原培养液,PBS冲洗。实验组加入200μl材料浸提液,阳性对照组加入200μl含0.64%苯酚和10%胎牛血清的DMEM培养液,阴性对照组加入含10%胎牛血清的DMEM培养液。置于37℃、5%CO2细胞培养箱中继续培养。分别于培养24、48和72h后各取一块培养板,各孔加入20μl的5%MTT,继续培养4h后弃去孔内液体并加入150μl二甲基亚砜(DMSO),振荡10~15min,波长490nm处自动酶标检测仪测吸光度。根据6级毒性评级标准计算各组相对增殖率(relative proliferation rate,RGR),RGR=实验组吸光度值/阴性对照组吸光度值。
6.新西兰大白兔股骨颈骨折动物模型的建立和分组:健康成熟新西兰大白兔12只,一级动物,雌雄各半,体质量2.5~3.9kg。将兔的右后肢作为实验侧,左后肢作为自身对照侧。实验侧应用直径3.5mm载VEGF和BMP-2的PDLLA涂层螺钉固定;而对照侧以直径3.5mm螺钉固定。10%戊巴比妥钠25mg/kg静脉注射麻醉,开通静脉补液通道。新西兰大白兔俯卧位,常规备皮,消毒铺巾。取双侧髋关节外侧弧形切口,长约5cm,依次切开皮肤、皮下、深筋膜,内旋下肢切断外旋肌群,保护坐骨神经,十字切开关节囊,显露股骨颈,微型摆锯于股骨颈基底部横行截断股骨颈,直视下复位,经股骨矩向股骨头钻孔、测深并置入直径3.5mm载VEGF和BMP-2的PDLLA涂层螺钉1枚固定。重新消毒铺巾,相同技术制作左侧股骨颈骨折,经股骨矩向股骨头钻孔、测深并置入3.5mm普通螺钉1枚固定作为对照组。术后允许自由活动,自由饮食。术后3日内每日予青霉素80万单位肌内注射。术后两周拆线。
7.检测方法:(1)髋关节X线检测:术后12周,取俯卧位摄髋关节X线片,所有摄片均采用同批底片,曝光条件相同(电压55kV、电流55mA,曝光时间0.3s,焦距90cm),观察股骨颈骨折愈合过程及股骨头密度变化。(2)micro-CT检测:术后12周,麻醉状态下处死新西兰大白兔将双侧股骨近端完整取出,去除固定螺钉,各组标本行体外高分辨率micro-CT扫描。球管电压 80kV,电流 80mA,曝光时间 3000ms,分辨率14mm,旋转角度360°,旋转角度增量0.5°。使用美国GE公司配套软件对标本进行三维重建,在股骨颈和股骨头内以直径3mm,高6mm圆柱形区域作为感兴趣(ROI)。分析骨密度(BMD)、骨小梁厚度(Tb.Th)、骨小梁间距(Tb.Sp)、骨小梁数量(Tb.N)和骨体积分数(BV/TV)。
8.组织学分析:甲醛固定标本,流水冲洗过夜,10% EDTA溶液脱钙2周。标本流水冲洗过夜,乙醇梯度脱水、透明、浸蜡、包埋、切片,切片厚约5μm,常规HE染色,光镜下观察术后12周骨折的愈合、股骨头缺血反应及修复。用计算机辅助图像分析系统以5个随机200倍视野血管的均数表示该组织的微血管密度,检测股骨头内微血管变化。
结 果
1.PDLLA涂层的体外释放检测:取20μg/ml含VEGF和BMP-2的PDLLA溶液5ml,将直径3.5mm皮质骨螺钉充分浸泡,并在无菌层流条件下风干螺钉,此过程重复两次。VEGF和BMP-2在最初的8h内药物是爆发性的释放,随后是比较持续和稳定的释放,并且释放可以持续12周。术后1h、4h、8h、12h、1天、14天、28天、56天和84天PDLLA涂层螺钉中VEGF缓释量分别为1.16±0.10、2.28±0.44、15.99±1.41、19.09±0.98、19.51±0.80、19.87±0.75、21.20±0.63、34.84±1.22、47.62±1.46mg/L。术后1h、4h、8h、12h、1天、14天、28天、56天、84天 PDLLA涂层螺钉中BMP-2缓释量分别为1.21±0.36、2.50±0.41、17.51±0.70、19.28±0.59、19.46±0.62、20.43±0.55、21.37±0.33、32.04±0.89、40.72±2.01mg/L。
2.载VEGF和BMP-2的PDLLA涂层螺钉的生物相容性:(1)体内全身急性毒性检测、热原反应和溶血实验:在72h观察期内,对照组和实验组小鼠一般情况良好,活动、食欲正常,呼吸平稳,无惊厥、腹泻、瘫痪和动物死亡等毒性反应。实验组(0.40±0.22)和对照组(0.40±0.26)体温升高,两组比较差异无统计学意义,且体温升高值<1.4℃,该样品符合热原检查的规定。浸提液溶血率0.96%,低于GB/T 16886和ISO 10993规定的5%,符合溶血实验的规定。(2)体外细胞毒性实验:实验组(0.31±0.02、0.52±0.07、0.77±0.05)和阴性对照组(0.30±0.02、0.53±0.07、0.79±0.10)在24、48和72h的A值均明显高于阳性对照组(0.19±0.02、0.21±0.03、0.28±0.06,P<0.01),实验组与阴性对照组比较,差异无统计学意义(P>0.05)。实验组在24、48和72h的RGR(1.01、0.99和0.97)均显著高于阳性对照组(0.62、0.40和0.36)。
3.新西兰大白兔股骨颈骨折动物模型的建立和分组:制作12只新西兰大白兔股骨颈骨折模型,右侧作为实验侧置入3.5mm载VEGF和BMP-2的PDLLA涂层螺钉1枚固定,左侧置入3.5mm螺钉作为自身对照侧。术后12周内所有实验兔活动逐渐恢复正常。切口愈合良好,均于术后2周拆除切口缝线,无明显炎性反应、切口裂开及关节脱位发生。
4.髋关节X线检查:术后12周显示双侧股骨颈骨折解剖复位,内固定坚强,采用涂层螺钉固定的右侧股骨颈骨折已愈合,采用普通螺钉固定的左侧股骨颈骨折处尚未完全愈合(图1)。
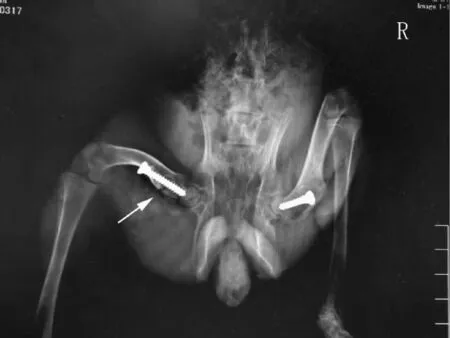
图1 术后12周髋关节X线检查置入复合VEGF和BMP-2涂层螺钉的右侧股骨颈骨折愈合,置入普通螺钉固定的左侧股骨颈骨折尚未完全愈合(白色箭头)
5.micro-CT:实验侧股骨近端BMD(323.42±43.31mg/mm3)、BV/TV(0.32±0.072)、Tb.Th(0.16±0.074mm)和Tb.N(2.15±0.43/mm)均较对照侧明显增加(P<0.01),Tb.Sp(0.30±0.12mm)较对照侧(0.78±0.31mm)降低(P<0.01),详见表1。

表1 股骨近端micro-CT检测
与对照侧比较,*P<0.01
6.组织学分析:术后12周,涂层螺钉和骨接触界面多由血管化的新生骨组织构成,而非涂层侧钛合金和骨组织间为纤维组织层。实验侧钉道周边微血管较对照侧增多稠密。实验侧股骨近端每×400视野微血管数目(39.17±14.27)均较对照侧(19.50±6.97)明显增加(P<0.01)。双侧均未检出股骨头坏死的组织学改变。

图2 HE染色观察股骨颈骨折愈合(×400)A.实验侧钉道周边骨小梁增粗增多,微血管密度增加;B.对照侧钉道周围纤维组织增生,骨化和微血管密度明显下降
讨 论
股骨头颈部的滋养动脉主要来自于股骨远端,股骨颈骨折几乎等同于将股骨头颈的血液供应完全切断,易导致股骨颈骨折不愈合和股骨头坏死。本研究应用载VEGF和BMP-2的PDLLA涂层螺钉固定新西兰大白兔股骨颈骨折,促进骨折端微血管形成,股骨颈和股骨头内骨小梁增粗致密,加速股骨颈骨折愈合。而及早恢复股骨头的血供,减少股骨头缺血的时间,是降低股骨头坏死发生率的关键[8~10]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种特异性促血管内皮细胞增生及血管生成因子,对血管再生起着关键性调控作用[8,9]。本研究也证实涂层螺钉释放的外源性VEGF显著增加股骨颈和股骨头内微血管数量。VEGF诱导的血管生成能增加骨折端血流量,促进软骨内成骨及骨修复,加速骨折愈合;拮抗VEGF作用骨折端完全由纤维组织取代,抑制骨折愈合,X线提示骨折端出现肥大的不连续骨痂或无骨痂[10]。BMP-2被认为是活性最强的唯一能单独诱导成骨的因子,促进未分化间充质细胞和成骨细胞前体细胞分化为成骨细胞,促进骨缺损修复和骨折愈合[8]。联合应用BMP-2与VEGF既能诱导成骨,又能刺激血管再生,使新生的骨组织快速完成血管化[8]。本研究通过PDLLA将VEGF和BMP-2附着于内固定螺钉,显著促进股骨颈和股骨头内骨小梁增粗增多,使股骨颈骨折愈合加快,进一步证实了VEGF和BMP-2在骨折修复中的关键作用。
目前BMP-2或VEGF应用方式主要为附着于固态人工骨局部置入或液态载体局部注射于骨折端[11,12]。但目前股骨颈骨折的治疗多采用闭合复位技术,术中不显露骨折端,牵引床复位后经股骨外侧3~5cm小切口置入直径6.5mm或7.3mm半螺纹空心钉,经长约70~100mm钉道对股骨颈骨折端进行加压固定。因此,往往难以将BMP-2或VEGF固态载体经狭长钉道置入骨折断端,临床操作困难。有研究者构建BMP-2或VEGF可注射性载体并在空心螺钉上靠近骨折端的部位打孔,便于BMP-2和VEGF有效作用于骨折断端。但此种技术会导致螺钉力学性能下降,甚至疲劳折断[13,14]。本研究将BMP-2和VEGF附着于内固定螺钉表面,在钉道全长均匀释放发挥生物学作用,增加微血管数量、骨小梁数量和厚度,促进股骨颈骨折愈合。
自20世纪60年代以来,以PDLLA为代表的可降解性材料在医学界就引起了关注。由于PDLLA为非晶态,无迟发性组织反应,生物相容性好,对骨修复干扰小,且降解吸收时间短,广泛应用于生物降解医用材料领域[15]。本研究中,PDLLA涂层螺钉的全身急性毒性检测、热原反应、溶血实验和体外细胞毒性实验也证实了其良好的生物相容性。由于PDLLA呈多孔态结构,有较高的孔隙率且孔隙间相互沟通,是一种具有良好生物相容性的可降解缓释骨架,也是BMP-2和VEGF的常用控释载体[16,17]。本研究应用PDLLA负载商品化的具有活性的VEGF和BMP-2,获得至少12周的VEGF和BMP-2 持续释放。李绍良等[18]应用PDLLA负载庆大霉素附着于钛制克氏针表面进行涂层稳定性实验,证明PDLLA涂层具有较强的机械稳定性,在置入髓腔的过程中绝大部分无脱失,并且可以保持PDLLA涂层在内固定表面均匀分布。因此,借助PDLLA负载BMP-2和VEGF固着于内固定螺钉表面治疗股骨颈骨折,并显著促进了股骨颈骨折愈合,有力证明了PDLLA涂层能够提供足够机械稳定将VEGF和BMP-2释放至骨折端发挥生物学效应,为微血管和新生骨的再生提供良好环境。
另一方面,空心螺钉采用滑动加压原理,螺杆提供滑动轴,将应力转化为轴向压应力,加压骨折断端,即使骨折修复过程中发生骨吸收块,仍能保持骨折块间紧密接触[19]。这一特性在有力保护骨折的愈合环境的同时,可能导致股骨颈短缩,有研究发现空心螺钉固定后股骨颈短缩率达30%~42%,降低临床疗效[20,21]。本研究发现涂层螺钉和骨接触界面多由血管化的新生骨组织构成,而非涂层侧钛合金和骨组织间为纤维组织层,表明复合VEGF和BMP涂层有助于增加空心螺钉把持力,同时BMP-2和VEGF促进骨修复的生物学效应可能有助于避免骨折断端骨吸收所致的股骨颈短缩,改善临床疗效。虽然本研究中双侧均未发现股骨头坏死,但涂层侧股骨近端骨小梁增粗增多致密、骨密度升高、微血管数量增加,具有抑制股骨头坏死的作用。
综上所述,载VEGF和BMP-2的PDLLA涂层生物相容性好,能够牢固附着于钛合金螺钉表面,促进股骨近端微血管增生和新生骨形成,加速股骨颈骨折愈合。该涂层制作简便,生物学效应显著,在股骨颈骨折治疗领域具有广阔的应用前景。
