感染人附红细胞体SD大鼠模型的构建
2019-08-12刘寰宇
白 静 陈 瑶 郝 雷 刘寰宇
人附红细胞体病(human eperythrozoonosis,HE)是由附红细胞体寄生于人红细胞表面、血浆、骨髓等多部位引起的一种人兽共患性传染病[1]。该疾病广泛存在于许多国家和地区,多发于夏秋季节,条件性致病,具有感染率高,发生率低的特点,免疫力低下时易发病[2]。一般认为接触传播、血源性传播、垂直传播、以及昆虫媒介传播等,为可能的传播途径。附红细胞体感染后是否发病,由个体的免疫状态决定。病变主要在肝脏、脾脏、淋巴结,也可累及心肺[3]。主要临床表现为发热、贫血、乏力、出汗、脱发,关节疼痛,严重时出现黄疸、肝脾大等[4]。临床诊断主要以在血液中查出附红体并伴有发热、贫血、乏力、关节肿大等典型表现并结合其职业、居住地区等进行综合判断。目前临床治疗上,可用的药物种类繁多,有四环素类、氨基糖苷类和青蒿霉素等,但多数用药后虽可控制临床症状,但极易复发[5]。 鉴于附红细胞体病的研究现状,对其发病机制进行深入研究显得尤为重要,但自1921年附红细胞体病首次被报道后,2000年出现短暂的研究热度至今,研究进行缓慢,一方面是关于此病的临床报道少,病例收集困难;另一方面,实验室研究中多集中于畜牧兽医对猪、牛等经济动物模型的构建及研究,对于人附红细胞体动物感染模型的构建,尚未见报道。因此,本研究通过人工感染实验动物的方法,建立人附红细胞体感染的动物模型,可为人附红细胞体病发病机制的研究奠定基础,以期推进人附红细胞体病的临床研究。
材料与方法
1.实验动物:SPF级SD大鼠30只,6周龄,雌雄各半,购自北京维通利华动物公司,实验动物许可证号:SCXK(京)2012-0001。
2.分组:动物进入动物饲养中心后立即经尾静脉采血,血涂片瑞氏染色,经油镜观察有无附红细胞体感染。确定无附红细胞体感染后,用随机数字表法将所有动物分为两组,模型组和对照组。
3.饲养管理及环境:模型组15只和对照组15只单笼、单室、分开饲养于内蒙古医科大学动物中心屏障管理系统,饮用高压灭菌水,食用SPF级鼠粮。采用8h和16h明暗交替照明,室温控制在18~29℃,湿度控制在30%~40%。
4.人附红细胞体血液样本筛选:人附红细胞体血液样本来源于内蒙古医科大学第二附属医院入院的患者,经静脉无菌采集抗凝血,经血涂片瑞士染色,油浸物镜(10×100oil)检查其附红细胞体感染情况。在血涂片的头、体、尾部各随机选取3个视野,每个视野计数200个红细胞,计数200个红细胞中被附红体感染的红细胞的个数,被感染红细胞的总数与红细胞总数的比值再乘以百分之百,即为该张血片的感染率。每张血片,计数3次,取平均值作为最终感染率。低于30%为轻度感染,30%~60%为中度感染,高于60%为重度感染。从中筛选重度感染的患者血样备用。
5.分离纯化人附红细胞体:筛选出的重度感染的人附红细胞体患者的抗凝血,2000r/min,离心10min,弃去上清液。在所剩的红细胞泥中加入等体积阿氏垂悬红细胞悬液。将其转移置大号离心管中,加入等体积的淋巴细胞分离液,2500r/min,离心20min,弃去白细胞层,将红细胞泥用等体积的阿氏液垂悬,50℃水浴30min,使附红细胞体与红细胞分离。2000r/min离心30min,弃去上清,所得沉淀垂悬于适量的阿氏液(2.05g葡萄糖、0.42g氯化钠、0.80g柠檬酸钠、加蒸馏水至100ml,pH值为6.1,过滤后高压灭菌)中,并用血细胞计数板将浓度调整为1×107个/微升此时用显微镜观察,视野中可见运动中的、大小不一的附红细胞体。
6.人附红细胞体感染SD大鼠模型构建:(1)模型组:每只SD大鼠,腹腔注射人附红细胞体分离纯化液100μl(浓度为1×107个/微升),每日1次,连续3天。对照组:每只SD大鼠,腹腔注射无菌生理盐水100μl,每日1次,连续3天。实验期间(0、3、5、7、9、11天),每天上午8点,用电子体温计测量记录大鼠肛温,同时观察大鼠的精神状态、摄食饮水情况、皮肤、巩膜有无黄染、脱毛严重与否。
7.检测人附红细胞体感染SD大鼠的感染率:腹腔注射的SD大鼠第0、3、5、7、9、11天,于鼠尾静脉采血进行瑞氏染色。在血涂片上,根据血膜大小滴加3~5滴瑞氏染液(1.2g瑞氏染粉、80ml甘油、600ml甲醇,常温放置3个月后,过滤使用),使其迅速盖满血膜。再加1倍量的缓冲液,使染液与缓冲液充分混合,染色10min,固定血片。水洗30s,自然干燥后,经油浸物镜光学显微镜检查计数其感染率,并观察红细胞大小、形态、颜色。
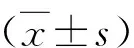
结 果
1.重度感染人附红细胞体患者血液样本筛选结果:在300例患者中筛选出18例附红细胞体重度感染患者血液样本(图1)。图1A为无感染人附红细胞体血涂片,可见表面光滑、细胞膜完好的淡红色细胞(10×100oil)。图1B为重度感染人附红细胞体血涂片:可见红细胞被具有明显折光性的棕褐色的小体附着(10×100oil)。
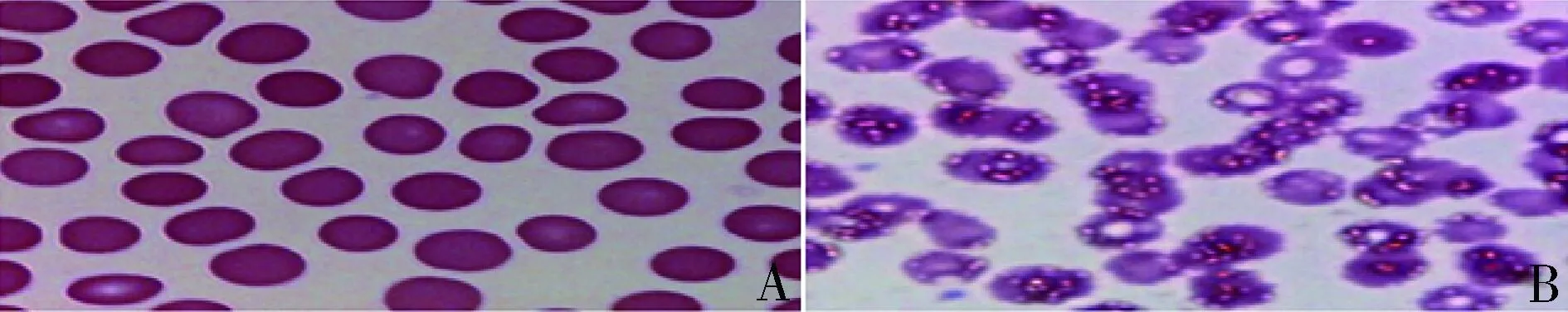
图1 人附红细胞体血液样本瑞氏染色血涂片(10×100oil)A.无感染人附红细胞体血涂片;B.重度感染人附红细胞体血涂片
2.人附红细胞体分离纯化结果:从18例附红细胞体重度感染患者血液样本中分离出了15ml人附红细胞体分离纯化液原液,计数浓度后调整为34ml浓度为1×107个/微升的人附红细胞体分离纯化液(图2)。图2A可见棕褐色圆形小体的人附红细胞体。图2B可见人附红细胞体具有明显的折光性。

图2 光镜下人附红细胞体分离纯化液图片(10×100oil)A.显示人附红细胞体为棕褐色圆形小体;B.显示人附红细胞体具有折光性
3.感染人附红细胞体SD大鼠模型瑞氏染色结果:对照组SD大鼠,鼠尾静脉采血进行瑞氏染色结果(图4),从左到右依次为对照0、3、5、7、9、11天。对照组大鼠每天血涂片,感染率均为0,红细胞均形态完整,呈淡粉色,无改变。
感染人附红细胞体SD大鼠,鼠尾静脉采血进行瑞氏染色结果(图3),从左到右依次为感染0、3、5、7、9、11天。第0天,感染率为0,红细胞呈淡粉色,边缘整齐,未见寄生的人附红细胞体;第3天,感染率为17.26%±1.33%,红细胞边缘有少量浅棕褐色、圆形附红细胞体寄生,部分红细胞边缘突起;第5天,感染率为37.02%±1.48%,红细胞变形,淡染区扩大,其表面寄生的人附红细胞体增多,血浆中也出现人附红细胞体;第7天,感染率为67.37%±2.52%,红细胞膜失去完整性,色淡、变大,血浆中发现活动的附红体明显增多;第9天,感染率为62.78%±2.34%,红细胞表面及血浆中有大量人附红体活动,但未见继续增加;第11天,感染率为61.32%±1.69%,与第7天、第9天比较未见明显变化。
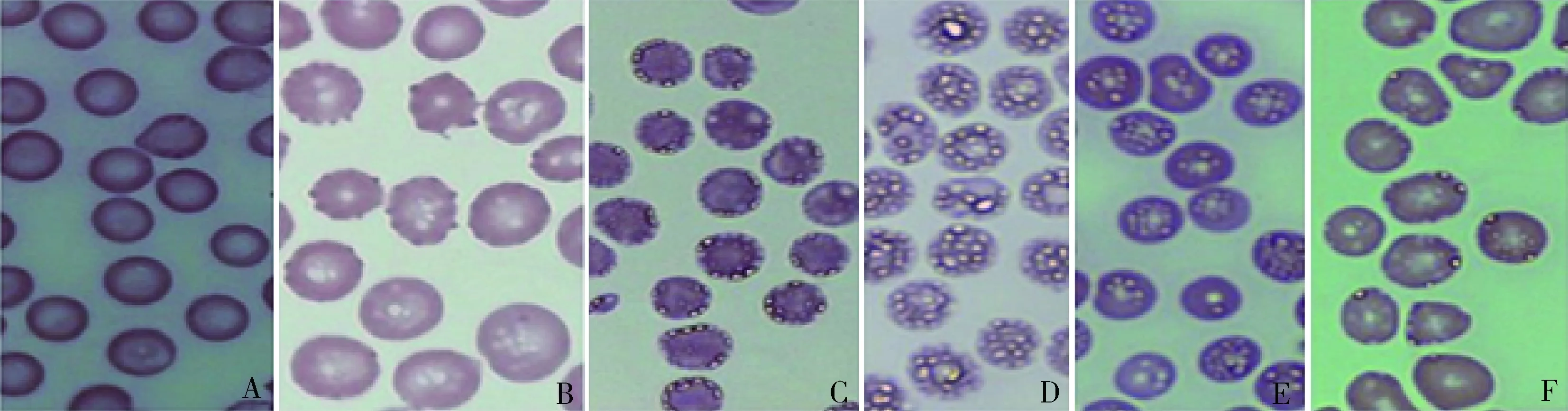
图3 模型组大鼠瑞士染色血涂片(10×100oil)A.感染第0天;B.感染第3天;C.感染第5天;D.感染第7天;E.感染第9天;F.感染第11天
图4 对照组大鼠瑞士染色血涂片(10×100oil)A.感染第0天;B.感染第3天;C.感染第5天;D.感染第7天;E.感染第9天;F.感染第11天
4.感染人附红细胞体SD大鼠模型感染率统计结果:复制感染人附红细胞体SD大鼠模型,第0天,模型组和对照组大鼠均无附红细胞体感染,两组间比较差异无统计学意义(P>0.05);从感染第3天开始,模型组大鼠感染率分别为17.26%±1.33%、37.02%±1.48%、67.37%±2.52%、62.78%±2.34%、61.32%±1.69%, 显著高于对照组(P<0.05); 模型组感染第3天、第5天、第7天感染率随着感染时间的延长,感染率逐渐升高(P<0.05),模型组感染第7天、第9天、第11天感染率比较差异无统计学意义(P>0.05,图5)。
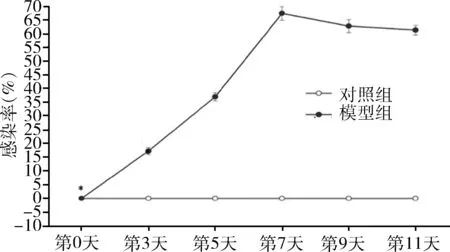
图5 感染人附红细胞体SD大鼠感染率
5.感染人附红细胞体SD大鼠模型临床症状:第0天、第3天、第5天、第7天、第11天受感染大鼠的体温分别为37.87±0.18℃、38.4±0.19℃、38.86±0.18℃、38.68±0.18℃、38.5±0.18℃。实验期间,对照组SD大鼠的精神状态良好,体温正常,摄食饮水情况正常,皮肤、巩膜均无黄染、无明显的脱毛现象。模型组SD大鼠从感染第3天开始出现精神萎靡,体温升高与未感染前比较,差异有统计学意义,摄食饮水欠佳;感染第11天,有4只模型组SD大鼠出现巩膜黄染,明显脱毛的现象。
讨 论
根据已知的人附红细胞体的生物学特性可成功的将人附红细胞体从人红细胞上或血浆中分离出来[6]。再以100微升/只的人附红细胞体分离纯化液,经腹腔注射,连续注射3天后,能成功的构建感染人附红细胞体SD大鼠模型。
1.实验动物的选择:复制感染人附红细胞体的动物模型,首先遇到的问题就是模型动物的选择。顾为望等[7]研究表明,FMMU白化豚鼠有独特的免疫学特性,红细胞免疫功能低,对人附红细胞体敏感。但经过反复的预实验,发现家兔、豚鼠、大鼠、小鼠、裸鼠均存在普遍的附红细胞体自然感染。最终选取SD大鼠作为造模动物,原因如下:首先在反复的预实验中,SD大鼠是附红细胞体自然感染率相对低的实验动物;其次倪婷婷等[8]描述了以猪阳性血液感染切除脾脏的昆明小鼠的方式建立小鼠感染模型,相比较大鼠具有体型大小合适、操作方便、血量相对充裕的优点,可以克服因小鼠血量少,而不能满足实验过程中反复测量实验指标的弊端;最后,模型动物选用SD大鼠,本身也具有经济适用的优势。
2.感染途径的选择:复制感染人附红细胞体的动物模型,感染途径的选择可有腹腔注射、皮下接种、接触感染等[9]。经过反复的预实验,最终选取腹腔注射附红细胞体分离纯化液的方法,主要考虑腹腔注射的感染途径,不但操作简便易行,而且还拥有实验更客观,容易干预,实验周期短的特点。
3.注射剂量及浓度的选择:对于分离纯化液的注射量以及浓度的制定,经预实验摸索及正式实验验证,采用100微升/只,连续3天给药,即可成功感染SD大鼠。但这仅是一个相对好操作的剂量,还在很多需要研究探讨的地方,例如:能够成功感染SD大鼠的最小剂量或最佳剂量;能够出现人附红细胞体病临床表现的最佳剂量等虽然以附红细胞体分离纯化液作为感染源,相对于利用全血作为感染源而言更纯净,但同样也存在收集大量附红细胞体患者的血样耗时长的缺陷。若能完善人附红细胞体的体外培养体系,就能更快捷的获取人附红细胞体,必将有利于该病模型的获取及发病机制的深入研究。
4.感染人附红细胞体SD大鼠模型的感染率:复制感染人附红细胞体的动物模型,模型组于感染第3天血涂片出现人附红细胞体;感染第7天,感染率达到最高并伴发体温升高、脱毛等临床症状。感染第11天,虽然感染率没有继续上升,但有4只模型组SD大鼠出现巩膜黄染,明显脱毛的现象,占模型组总数的26.67%,说明已经成功复制了感染人附红细胞体的SD大鼠模型,并且在此模型的基础上可进一步研究探讨关于人附红细胞体病对机体代谢方面的影响机制。
5.需要进一步研究的问题:(1)造模成功的SD大鼠的感染率与临床症状(如饮食差、脱毛等)是否存在相关性,还需进一步验证。其次对4只模型组出现巩膜黄染的SD大鼠,进一步检测时,发现其血糖显著降低,直接胆红素和总胆红素升高,是个体差异还是有统计学意义,还需进一步的实验证实。(2)造模成功的SD大鼠,感染第7天、第9天、第11天感染率虽然维持在60%以上,但不再继续上升的原因以及是否需要延长实验时间,需要开展进一步的实验验证。
