高体质指数对胃癌切除术患者预后影响的Meta分析
2019-08-07谢桂生韦皓棠陈丰倪敏高顺惠陈锋
谢桂生 韦皓棠 陈丰 倪敏 高顺惠 陈锋
作者单位:530031 南宁 广西医科大学第三附属医院胃肠外科
胃癌是最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因[1]。开腹或腔镜下胃癌根治术是胃癌的主要治疗方式。有研究报道超重和肥胖与胃癌患者术后并发症更高的发生风险有关[2],但也有研究认为术后并发症发生风险与高体质指数(bady mass index,BMI)无相关性[3]。另有研究指出,腹膜腔内过多的脂肪组织可能影响手术视野和解剖平面,并进一步增加术中出血的风险,且使淋巴结切除术和吻合术的手术难度增加[4]。可见目前对于高BMI与胃癌切除术患者预后的关系各研究结果并不一致。本研究采用Meta分析评价高BMI对胃癌切除术患者术后并发症及长期生存的影响。
1 资料与方法
1.1 纳入标准
1.1.1 研究类型 研究类型包括队列研究、病例对照研究和随机对照试验。语种为中文及英文。纳入的文献均评估了BMI对胃癌切除术患者术后并发症和预后的影响。
1.1.2 研究对象 ⑴所有患者均接受开腹或腹腔镜胃癌切除术且经病理证实为原发性胃癌。⑵胃癌患者按照BMI分为高BMI组和低BMI组,种族、国籍、病程不限。BMI≥30 kg/m2或 BMI≥25 kg/m2为高 BMI组,BMI<25 kg/m2或 BMI<18.5 kg/m2为低 BMI组。
1.1.3 结局指标 胃癌患者的围手术期死亡率;5年总生存率;术后并发症,包括吻合口瘘、胰腺炎、术口感染、肺部感染、肠梗阻、腹腔感染等。
1.2 排除标准
⑴会议摘要;⑵未以BMI≥30 kg/m2或BMI≥25 kg/m2为超重或肥胖截断值;⑶并发症数据不完整;⑷同一研究机构或作者的重复研究。
1.3 文献检索
计 算机 检 索 PubMed、EMbase、Scopus、Cochrane Library、万方和中国知网等数据库,检索时间为各数据库建库至2018年12月31日。采用主题词和自由词相结合的方法检索。英文检索词包括gastrectomy、gastric cancer、overweight、obesity、body mass index、BMI等;中文检索词包括胃癌、超重、肥胖、体质指数等。同时手动筛选相关文献,确定潜在的纳入文献。
1.4 文献筛选及资料提取
由2位研究者根据纳入和排除标准独立筛选文献、提取资料并交叉核对,如遇分歧,则讨论解决或交由第3名研究者协助判断,缺乏的资料尽量与作者联系补充。文献筛选时首先阅读文题,在排除明显不相关的文献后,进一步阅读摘要和全文,以确定最终是否纳入。资料提取的内容主要包括:第一作者、出版年份、国家或地区、样本量、年龄、性别、中位随访时间、TNM分期、BMI截断值、手术方式、手术时间、清扫淋巴结数量、术中失血量、输血量、术后并发症、术后30 d内死亡率和生存数据(OS或肿瘤特异性生存率)。
1.5 文献质量评价
由2位研究者独立采用纽卡斯尔-渥太华量表(the Newcastlee Ottawa Scale,NOS)对纳入文献进行质量评价[5],交叉核对,如遇分歧,则征求第3位研究人员的意见,协商解决。若NOS评分≥6分,则提示纳入文献质量良好。
1.6 统计学方法
采用Review Manager 5.3软件进行Meta分析。以风险比(risk ratio,RR)为效应指标,同时计算其对应的95%可信区间(CI)。采用Q检验分析各研究的异质性,若I2<75%,P>0.05,则认为研究结果异质性较小可以接受,采用固定效应模型进行Meta分析;若I2>75%,P<0.05,则认为研究结果存在异质性,采用随机效应模型进行Meta分析。以P<0.05为差异有统计学意义。根据手术类型(开腹或腔镜手术)、BMI截断值进行亚组分析,同时根据患者术后并发症发生率和围手术期死亡率进行发表偏倚分析。
2 结果
2.1 文献检索结果
根据检索策略共检索出文献1 065篇,通过其他资源补充相关文献27篇,删除重复文献158篇,经阅读文章题目和摘要排除862篇,阅读文献全文复筛排除 37 篇,最终共纳入 35 篇文献[2-4,6-37]。
2.2 纳入研究的基本特征和质量评价
纳入的35篇文献均为队列研究,包括32 113例胃癌患者,其中女性11 356例,男性20 757例。根据NOS质量评价方法对纳入文献进行评分,结果所有纳入文献的NOS评分均在7~8分之间,提示纳入文献质量良好,无高风险文献纳入分析。纳入文献的基本特征及NOS评分见表1。
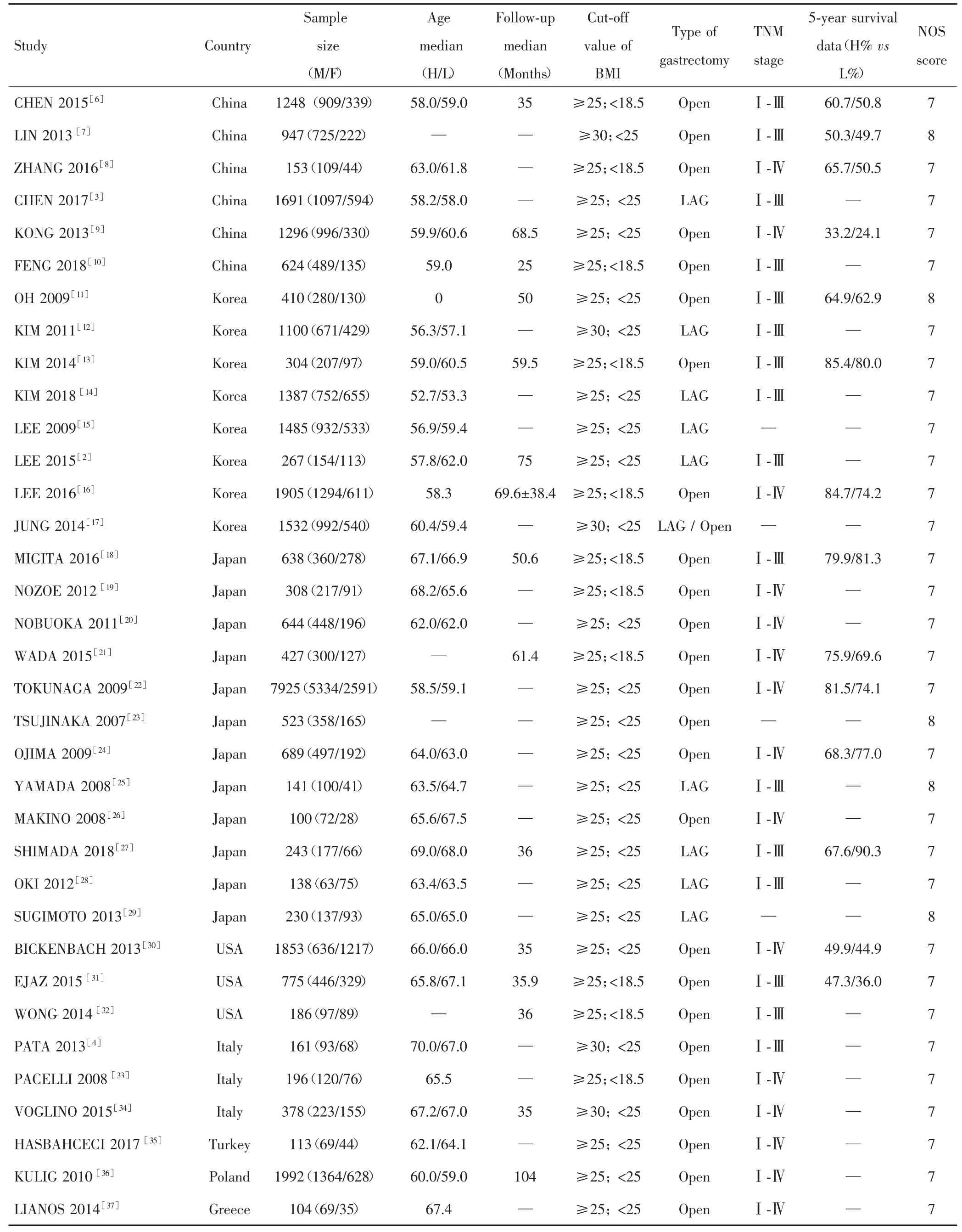
表1 纳入文献的基本特征及NOS评分Tab.1 Basic characteristics of the included study and NOS score
2.3 Meta分析结果
2.3.1 BMI与胃癌患者术后并发症发生率的关系 共30 项研究[2-3,6-15,17-21,23,25-31,33-37]报道了 BMI与胃癌患者术后并发症发生率的关系。各研究存在异质性(I2=61%,P<0.001),采用随机效应模型进行分析,结果显示,高BMI组胃癌患者术后并发症的发生率高于低BMI组(RR=1.28,95%CI:1.15~1.41,P<0.001),漏斗图提示发表偏倚不明显,见图1、图2。对开腹与腹腔镜手术进行亚组分析,其中开腹手术各研究存在异质性(I2=70%,P<0.001),采用随机效应模型分析;腹腔镜手术各研究间异质性较小(I2=25%,P=0.22),采用固定效应模型分析,结果显示,开腹和腹腔镜手术中高BMI组患者的术后并发症发生率均高于低BMI组(RR=1.29,95%CI:1.14~1.46,P<0.001;RR=1.24,95%CI:1.04~1.47,P=0.01)。根据 BMI不同定义进行亚组分析,共19 项研究[2-3,9,11,14-15,20,22-30,35-37]以 BMI≥25 kg/m2定义为高 BMI组,BMI<25 kg/m2定义为低 BMI组,异质性检验结果显示各研究的异质性较小(I2=28%,P<0.1),采用固定效应模型进行分析,结果显示高BMI组患者术后并发症的发生率高于低BMI组患者(RR=1.20,95%CI:1.13~1.29,P<0.001)。

图1 BMI对开腹或腹腔镜胃癌切除术患者术后并发症的影响Fig.1 Effect of BMI on postoperative complications in patients with gastric cancer undergoing open or laparoscopic gastrectomy

图2 基于术后并发症的发表偏倚Fig.2 Publication bias based on postoperative complications
2.3.2 BMI与胃癌患者围手术期死亡率的关系 13项研究[4,6-7,11,15,17,20,23-24,27,31,34,36]报道了 BMI与患者围手术期死亡率的关系。各研究异质性可接受(I2=0%,P=0.76),采用固定效应模型进行分析,结果显示高BMI组患者围手术期死亡率与低BMI组患差异无统计学意义(RR=0.79,95%CI:0.51~1.22,P=0.29),漏斗图提示存在一定发表偏倚,见图3、图4。开腹与腹腔镜手术的亚组中,各研究的异质性均可接受(I2=0,P=0.81;I2=0,P=0.79),采用固定效应模型进行分析,结果显示,开腹手术和腹腔镜手术中,两组患者围手术期死亡率差异均无统计学意义(RR=0.67,95%CI:0.41~1.09,P=0.11;RR=1.81,95%CI:0.64~5.13,P=0.27)。
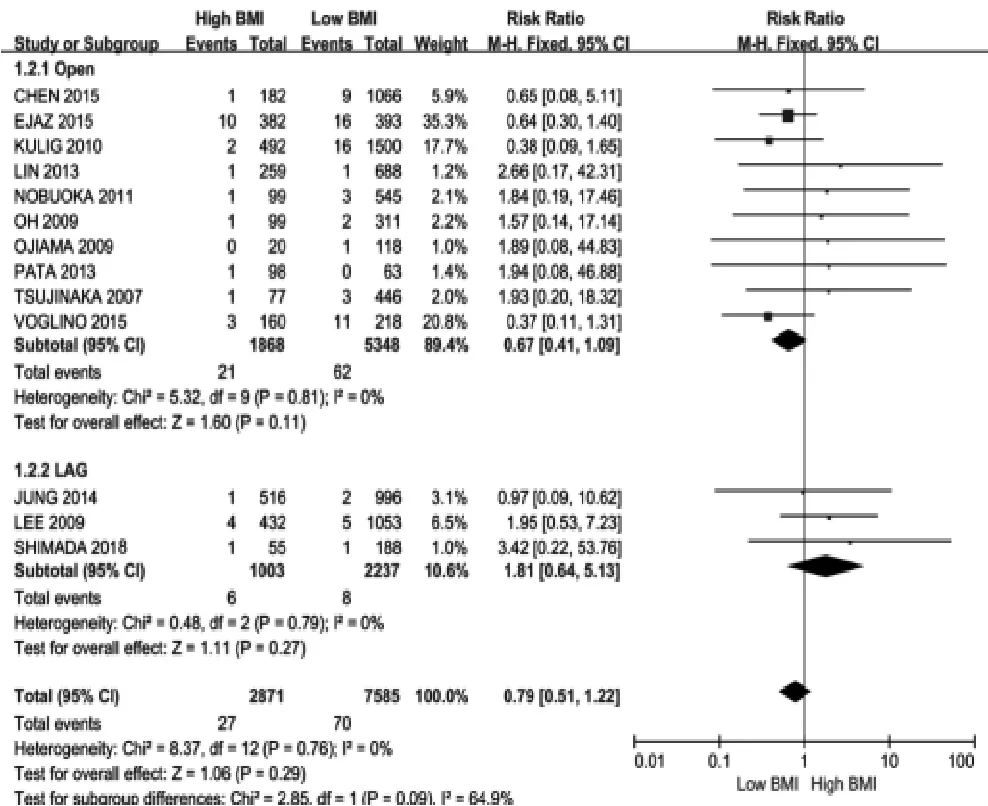
图3 BMI对开腹或腹腔镜胃癌切除术患者围手术期死亡率的影响Fig.3 Effect of BMI on perioperative mortality in patients with gastric cancer undergoing open or laparoscopic gastrectomy

图4 基于围手术期死亡率的发表偏倚Fig.4 Publication bias based on perioperative mortality
2.3.3 BMI与胃癌患者总生存率的关系 共有9项研究[6,9,11,16,18,22,31-32,37]报道了 BMI与患者 5 年总生存率的关系,各研究存在异质性(I2=68%,P=0.001),采用随机效应模型进行分析,结果显示高BMI组患者较低BMI组患者的生存率更低(RR=0.87,95%CI:0.79~0.96,P=0.006),见图 5。
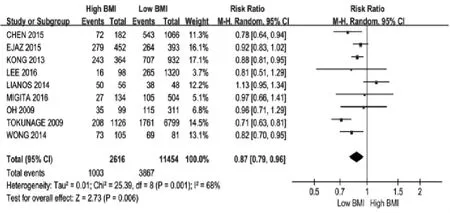
图5 BMI对开腹或腹腔镜的胃癌切除术患者5年总生存率的影响Fig.5 Effect of BMI index on 5-year survival rate of patients with gastric cancer undergoing open or laparoscopic gastrectomy
3 讨论
目前,多项研究已报道BMI对胃癌患者术后并发症和预后的影响,但结果相互矛盾[2-3]。本研究主要从高BMI与胃癌患者术后并发症、围手术期死亡率和总生存率的相关性进行Meta分析。根据NOS评价标准,纳入的35篇文献评分均在7~8分之间,提示纳入文献质量良好,无高风险文献纳入分析。
KAMBARA等[38]分析了460例接受开腹R0手术的胃癌患者与BMI的关系,发现BMI与术后复发率呈U型关系,即低BMI和高BMI均增加术后复发率;同时高BMI可增加手术时间、术中出血量、术后感染风险和切口脓肿发生率,且减少术中淋巴结切除数量,基于肿瘤分期亚组分析亦支持该结果。我国学者WANG等[39]分析了827例接受开腹或腔镜胃癌手术的患者,发现BMI与肿瘤大小、TNM分期、肿瘤浸润深度、肿瘤分化程度、手术切缘阳性率、淋巴结转移、术后并发症以及总生存率等无关;然而,BMI与胃癌发生的位置有关:高BMI患者的贲门部胃癌发生率显著高于胃体和幽门部。本研究结果显示,无论是开腹还是腹腔镜胃切除术,高BMI组患者的术后并发症发生风险均高于低BMI组。考虑高BMI患者术后并发症发生率较高可能有以下原因:⑴术中失血量较大及手术时间延长,可能增加腹腔感染的风险;⑵超重和肥胖与较多的合并症相关,包括糖尿病、胰岛素抵抗和免疫抑制等;⑶切口部位过多的皮下脂肪组织、高腹内压和高表面张力可能导致伤口感染概率增加;⑷有限的手术区域和不充分的暴露可能增加组织的潜在医源性损伤和重建难度,从而导致吻合口瘘和胰瘘的发生风险增加[5]。但本研究纳入多数的文献未详尽描述并发症的类型,因此未对并发症的型进行亚组分析,两者的关系有待研究。
有研究表明术后并发症与胃癌患者肿瘤复发及长期生存相关,尤其是存在严重术后并发症的患者[40-41]。PALMELA等[42]研究指出,术后并发症高及高BMI的患者术后长期生存率均较低。本研究9项研究结果亦表明高BMI的胃癌患者5年生存率较低BMI组患者差,提示高BMI与胃癌患者术后的不良预后相关。但关于高BMI与患者围手术期死亡率的关系,目前各研究结果并不一致。CHEN等[43]纳入9项接受腹腔镜切除术的亚太胃癌患者研究的Meta分析发现,虽然高BMI增加了手术时间、术中出血量和淋巴结切除数量,但并未显著增加围手术期死亡率。而MULLEN等[44]的研究则提出“肥胖悖论”,其分析了118 707例普外科手术中BMI与患者围手术期并发症和死亡率的关系,发现BMI与围手术期死亡率呈J型分布,超重和中度肥胖患者的围手术期死亡率比正常体重患者低。本研究结果与CHEN等[43]的结果一致,亦发现高BMI与胃癌患者的围手术期死亡率无关。可见虽然高BMI增加了围手术期并发症的发生,但可能由于围手术期护理技术和手术技巧的不断提高,这些并发症不足以导致患者死亡。
本研究存在以下局限性:⑴术后并发症的定义和严重程度评估可能不同,即并非所有纳入的研究都使用Clavien-Dindo方法评估术后并发症。⑵大多数纳入的研究为回顾性,结果可能受潜在混杂因素的影响。⑶尽管BMI被认为是评估超重和肥胖的标准,但是患者脂肪组织分布存在差异,亦可能影响分析结果。⑷西方人群的BMI指数和体脂比例均与东方人群不同,可能对结果判断产生一定的偏倚。
综上所述,本研究结果显示,相对于低BMI患者,高BMI胃癌患者无论是接受开腹还是腹腔镜胃切除术,术后并发症发生率均较高,5年生存率较低,但不增加围手术期死亡率。对于高BMI的胃癌切除术患者,未来仍需要进一步分析其复发率和术后并发症类型,从而采取相应措施改善高BMI胃癌切除术患者的预后,提高生存质量。
[2019-03-11收稿][2019-05-07修回]
[编辑汤春丽/罗惠予]
