TBX15基因启动子甲基化在肝细胞癌中的表达及其功能研究
2019-08-07庞婷刘顺仇小强李沭秦小玲李柯桦刘美良伍柳玉曾小云
庞婷 刘顺 仇小强 李沭 秦小玲 李柯桦 刘美良 伍柳玉 曾小云
作者单位:530021 南宁 广西医科大学公共卫生学院流行病与卫生统计学教研室
人类 TBX15(T-box transcription factor 15,TBX15)是T-box基因家族的成员之一,其编码的生物蛋白是一种对疾病发展至关重要的转录因子[1]。大量研究表明,转录因子TBX15的甲基化水平可能影响人类肿瘤的发生发展,如卵巢癌[2]、乳腺癌[3]、甲状腺癌[4]、前列腺癌[5]和肾细胞癌[6]等,然而TBX15基因与肝细胞癌(简称“肝癌”)发生发展关系的研究尚未见报道。全基因组DNA甲基化分析表明,TBX15在肝癌中高度甲基化且表达下调[7]。本课题组利用TCGA数据库的肝癌数据对TBX15基因进行生物信息学整合分析也发现,TBX15基因在肝癌中启动子的甲基化程度与mRNA表达呈负相关,且与肝癌患者预后相关,据此推测TBX15基因可能在肝癌的发生发展中发挥重要作用。本研究通过分析不同肝癌细胞系中TBX15基因启动子甲基化对mRNA表达的调控及对肿瘤细胞生物学行为的影响,以进一步了解该基因在肝癌发生发展中的调控机制,为肝癌的精准治疗提供新的靶点。
1 材料与方法
1.1 主要材料与仪器
人肝癌细胞株HepG2、MHCC97H和SNU449购自广州赛库生物技术有限公司;TBX15及GAPDH引物由广州英赞生物科技有限公司合成;Lipofectamine 2000 Transfection Reagent购自上海博耀生物科技有限公司;SYBR Premix Ex TaqⅡ试剂盒购自日本TaKaRa公司;0.25%胰蛋白酶及CCK-8试剂盒购自北京智杰方远科技有限公司;实时荧光定量PCR(ABI StepOne Plus)仪购自美国ABI公司;凝胶成像系统(JS-1075)购自上海培清科技有限公司;倒置荧光显微镜(CKX41)购自日本Olympus公司。
1.2 构建TBX15过表达载体
根据UCSC基因组生物信息库查找TBX15基因的序列,对TBX15基因序列及pcDNA3.1(+)载体序列进行分析,以人脂肪干细胞mRNA反转录的cDNA为模板,PCR扩增基因序列,将目的基因片段构建到pcDNA3.1(+)载体中,再用KpnI和XbaI对上述PCR产物和载体进行双酶切,反应条件:37℃水浴,30 min;80℃灭活,10 min。酶切后按照Axygen纯化试剂盒说明书进行产物纯化,将酶切产物与T载体进行连接和转化,取菌液均匀涂在平板上,于37℃培养12 h。选取上述平板上的单菌落,送测序公司测序,进行下一步鉴定。
1.3 细胞培养和转染
人肝癌细胞株HepG2、MHCC97H和SNU449培养于含1%双抗的DMEM培养液和10%胎牛血清中,培养条件:5%CO2、37℃,饱和湿度,每2~3 d换液传代1次。按照Lipofectamine 2000 Transfection Reagent转染试剂盒说明书将空白质粒、空载质粒pc3.1及TBX15过表达质粒转染至肝癌SNU449细胞。分别将5 μg DNA 和 15 μL Lipofectamine 2000 转染试剂与500 μL Opti-MEM培养基混匀。再把上述2管溶液混合为转染复合物,室温静置孵育10 min。将孵育后的转染复合物均匀加入培养瓶中,培养6 h后换成完全培养基。继续培养2~4 d后提取RNA,采用qPCR检测转染后3组质粒细胞的mRNA表达水平,收集细胞进行后续功能实验。
1.4 亚硫酸氫盐测序法检测肝癌细胞中TBX15的甲基化状态
提取 HepG2、MHCC97H和 SNU449肝癌细胞DNA,按照 EpiTect Fast DNA Bisulfite Kit(QIAGEN)试剂盒说明书对DNA进行亚硫酸氢盐修饰。利用Methprimer在线预测CpG岛软件设计引物,外侧(-489~23 bp,516 bp) 上游引物序列:TGTTGTAAGGTGGGAGAGTTGATTT,下游引物序列:AAAACCATAACTTTCCCAACCAAC;内侧(-364~-92 bp,277 bp)上游引物序列:TATGATTGGTTTGTTTGGTTTTTTAG,下游引物序列:CTAACCATTCTTAATTCCCACACCT。配制反应体系进行PCR扩增,反应条件:95℃5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,30 个循环,72 ℃ 5 min。按照Axygen凝胶纯化试剂盒说明书进行PCR产物纯化,回收片段。将目的片段DNA与线性化载体连接和转化,取菌液均匀涂在平板上,于37℃过夜培养。选取上述平板上的单菌落,送测序公司测序进行下一步鉴定。
1.5 qPCR检测不同肝癌细胞中TBX15 mRNA的表达
按照Qiagen试剂盒中的步骤提取HepG2、MHCC97H和SNU449肝癌细胞的总RNA,用Nanodrop2000超微量分光光度计测定RNA的浓度和纯度,核酸电泳仪测定RNA的完整性。逆转录cDNA,TBX15上游引物序列:GGTGTGGGCGGCTAAAATGA,下游引物序列:GCTCTGCTCAGAATCCGGG。内参GAPDH上游引物序列:GAAGGTGAAGGTCGGAGT,下游引物序列:GAAGATGGTGATGGGATTTC。按照SYBR Premix Ex TaqⅡ试剂盒说明书,每组为20 μL的Real-time PCR体系,每孔设3个复孔。反应条件:95℃30s,95℃5 s,60℃30 s,40个循环。取PCR产物于1%琼脂糖凝胶中电泳,电压120 V,15 min。实时荧光定量结果采用相对定量分析法,采用2-△△Ct方法计算TBX15基因的mRNA 表达量[8]。
1.6 Western blot检测肝癌细胞中TBX15蛋白的表达
取转染后的空白质粒组、空载质粒pc3.1组以及TBX15过表达质粒组肝癌SNU449细胞,加入200 μL裂解液在冰上裂解30 min,4℃、13 000 r/min离心30 min,然后移取上清至洁净离心管中。将高浓度待测蛋白以一定倍数稀释后与4×Loading Buffer以3∶1的体积比混合,沸水浴5 min,取出样品管置于冰上,待其恢复至室温后离心震荡,按照上样顺序点样,电泳30 min。以湿转法将蛋白转移至PVDF膜,将膜浸入5%BSA的封闭液中,室温封闭1 h。取出已封闭的PVDF膜,浸于1×TBS-T缓冲液中,于摇床上缓慢洗涤15 min。然后移入第一抗体中,4℃下孵育过夜。加入有对应HRP标记的第二抗体中,室温摇床孵育1 h。采用ECL化学发光显色,移至凝胶成像分析仪中,曝光显影。用Image J软件对目的条带进行灰度值计算,以内参为基数,计算公式:相对灰度值=TBX15基因灰度值/GAPDH基因灰度值。
1.7 CCK-8法检测肝癌SNU449细胞的增殖情况
采用CCK-8法检测转染空白质粒、空载质粒pc3.1和TBX15过表达质粒后肝癌SNU449细胞的增殖情况,实验重复3次。取上述3组处于对数生长期的细胞,分别加入0.25%胰蛋白酶0.5 mL,消化至细胞变圆脱落,加入全培养液5 mL终止消化,吹打成细胞悬液并转移至15 mL离心管中,1 000 r/min离心5 min,弃上清液,加入检测培养液3 mL重悬细胞并计数,将细胞密度调整至 1×105个/mL,以 100 μL/孔加入96孔板中,每组细胞设置2个复孔。细胞孵育24 h、48 h、72 h后分别加入CCK-8显色液,于37℃、5%CO2培养箱中孵育60 min。取出96孔板于酶标仪读取各孔OD450吸光值。计算细胞增殖抑制率,计算公式:细胞增殖抑制率=[1-(过表达质粒组吸光值/空白质粒组或空载质粒组吸光值)]×100%。
1.8 流式细胞术检测肝癌SNU449细胞的凋亡情况
采用流式细胞术检测转染空白质粒、空载质粒pc3.1和TBX15过表达质粒后肝癌SNU449细胞的凋亡情况,实验重复3次。将上述3组细胞悬液计数后,取约1.5×105个细胞置于离心管中,1200r/min离心5 min,弃上清液。然后分别加入 150 μL 1×Binding Buffer,重悬(理想浓度为106个细胞/L)后分成实验样品管和阴性对照管,实验样品管加入5μLAnnexinV-PE和5μL7-AAD染料,阴性对照管不加任何染料。室温下避光孵育15 min,分别加入 200μL1×AnnexinVBindingBuffer,1h内上机。
1.9 统计学方法
本研究实验数据经Excel整理后采用SPSS 17.0软件进行分析。计量资料采用均数±标准差(x±s)表示,组间差异比较采用单因素方差分析(one-way ANOVA),若整体差异有统计学意义,进一步两两比较采用LSD法。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 TBX15基因在3种肝癌细胞中的甲基化状态
采用TBX15启动子引物对亚硫酸氫盐修饰的DNA进行PCR扩增,根据BSP结果计算启动子甲基化率。结果显示,肝癌HepG2、MHCC97H、SNU449细胞均发生了异常甲基化,其启动子甲基化率分别为57.4%、78.9%和89.5%,其中TBX15启动子在肝癌SNU449细胞中甲基化程度最高。
2.2 3种肝癌细胞中TBX15 mRNA的表达水平
采用qPCR检测3种肝癌细胞中TBX15 mRNA的表达水平,扩增曲线、溶解曲线良好。以肝癌MHCC97H细胞检测的2-△△Ct值为1,计算其余细胞的平均 2-△△Ct值。结果显示,TBX15 mRNA在肝癌SNU449细胞中几乎不表达,在肝癌HepG2细胞中高表达,组间差异有统计学意义(P<0.01),见图1。
2.3 构建TBX15过表达载体
分别将空白质粒、空载质粒和TBX15过表达质粒转染至甲基化程度最高和TBX15 mRNA表达水平最低的肝癌SNU449细胞,以空白质粒组的2-△△Ct值为1,计算其余各组的平均2-△△Ct值。qPCR结果显示,TBX15过表达质粒组TBX15 mRNA的相对表达量为1 385.28±18.19,空载质粒组和空白质粒组分别为 1.14±0.30 和 1.00±0.16,TBX15 过表达质粒组TBX15 mRNA的相对表达量较其余两组显著升高,差异有统计学意义(P<0.01),空载质粒组和空白质粒组差异无统计学意义(P=0.450),见图 2。采用Western blot检测3组细胞中TBX15蛋白的表达水平,结果显示,与空白质粒组和空载质粒组细胞相比,TBX15过表达质粒组细胞中TBX15蛋白表达明显上调,见图3。以上结果说明TBX15过表达载体构建成功。

图1 3种肝癌细胞系中TBX15 mRNA的表达水平Fig.1The mRNA expression levels of TBX15 in three HCC cell lines

图2qPCR检测3组细胞中TBX15 mRNA的表达Fig.2 qPCR detecting the TBX15 mRNA expression in three groups

图3 Western blot检测3组细胞中TBX15蛋白的表达Fig.3 Western blot detecting the TBX15 protein expression in three groups
2.4 过表达TBX15对肝癌SNU449细胞增殖能力的影响
CCK-8检测结果显示,培养24 h后,空白质粒组、空载质粒组和TBX15过表达质粒组肝癌SNU449细胞的OD值差异无统计学意义(F=1.525,P=0.291);培养48 h后,3组OD值差异有统计学意义(F=9.353,P=0.014),两两比较发现,TBX15过表达质粒组肝癌SNU449细胞的增殖能力较空载质粒组强(P=0.015);培养72 h后,3组细胞的OD值差异无统计学意义(F=0.326,P=0.734),见表 1。
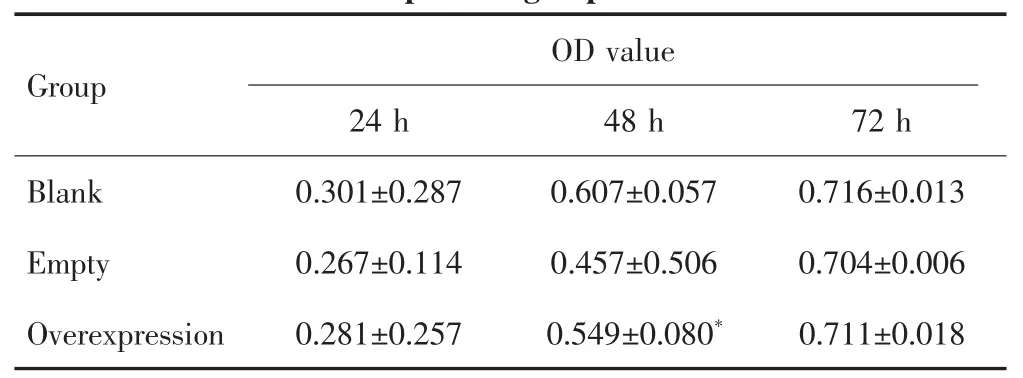
表1 CCK-8检测不同质粒转染组肝癌SNU449细胞的OD值Tab.1 CCK-8 detecting the OD values of SNU449 cells in different plasmid groups
2.5 过表达TBX15对肝癌细胞凋亡的影响
流式细胞术检测结果显示(图4),空白质粒组、空载质粒组和过表达质粒组肝癌SNU449细胞的早期凋亡比例差异有统计学意义(F=13.609,P=0.006),且两两比较发现,过表达质粒组肝癌SNU449细胞的凋亡能力高于空白质粒组(P=0.002);3组细胞晚期凋亡比例差异无统计学意义(F=1.144,P=0.379);3组细胞总凋亡比例差异有统计学意义(F=6.059,P=0.036),两两比较发现,过表达质粒组肝癌SNU449细胞的凋亡能力高于空白质粒组(P=0.014),见表2。

图4 流式细胞术检测不同质粒转染组肝癌SNU449细胞的凋亡情况Fig.4 Flow cytometry detecting the apoptosis of SNU449 cells in different plasmid groups
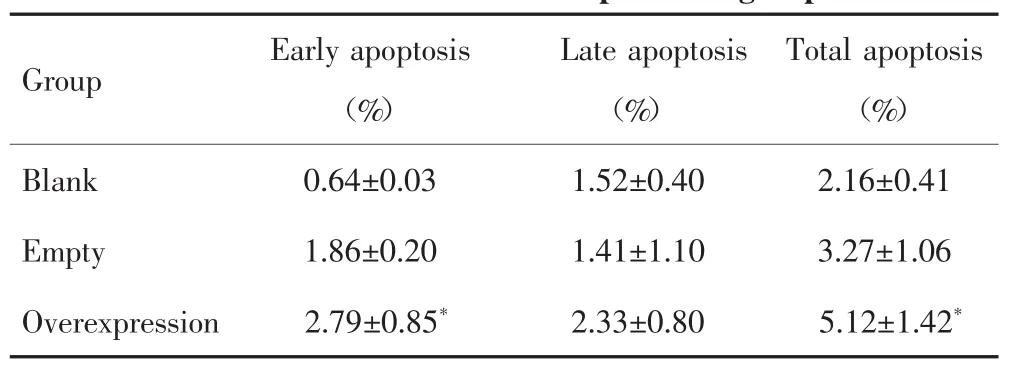
表2 流式细胞术检测不同质粒转染组肝癌SNU449细胞的凋亡比例Tab.2 Flow cytometry detecting the apoptosisproportion of SNU449 cellsin differentplasmid groups
3 讨论
肿瘤抑制基因的表观遗传沉默是导致人类癌症发生、进展的主要事件,这些基因启动子区域中的CpG岛超甲基化是肿瘤抑制因子表达失活的重要机制[9]。越来越多的研究证明,DNA在肿瘤患者中甲基化异常与肿瘤分化差、侵袭高和不良预后等有关[10-11],因此DNA甲基化可能成为不同类型肿瘤的潜在诊断和预后标志物。本研究结果显示,TBX15基因在肝癌MHCC97H和SNU449细胞中呈高度甲基化状态,在肝癌HepG2细胞中呈中度甲基化状态。采用qPCR检测3株细胞TBX15 mRNA的表达水平,发现TBX15 mRNA在肝癌MHCC97H和SNU449细胞中表达失活,证实了启动子高甲基化与肝癌中TBX15表达缺失有关,提示DNA甲基化可能是导致肝癌TBX15基因沉默的主要机制。
研究表明,在某些特定肿瘤中,由于启动子中CpG岛的超甲基化,许多肿瘤抑制基因功能缺失,可能抑制肿瘤的发生发展[12]。研究发现,越来越多的基因甲基化参与肝细胞的癌变和转移[13-14]。LI等[3]研究发现TBX15可通过抑制肿瘤细胞增殖和转移而阻碍乳腺癌的发生发展。本研究体外功能实验结果显示,转染过表达TBX15质粒48 h后,发现可促进肝癌SNU449细胞增殖,与上述研究结果不一致,原因可能是观察24 h后部分细胞还未转染成功,而这部分细胞还可以继续分裂增长,在转染48 h后3组细胞增长的速度开始出现明显差异,72 h后趋于平稳。ARRIBAS等[4]研究发现TBX15过表达可以改变促凋亡/抗凋亡蛋白质的比例,下调线粒体凋亡,促使细胞色素c降低,裂解减少,从而抑制肿瘤细胞凋亡。然而本研究发现过表达TBX15促进了肝癌细胞的凋亡,具体机制尚未知。以上结果提示TBX15基因在肝癌恶变和转移中可能发挥促癌与抑癌的双重功能。
既往研究认为细胞分化和增殖紊乱是恶性肿瘤发生机制的全部内容[15],近年发现肿瘤细胞丧失自发凋亡能力也是其发病的重要机制之一,肿瘤细胞在快速增殖的同时可能也伴随着细胞凋亡。本研究发现过表达TBX15诱导肝癌SNU449细胞凋亡能力可能比细胞增殖能力强,在一定程度上抑制肿瘤细胞的进展,提示TBX15基因可能是治疗肝癌的潜在靶点。
综上所述,TBX15基因启动子甲基化可能与肝细胞癌恶性生物学行为相关,为研究肝癌的发生进展机制提供新的方向。本研究仅在肝癌SNU449细胞中进行功能研究,未能充分排除肿瘤异质性的影响,而TBX15基因在其他肝癌细胞株是否发挥相同作用尚未知。此外,本研究仅在细胞水平进行功能探讨,仍需在多种肝癌细胞株和动物实验中验证。
