外周血血小板与淋巴细胞比值在滤泡淋巴瘤预后中的价值
2019-08-07权小英叶斌吴春芝雷蕾陈小艳张智慧
权小英 叶斌 吴春芝 雷蕾 陈小艳 张智慧
作者单位:610051 成都 1成都市第六人民医院肿瘤科;610041 成都 2四川省肿瘤医院淋巴瘤科
滤泡淋巴瘤(follicular lymphoma,FL)是一种非霍奇金淋巴瘤,主要来源于滤泡生发中心细胞的惰性B细胞[1]。该病恶性程度低,生长缓慢,具有高度异质性,欧美国家常见而亚洲国家发病率较低[2-3]。部分患者可发生病理类型改变,转化为弥漫大B淋巴瘤,预后差[4]。目前认为预后模型FLIPI[5]在FL的预后判断中显示了良好的应用前景,但该模型基于西方人群,而FL存在种族、地域差异性,而且其评分主要基于临床体征,并不能全面反映FL的生物学特点。所以,该预后模型是否适应现阶段我国患者仍需深入分析。Meta分析显示血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)是多种实体肿瘤的独立预后因素[6],近年研究[7-9]亦发现 PLR 与结外 NK/T 细胞淋巴瘤、边缘区淋巴瘤、弥漫大B细胞淋巴瘤预后相关。但是,目前PLR与FL预后的关系未见相关报道。本研究探讨PLR与FL预后的相关性,为FL的临床治疗和预后判断提供新的思路。
1 资料与方法
1.1 一般资料
回顾性分析2006年2月至2016年12月在四川省肿瘤医院初诊的74例FL患者的临床资料。纳入标准:⑴经病理活检和免疫组化确诊为FL;⑵初治患者,排除晚期、复发患者;⑶无急慢性感染者;⑷不合并其他肿瘤;⑸临床资料完整。排除标准:⑴前期接受相关的抗肿瘤治疗;⑵不规范放化疗治疗或中途放弃治疗者;⑶合并心肺或肝肾功能等重要脏器不全者;⑷依从性差。所有患者均完善血常规、血生化、骨髓及流式细胞学检查,颈胸腹CT等检查。收集患者性别、年龄、ECOG 评分、Ann Arbor分期、血红蛋白(HB)、乳酸脱氢酶(LDH)、FLIPI评分、淋巴细胞计数、血小板计数、病理诊断、骨髓穿刺、心电图、浅表淋巴结彩超、颈胸腹CT等临床资料。同时采集患者治疗前外周血,血小板及淋巴细胞计数通过全自动血细胞分析仪(型号Mindray BC-5800)分析。本研究患者或其家属知情同意。
1.2 治疗方案
采用CHOP方案(环磷酰胺+长春新碱+表阿霉素+泼尼松)33例,CHOP方案(环磷酰胺+长春新碱+表阿霉素+泼尼松)联合放疗21例,RCHOP方案(利妥昔单抗+环磷酰胺+长春新碱+表阿霉素+泼尼松)16例,接受FC治疗方案(氟达拉滨+环磷酰胺)。共接受3~8个周期治疗,21 d为1个周期。放疗采用6-MeV电子线的直线加速器行调强适形放射治疗,肿瘤靶区(gross tumor volume,GTV)为肉眼或临床检查可见的原发灶及阳性淋巴结,临床靶区(clinical tumor volume,CTV)包括GTV在内以及邻近器官或结构组织,靶区剂量范围为24~46 Gy(中位剂量38 Gy),1.8~2.0 Gy/d,每周 5 d。
1.3 随访
通过门诊或电话随访,随访内容包括血清LDH、肿瘤标志物、浅表淋巴结彩超、胸片、腹部彩超、颈胸腹CT等,每3月1次,随访时间截至2019年6月6日,随访期间死亡46例,无失访者。无进展生存期(progression free survival,PFS)定义为自确诊之日至出现进展、复发、死亡或随访截止的时间。总生存期(overall survival,OS)定义为自确诊之日至死亡或随访截止的时间。
1.4 统计学方法
采用 X-Tile 3.6.1 软件(http://tissuearray.org)计算PLR的最佳截断值,采用SPSS 17.0软件进行数据分析。计量数据采用均数±标准差(x±s)表示,分类数据采用例数(百分比)表示。分类资料的组间比较采用χ2检验或Fisher精确概率法。生存曲线分析采用Kaplan-Meier,组间比较采用Log-rank检验。采用Cox回归模型分别分析PLR与患者PFS和OS的关系,并计算风险比(HR)及其对应的95%可信区间(CI)。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共74例患者符合标准纳入研究,其中男性50例,女性 24例;中位年龄53岁(30岁~79岁);按照 Ann Arbor分期[10],Ⅰ期 5例(6.8%),Ⅱ期 26例(35.1%),Ⅲ期27例(36.5%),Ⅳ期16例(21.6%)。以OS为终点事件,X-Tile软件计算PLR的最佳截断值为186.8(χ2=13.232,P=0.009)。根据PLR 截断值将患者分为低PLR组59例(79.7%),高PLR组15例(20.3%),两组患者的各项临床特征比较,差异均无统计学意义(P>0.05)。见表 1。
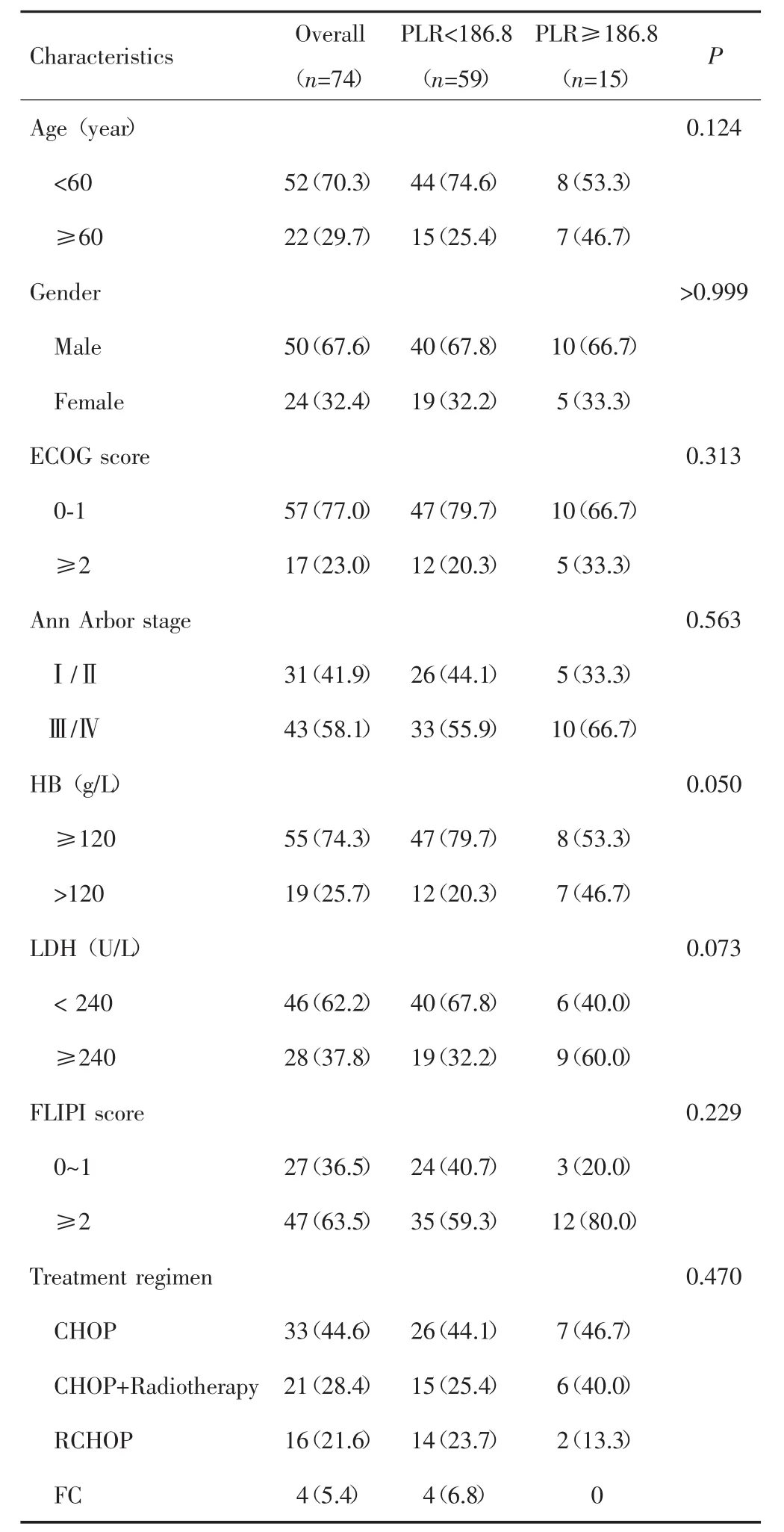
表1 两组患者的临床特征比较[n(%)]Tab.1 The comparison of clinical characteristics between the two groups[n(%)]
2.2 生存分析
中位随访42个月(范围:6~144个月)。4年PFS为42.0%,见图1A;4年OS为54.7%,见图 1B。低PLR组和高PLR组的4年PFS分别为51.3%和6.7%,差异有统计学意义(χ2=25.320,P<0.001),见图1C;两组4年OS分别为65.7%和8.3%,差异亦有统计学意义(χ2=29.414,P<0.001),见图 1D。

图1 FL患者的PFS及OS生存曲线Fig.1 The survival curve of PFS and OS for FL patients
2.3 PLR与FL患者PFS及OS的关系
单因素Cox回归分析显示,年龄、Ann Arbor分期、ECOG评分、LDH、HB、FLIPI评分及PLR与PFS和OS有关(P<0.05)。多因素Cox回归分析显示,PLR≥186.8是影响FL患者PFS(HR=3.949,95%CI:1.856~8.404,P<0.001)和 OS(HR=4.795,95%CI:2.259~10.178,P<0.001)的独立危险因素。见表2、表3。
2.4 PLR与不同FLIPI评分患者预后的关系
根据FLIPI评分,27例患者属于低危组(0~1分),47例患者归属为中高危组(≥2分)。进一步分层分析,发现在低危FL患者中,低PLR组的中位PFS和中位OS均高于高PLR组(PFS:75.5个月vs19.0个月,χ2=14.798,P<0.001,图 2A;OS:85.5 个月vs28 个月,χ2=13.271,P<0.001,图 2B);在中高危 FL 患者中,低PLR组的中位PFS和中位OS亦均高于高PLR组(PFS:32.0 个月vs12.0 个月,χ2=10.766,P=0.001,图 2C;OS:51.0 个月vs19.0 个月,χ2=13.404,P<0.001,图 2D)。

表2 影响FL患者PFS的单因素及多因素分析Tab.2 Univariate and multivariate analysis of prognostic factors for PFS in FL patients
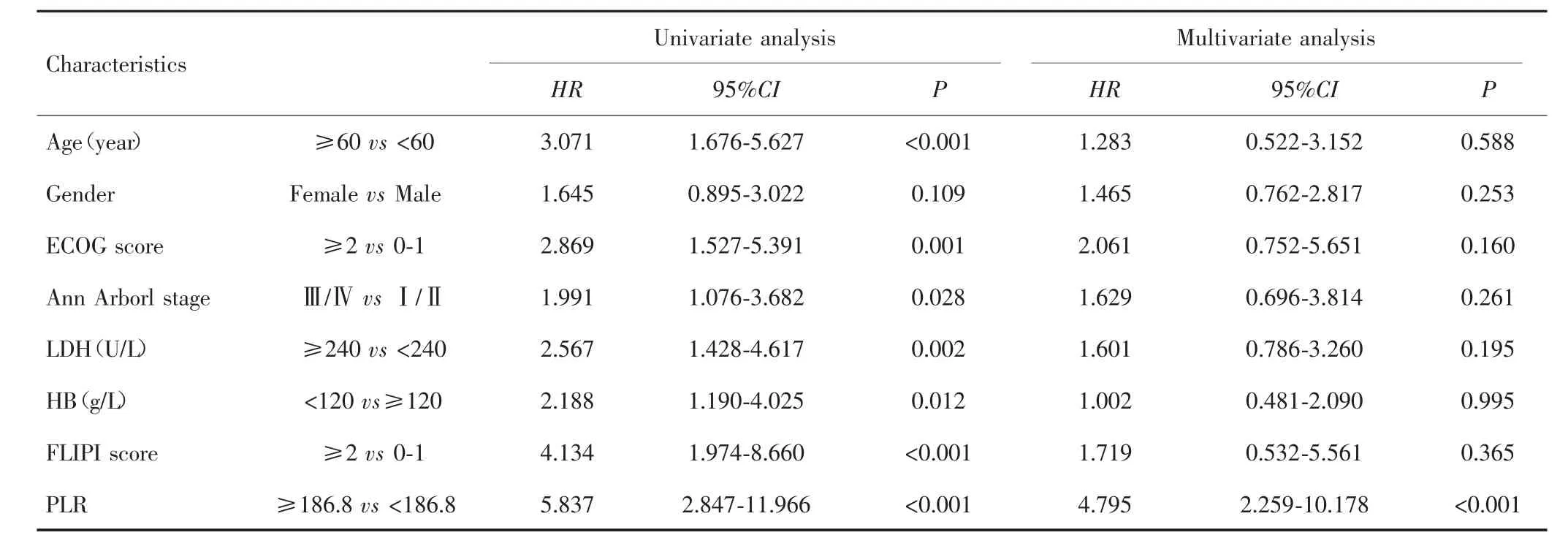
表3 影响FL患者OS的单因素及多因素分析Tab.3 Univariate and multivariate analysis of prognostic factors for OS in FL patients
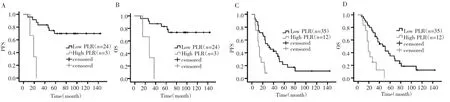
图2 PLR与不同FLIPI评分FL患者PFS及OS的关系Fig.2 Different FLIPI score for the relationships of between the PLR and PFS or OS
3 讨论
滤泡淋巴瘤是一种常见的惰性淋巴瘤,西方国家发病率较高(22%~35%),而我国发病率整体较低(8.1%~23.5%),具有高度临床异质性[11]。该病典型的临床表现为全身多处无痛性淋巴结肿大,确诊时患者往往处于晚期[4]。本研究纳入的患者中晚期患者占58.1%,与上述文献相似。FL的中位发病年龄为60岁左右,生长缓慢,恶性程度低,对治疗敏感,总体预后较好,中位生存期可长达10年左右[12]。但由于其惰性的生物学特性,初始治疗后易复发,预后较差[13]。本研究中,74例FL患者中位发病年龄为53岁,4年PFS为42.0%,OS为54.7%,发病年龄与既往文献报道相类似[12],但 PFS及 OS较 LEE 等[14]报道略低,可能与入组病例不同、人种及地域分布差异以及治疗方案不同等有关。
研究认为FLIPI评分[5]在FL的预后评估中发挥重要作用,对临床治疗选择亦有重要的指导价值。但FLIPI评分的建立是在利妥昔单抗应用前产生,难以评估使用利妥昔单抗方案患者的预后。与此同时,上述预后指数主要由临床体征组成,不能全面反映FL的生物学行为,因此寻找新的评估FL患者预后的指标有重要意义。既往研究[15-16]发现肿瘤微环境中炎症反应与其预后密切相关。亦有研究报道PLR与多种实体肿瘤的预后有关,包括恶性淋巴瘤[6-9]。一般认为PLR比值升高说明淋巴细胞相对减少或血小板相对增多。其中,淋巴细胞作为判断机体微环境中免疫反应的主要指标之一,在肿瘤细胞的发生发展及转移过程中发挥重要的免疫监视和免疫防御作用,同时亦可促进肿瘤细胞凋亡,发挥抗肿瘤作用[17]。有研究发现外周血淋巴细胞数量减少是影响FL、结外NK/T细胞淋巴瘤、弥漫大B细胞淋巴瘤预后的独立危险因素[18-20]。肿瘤患者往往合并高凝状态,伴随继发性血小板增多,而这可能是肿瘤触发的非特异性炎症反应所致[21]。与此同时,炎症反应可诱导多种细胞因子如白介素-10、白介素-6释放,抑制宿主免疫功能,导致免疫抑制,促进肿瘤细胞发生发展[22-24]。以上研究说明PLR能够反映肿瘤患者微环境中炎症反应与抗肿瘤免疫反应间的平衡状态,PLR值越高说明其抗肿瘤能力越低,预后越差。越来越多的研究表明PLR可广泛应用于评估实体肿瘤和血液淋巴瘤肿瘤患者的预后[6-9]。
本研究发现,低PLR组的PFS和OS较高PLR组长,多因素分析亦证实PLR是影响FL患者预后的独立因素。分析原因可能是高PLR患者的淋巴细胞数相对较少,免疫抑制较严重,而血小板相对较多,炎症反应较为强烈,造成抗肿瘤免疫反应和肿瘤炎症反应失衡,导致肿瘤免疫逃逸和转移扩散,致使预后较差。为进一步检验PLR评估FL预后的价值,本研究根据FLIPI评分进行分层分析,结果发现,PLR低危与高危组中,低PLR患者的PFS和OS均较高PLR患者长,提示PLR可作为评估FL患者预后的生物学标志物,有助于判断FL患者机体微环境中免疫能力。既往研究[5,13]证实年龄、Ann Arbor分期、ECOG 评分、HB、LDH、FLIPI评分与FL患者预后有关。本研究单因素亦发现年龄≥60岁、Ann Arbor分期Ⅲ/Ⅳ期、ECOG评分≥2分、HB<120 g/L、LDH升高的患者生存期较差,与既往文献报道相符[5,13]。值得注意的是,本研究多因素分析显示Ann Arbor分期、ECOG评分、HB、LDH均不是独立的预后影响因素,说明FL预后受多种因素影响。但本研究发现一些国际公认的指标如年龄并不构成独立的危险因素,可能由于本研究样本量相对较少,随访时间较短,亦可能得益于现有医疗技术水平提高和放化疗的优化改进,患者更耐受治疗。
综上所述,本研究发现PLR高的FL患者预后较差,PLR是影响FL患者预后的独立指标,有望成为评估FL预后的指标。但本研究属于单中心小样本回顾性研究,有待多中心大样本前瞻性研究来进一步优化其预后评估价值,以更好地指导临床医师选择合理有效的个体化治疗方案,改善患者预后。
