沉默ERK5对胃癌SGC-7901、BGC-823细胞生物学功能的影响
2019-08-07庞森吴向华李贵彬陈俊黄精乐
庞森 吴向华 李贵彬 陈俊 黄精乐
作者单位:530021 南宁 广西医科大学第一附属医院胃肠腺体外科
胃癌是我国最常见的消化道恶性肿瘤,术后易复发转移,严重影响患者的生存[1]。因此,探讨胃癌生长侵袭的机制,寻找治疗胃癌的有效靶点尤为重要。细胞外信号调节激酶5(extracellular signal regulated kinase 5,ERK5)是丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)信号转导通路家族新发现的成员之一。近年来多项研究提示ERK5与肿瘤的生物学行为密切相关,如,ERK5在乳腺癌[2]、前列腺癌[3]及结直肠癌[4]等多种恶性肿瘤中呈高表达并促进肿瘤的生长与侵袭。另有研究表明,胃癌组织中ERK5蛋白高表达可能与患者生存预后较差有关[5]。本研究检测多种人胃癌细胞株及胃黏膜上皮细胞GES-1中ERK5 mRNA的表达水平,并采用RNA干扰技术敲低胃癌细胞SGC-7901、BGC-823中ERK5的表达,观察沉默ERK5对胃癌细胞生长、侵袭等细胞生物学功能的影响,以期为胃癌的靶向治疗提供新思路。
1 材料与方法
1.1 主要材料
人胃癌细胞株 SGC-7901、BGC-823、AGS、HGC-27和人胃黏膜上皮细胞株GES-1购自中科院上海细胞库;无糖型RPMI 1640培养基、0.25%含EDTA胰蛋白酶、澳洲胎牛血清购自美国Gibco公司;ERK5及内参GAPDH引物购自上海吉凯公司;qRT-PCR相关试剂盒购自日本Takara公司;CCK-8试剂购自日本同仁公司;Transwell小室购自美国Corning公司;Matrigel生物胶购自美国BD公司;Annexin V-APC/7AAD凋亡试剂及细胞周期试剂购自杭州联科生物公司。
1.2 方法
1.2.1 干扰序列的合成与慢病毒载体的构建 靶向干扰ERK5基因序列的短发荚RNA(shRNA)及阴性对照shRNA均委托上海吉凯公司设计合成,并克隆包装至慢病毒载体中。
1.2.2 细胞培养 各细胞株接种于含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的RPMI 1640培养基中,并置于37℃、5%CO2细胞培养箱中培养。
1.2.3 细胞转染 胰酶收集胃癌细胞SGC-7901、BGC-823并接种于6孔板中。采用携带ERK5-shRNA及阴性对照shRNA的慢病毒分别对上述两株细胞进行转染(慢病毒感染复数:SGC-7901细胞MOI=10;BGC-823细胞MOI=100),并分别将SGC-7901细胞及BGC-823细胞分为沉默组(KD组)、阴性对照组(NC组),荧光倒置显微镜下观察细胞慢病毒感染率,qRTPCR检测ERK5基因的沉默效果。
1.2.4 qRT-PCR检测细胞中ERK5 mRNA的表达
Trizol法提取细胞总RNA,并用逆转录试剂盒将总RNA逆转录为cDNA。采用荧光定量PCR仪进行扩增。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃5 s,循环 40 次。以GAPDH为内参基因,2-ΔΔCt法分析各组细胞ERK5 mRNA的相对表达量。引物序列:ERK5上游引物为5'-GCCTGTTGGAACGCTGGACTC-3',下游引物为 5'-GGAGGAGGACTGGTAGGTTGGAC-3';内参 GAPDH上游引物为5'-TGACTTCAACAGCGACACCCA-3',下游引物为5'-CACCCTGTTGCTGTAGCCAAA-3'。实验重复3次。
1.2.5 CCK-8法检测胃癌细胞生长能力 将转染后的胃癌细胞SGC-7901、BGC-823分别以2 000个/孔接种于96孔板,每组设5个复孔,连续培养4 d。分别在细胞接种 1 d、2 d、3 d、4 d 后每孔加入 10 μL CCK-8试剂继续孵育2 h。使用酶标仪检测450 nm波长处各孔细胞吸光度值(OD450),根据吸光度值绘制胃癌细胞生长曲线图。实验重复3次。
1.2.6 平板克隆形成实验检测胃癌细胞克隆形成能力 将转染后的胃癌细胞SGC-7901、BGC-823分别以1 000个/孔接种于6孔板中,连续培养10 d。4%多聚甲醛固定细胞10 min,并以0.1%结晶紫溶液染色30 min。PBS清洗后拍照并计数大于50个细胞的克隆数。实验重复3次。
1.2.7 Transwell小室法检测胃癌细胞迁移和侵袭能力 用无血清培养基稀释后的Matrigel基质胶包被Transwell小室底膜的上层面,待其聚合成凝胶。用胰酶收集转染后的各组胃癌细胞,用200 μL无血清培养基重悬5×104个细胞接种于小室上室,下室孔板中加入600 μL含15%胎牛血清的培养基。培养24 h后用棉签轻轻擦去上室未穿膜细胞,4%多聚甲醛固定10 min,0.1%结晶紫溶液染色30 min,风干后显微镜下观察计数穿膜细胞。细胞迁移实验不需要提前铺胶,其余步骤同侵袭实验。实验重复3次。
1.2.8 流式细胞仪检测胃癌细胞凋亡与细胞周期 转染后的胃癌细胞 SGC-7901、BGC-823 以 1×105个/孔接种于6孔板中连续培养3 d,用胰酶收集于离心管中。预冷PBS洗涤及离心细胞2次,分别进行细胞周期与细胞凋亡检测。⑴细胞凋亡:每管细胞加入5 μL Annexin V-APC及10 μL 7AAD试剂混匀,室温下避光孵育30 min,流式细胞仪(FACS)分析细胞凋亡情况。⑵细胞周期:每管细胞加入10 μL破膜剂及1 mL碘化丙啶(PI,50 μg/mL)溶液混匀,室温下避光孵育1 h,FACS仪分析细胞周期分布。实验重复3次。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。数据以均数±标准差(x±s)表示。胃癌和胃黏膜上皮细胞株ERK5 mRNA表达水平的组间比较采用单因素方差分析,若整体差异有统计学意义,进一步的多重比较采用LSD检验。NC组与KD组细胞ERK5 mRNA表达水平、细胞克隆数、迁移、侵袭、凋亡和周期数据分析采用独立样本t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 ERK5 mRNA在胃癌细胞株中呈高表达
qRT-PCR 检测结果显示,SGC-7901、BGC-823、AGS、HGC-27和GES-1细胞中ERK5 mRNA相对表达量分别为 2.696±0.501、1.865±0.185、1.793±0.137、1.530±0.093和1.008±0.158,组间差异有统计学意义(F=14.724,P<0.001)。与胃黏膜上皮细胞GES-1相比,胃癌细胞 SGC-7901、BGC-823、AGS、HGC-27 中 ERK5 mRNA均显著高表达(P<0.001,0.003,0.005,0.003),见图1。因此,本研究选取ERK5表达水平相对较高的胃癌细胞SGC-7901与BGC-823进行后续实验。
2.2 转染ERK5-shRNA沉默胃癌细胞SGC-7901、BGC-823中ERK5 mRNA的表达
荧光倒置显微镜下观察慢病毒转染后细胞绿色荧光蛋白表达,结果显示,胃癌细胞SGC-7901、BGC-823慢病毒转染效率均大于80%,见图2A~B。qRT-PCR实验结果显示,SGC-7901细胞NC组与KD组中ERK5 mRNA相对表达量分别为1.000±0.029和0.256±0.019,差异有统计学意义(P<0.001),KD组胃癌细胞沉默效率为(74.4±1.5)%,见图 2C;BGC-823细胞 NC 组与BGC-823KD组中ERK5mRNA相对表达量分别为1.010±0.188 和 0.309±0.049,差异有统计学意义(P=0.002),KD组胃癌细胞沉默效率为(69.1±3.9)%,见图2D。说明两株胃癌细胞转染成功,可用于后续功能实验。
2.3 沉默ERK5可抑制胃癌细胞的生长能力
CCK-8实验检测结果显示,在SGC-7901与BCG-823两株胃癌细胞中,KD组细胞OD450值均显著低于NC组细胞,提示沉默ERK5可抑制两株胃癌细胞的生长能力。见图3及表1。
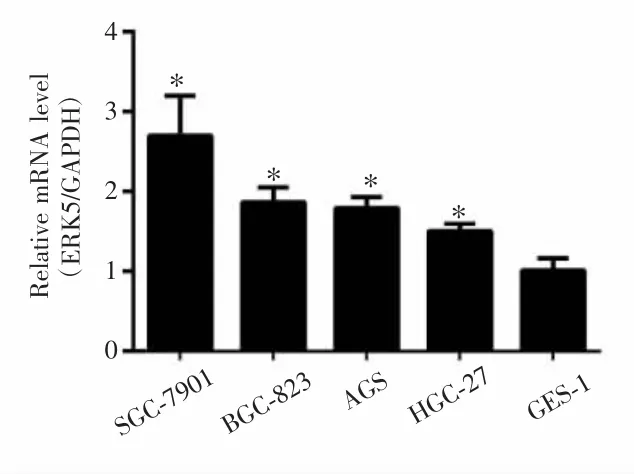
图1 不同胃癌细胞株及胃黏膜上皮细胞株中ERK5 mRNA的表达Fig.1 Expression of ERK5 mRNA in gastric cancer cell lines and gastric mucosal epithelial cell line

图2 慢病毒转染后胃癌细胞中ERK5 mRNA的表达水平Fig.2 Expression levels of ERK5 mRNA in gastric cancer cells after lentiviral transfection
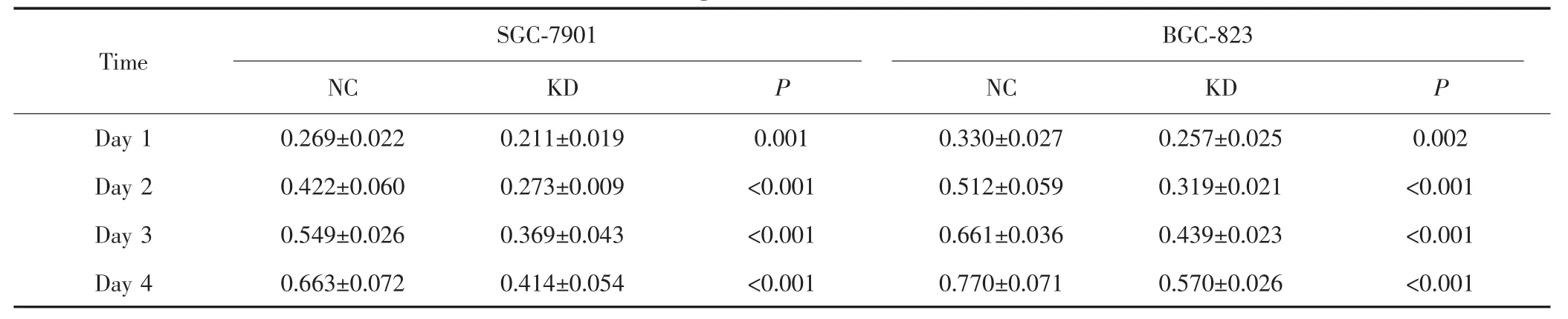
表1 胃癌细胞SGC-7901、BGC-823 OD450值Tab.1 The OD450values of gastric cancer SGC-7901 and BGC-823 cells

图3 胃癌细胞SGC-7901、BGC-823生长曲线Fig.3 Growth curve of gastric cancer SGC-7901 and BGC-823 cells
2.4 沉默ERK5抑制了胃癌细胞克隆形成能力
平板克隆实验结果显示,SGC-7901细胞NC组与KD组细胞克隆形成数目分别为(858.333±22.066)个和(564.667±26.107)个,差异有统计学意义(P<0.001);BGC-823细胞NC组与KD组细胞克隆形成数目分别为(458.000±18.457)个和(241.333±32.887)个,差异亦有统计学意义(P<0.001)。提示沉默ERK5可抑制两株胃癌细胞克隆形成能力。
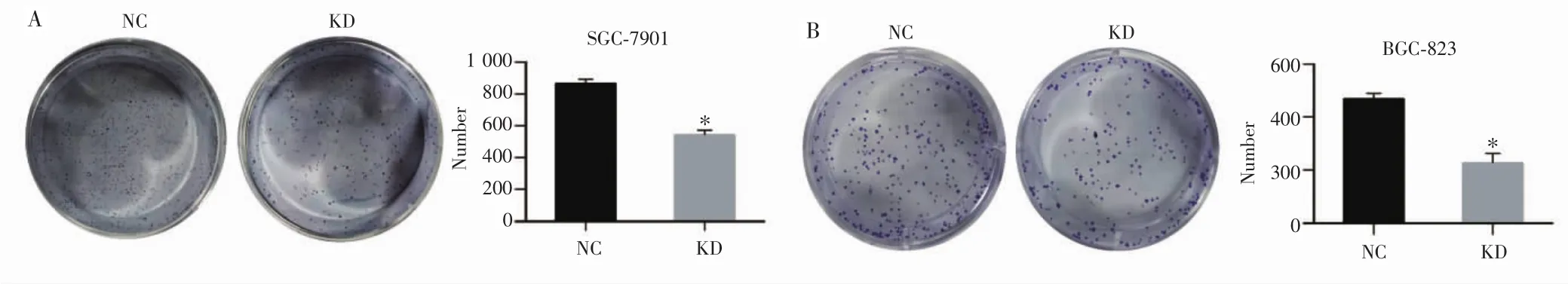
图4 胃癌细胞SGC-7901、BGC-823克隆形成情况Fig.4 Clonal formation of gastric cancer SGC-7901 and BGC-823 cells
2.5 沉默ERK5可抑制胃癌细胞的迁移与侵袭能力
Transwell迁移及侵袭实验结果显示,SGC-7901细胞NC组与KD组细胞迁移穿膜数分别为(161.000±13.928)个、(65.333±3.682)个,细胞侵袭穿膜数分别为(51.500±5.679)个、(12.333±2.494)个,与NC 组相比,KD 组细胞迁移穿膜数及细胞侵袭穿膜数均显著减少(P=0.001,<0.001),见图5A。BGC-823细胞NC组与KD组细胞迁移穿膜数分别为(93.333±4.497)个、(59.667±3.091)个,细胞侵袭穿膜数分别为(35.000±4.123)个、(17.750±1.920)个,与NC组相比,KD组细胞迁移穿膜数及细胞侵袭穿膜数均显著减少(P=0.001,0.014),见图5B。说明沉默ERK5可抑制胃癌细胞的迁移及侵袭能力。

图5 胃癌细胞SGC-7901、BGC-823的迁移及侵袭情况Fig.5 Migration and invasion of gastric cancer SGC-7901 and BGC-823 cells
2.6 沉默ERK5促进胃癌细胞的凋亡
流式细胞仪检测结果显示,SGC-7901细胞 NC组与KD组的细胞凋亡率分别为(4.767±0.509)%和(8.480±0.212)%;BGC-823细胞 NC 组与 KD 组细胞凋亡率分别为(5.890.±0.195)%和(11.587±1.176)%,SGC-7901、SGC-823胃癌细胞KD组细胞凋亡率均大于NC组的细胞凋亡率(P=0.001,0.002),见图6。说明沉默ERK5可促进胃癌细胞的凋亡。
2.7 沉默ERK5改变了胃癌细胞的周期分布
流式细胞仪检测结果显示,SGC-7901细胞NC组与KD组的细胞SGC-7901、SGC-823周期分布比例G0/G1期分别为(55.787±1.035)%和(69.997±2.570)%;S期分别为(25.643±0.693)%和(21.110±1.507)%;G2/M 期分别为(17.567±0.753)%和(8.897±1.068)%,NC组与KD组各周期分布比例差异有统计学意义(P=0.002,0.018,0.001),见图 7A。BGC-823 细胞 NC组与KD组细胞周期分布比例G0/G1期分别为(51.413±1.574)%和 (64.240±0.612)%,S 期分别为(33.863±1.228)%和(26.603±2.630)%,G2/M 期分别为(14.723±0.487)%和(9.827±1.649)%,NC 组与 KD 组各周期分布比例差异有统计学意义(P<0.001,0.024,0.016),见图7B。说明沉默ERK5可改变两株胃癌细胞各周期分布比例,主要引起G0/G1期细胞周期阻滞。

图6 胃癌细胞SGC-7901、BGC-823凋亡分布Fig.6 Distribution of apoptosis in gastric cancer SGC-7901 and BGC-823 cells
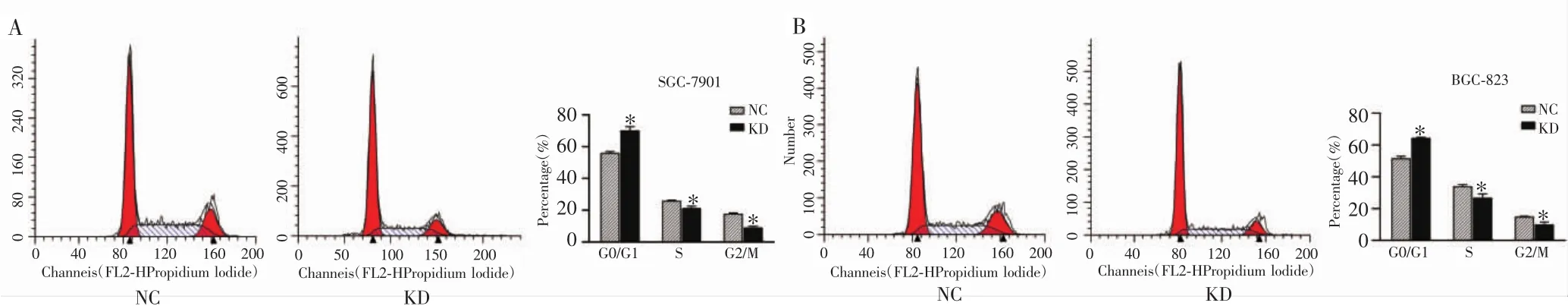
图7 胃癌细胞SGC-7901、BGC-823周期分布情况Fig.7 Cell cycle distribution of gastric cancer SGC-7901 and BGC-823 cells
3 讨论
据GLOBOCAN统计资料显示,2018年全球胃癌新增病例约103万,死亡病例约78万,病死率仅次于肺癌[6]。胃癌发病隐匿,早期临床特征不明显,患者就诊时往往处于进展期,传统手术及化疗治疗效果有限,预后较差。随着分子生物学的快速发展,靶向治疗具有特异性强、副作用小等优点,成为胃癌治疗的研究热点。但目前胃癌靶向治疗进展较缓慢,寻找合适的靶标并阐明其相关功能,将有助于改善胃癌治疗现状[7]。
MAPK信号转导通路在多种恶性肿瘤的发生发展中起重要作用[8],ERK5作为MAPK信号通路的成员之一,与肿瘤的生长、侵袭密切相关。有研究报道ERK5被MEK5α激活移位到细胞核内进而发挥调节转录功能[9]。研究发现ERK5在乳腺癌组织中呈高表达并促进乳腺癌细胞生长[2]。ERK5抑制剂可促进白血病细胞Kasumi-1和HL-60凋亡[10]。MEK5-ERK5通路的抑制可调控周期蛋白D1、周期蛋白E和CDK4的表达,进而诱导G1期细胞周期阻滞导致鼻咽癌细胞CNE1的生长抑制[11]。此外,还有研究认为在胃癌组织中ERK5表达水平与肿瘤恶性程度有关[12],推测ERK5可能对胃癌的生长、侵袭有着重要的调控作用。因此,本研究进一步分析ERK5在胃癌细胞中的生物学功能,以期对胃癌的靶向治疗提供新思路。
本研究检测了多种人胃癌细胞株和人胃黏膜上皮细胞株GES-1中ERK5 mRNA的相对表达水平,发现胃癌细胞 SGC-7901、BGC-823、AGS 与 HGC-27 中ERK5 mRNA的表达水平均显著高于胃黏膜上皮细胞。且其中选取ERK5表达水平较高的胃癌细胞SGC-7901与BGC-823进行了一系列细胞功能学实验,结果发现,沉默胃癌细胞中ERK5的表达可抑制胃癌细胞的生长并促进其凋亡。同时,沉默ERK5还抑制了胃癌细胞的迁移与侵袭能力,表明ERK5的高水平表达可能与胃癌细胞的高转移性有关。此外,沉默ERK5还影响胃癌细胞的周期分布,使细胞阻滞在G1期,进而导致胃癌细胞的生长抑制。有研究发现ERK5调控胃癌细胞的生长可能是通过抑制细胞凋亡和促进细胞周期进展而实现[13],但具体机制仍需进一步阐明。在白血病中,有研究发现ERK5通过负反馈调节microRNA-143介导的Fas凋亡途径影响细胞凋亡[14]。ERK5也可通过TGFβ介导的上皮-间质转化(EMT)途径调控乳腺癌细胞的迁移和侵袭能力[15]。在胃癌中ERK5亦可能通过类似的分子机制调控胃癌细胞的凋亡和侵袭能力,有关方面值得进一步深入研究。
综上所述,本研究通过体外实验证实了沉默ERK5对胃癌细胞生长侵袭能力具有抑制作用。但本研究仅探讨了ERK5对胃癌细胞生物学功能的影响,在未来的研究中将进一步阐明ERK5影响胃癌细胞生长侵袭的具体分子机制,ERK5有望成为胃癌治疗的新靶点。
