新辅助化疗对乳腺浸润性微乳头状癌的预后影响及其疗效分析*
2019-08-07贾宏琴李伟东谷峰李帅韩芸蔚付丽
贾宏琴 李伟东 谷峰 李帅 韩芸蔚 付丽
乳腺浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)在乳腺癌中的发生率约为6%[1],研究表明IMPC 具有淋巴结转移率高的特性,但其侵袭转移分子机制的研究尚不完善,临床治疗与非特殊型浸润性癌无异,预后报道不一[2-4]。新辅助化疗(neoadjuvant chemotherapy,NAC)可降低乳腺癌患者的临床分期,为患者创造手术机会,而其在IMPC 患者中的疗效研究甚少。本研究旨在探讨NAC对乳腺IMPC的预后影响及疗效差异,为乳腺IMPC的临床精准治疗提供理论依据。
1 材料与方法
1.1 一般资料
收集2011年1月至2014年3月251 例于天津医科大学肿瘤医院诊治的IMPC 女性患者的临床病理资料,分为NAC 组(67 例)和非NAC 组(184 例)。所有患者中位年龄为50(27~70)岁,纯型IMPC患者为42例(3例为双发病灶)、混合型为209例。采用乳腺癌AJCC指南(第七版)进行TNM分期。纳入标准:1)病理诊断含IMPC成分≥1%;2)所有患者总化疗周期≥6个周期,其中NAC 组术前化疗周期≥1个周期;3)采用标准乳腺癌联合化疗或序惯化疗方案。排除标准:1)非NAC组中病理学TNM分期为Ⅰ期;2)有乳腺癌既往史;3)初诊4 个月内发现远处转移;4)单药化疗。
1.2 方法
1.2.1 免疫组织化学法评分标准 ER 和PR 表达阳性被定义为细胞核染色≥1%,HER-2 判定标准参照美国临床肿瘤学会与美国病理医师学会指南。Ki-67以细胞核染色≥20%判为高表达,P53 蛋白染色以细胞核染色≥10%判为阳性。
1.2.2 随访 采用病历随访的方式,无复发生存(recurrence-free survival,RFS)时间为从确诊乳腺癌到首次确认出现同侧治疗区域的胸壁以及同侧腋窝、锁骨区淋巴结发生相同组织学类型肿瘤或末次随访时间,无远处转移生存(distant metastasis-free survival,DMFS)时间为从确诊乳腺癌到首次出现远处转移或末次随访的时间。患者确诊日期作为随访起始日期,截止至2018年11月。
1.2.3 倾向评分匹配法 采用倾向评分匹配法(propensity score matching,PSM)以1:1 进行最近邻匹配,匹配时将连续变量肿瘤直径(治疗前),分类变量年龄(是否年龄>50 岁)、绝经、ER、PR、HER-2、Ki-67、P53 状态纳入预测变量。为防止每对匹配的个体差别过大,以匹配容差值为0.01 进行倾向性匹配。采用标准化差异法来评价两组基线资料的均衡性。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。组间比较等级资料采用χ2检验,计量资料组间比较采用Mann-Whitney U 检验,配对样本间等级资料和计量资料比较均采用Wilcoxon 配对秩和检验。单因素生存分析采用Kaplan-Meier 法,采用Cox比例回归风险模型进行多因素生存分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 NAC组患者NAC治疗前后肿瘤大小改变
67 例NAC 组的IMPC 患者均未达到病理学完全缓解(pathological complete response,pCR)。NAC 前肿瘤最大径平均值为(5.0±2.3)cm,NAC 后减小为(4.2±2.8)cm(P=0.035)。NAC 前临床T1/T2/T3 期的IMPC 患者分别为2、41、24 例,NAC 后的病理学T1、T2、T3期的IMPC 患者分别为12、32、23例,NAC 前后T分期差异无统计学意义(P=0.064)。67例患者中,T分期减小为20 例(29.9%)、T 分期无改变为38 例(56.7%)、T分期增大为9例(13.4%)。
2.2 两组匹配患者基线资料
行PSM 前,NAC 组患者的肿瘤最大径平均值为(5.0±2.3)cm,显著大于非NAC 组的(3.3±1.7)cm(P<0.001),NAC 组的T 分期亦显著高于非NAC 组(P<0.001),但NAC 组的Ki-67 表达低于非NAC 组(P=0.030);行PSM 后,共匹配49 对(98 例)患者,NAC 组与非NAC组的肿瘤最大径平均值分别为(4.3±1.9)cm与(4.2±2.0)cm(P=0.651),两组其他基线资料亦差异均无统计学意义(表1)。匹配后各基线指标几乎均绝对标准差<0.20,匹配效果较好(图1)。
2.3 两组患者术后病理参数比较
行PSM 前,NAC 组的肿瘤最大径平均值为(4.2±2.9)cm,显著大于非NAC 组的(3.3±1.7)cm(P=0.039);与非NAC组相比,NAC组患者行NAC后病理学T 分期、N 分期与肿瘤中的IMPC 成分比例均较高(均P<0.05)。行PSM 后,NAC 组与非NAC 组的肿瘤最大径平均值分别为(4.2±2.8)cm 与(4.2±2.0)cm,两组比较差异无统计学意义(P=0.461)。虽NAC 组的IMPC成分比例高于非NAC组,但两组其他参数均差异无统计学意义(均P>0.05),见表2。
2.4 生存分析
251例IMPC患者的中位随访时间为44(3.6~92.3)个月。匹配前、后NAC组的IMPC患者的5年累积RFS率(77.6%vs.89.2%)与非NAC组(72.1%vs.91.0%)比较差异均无统计学意义(均P>0.05,图2A,C);匹配前、后NAC 组的IMPC 患者的5年累积DMFS 率(53.4%vs.50.0%)均显著低于非NAC组的(69.1%vs.59.2%),两者比较差异具有统计学意义(均P<0.05,图2B,D)

表1 两组基线资料匹配前后比较
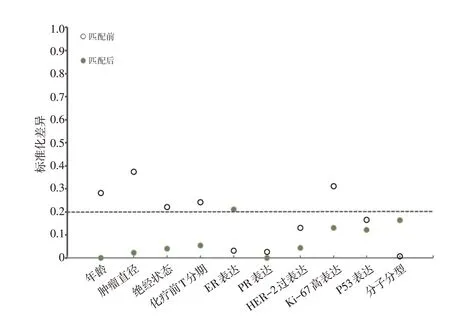
▶图1 匹配前、后各参数标准化差异
单因素生存分析显示,行PSM前的NAC、病理学高N分期及P53阳性患者的DMFS率更低(均P<0.05);行PSM后的NAC、病理学高N分期、ER阳性及HER-2阳性患者的DMFS更差(均P<0.05,表3)。采用Cox比例回归风险模型进行多因素生存分析显示,行PSM前的NAC不是患者远处转移风险的独立预后因素(P>0.05);行PSM后的NAC是患者DMFS的独立预后因素(P<0.05,表4)。
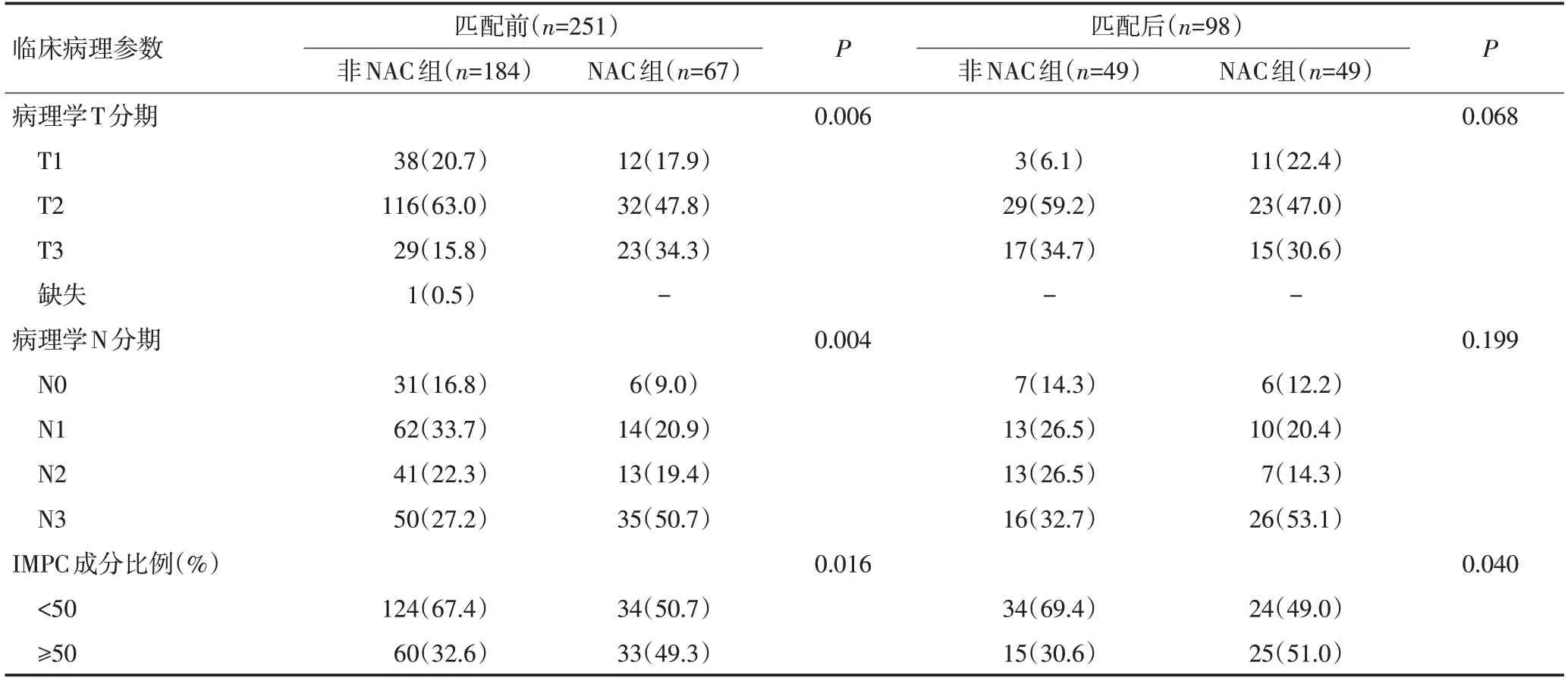
表2 两组患者术后病理参数比较
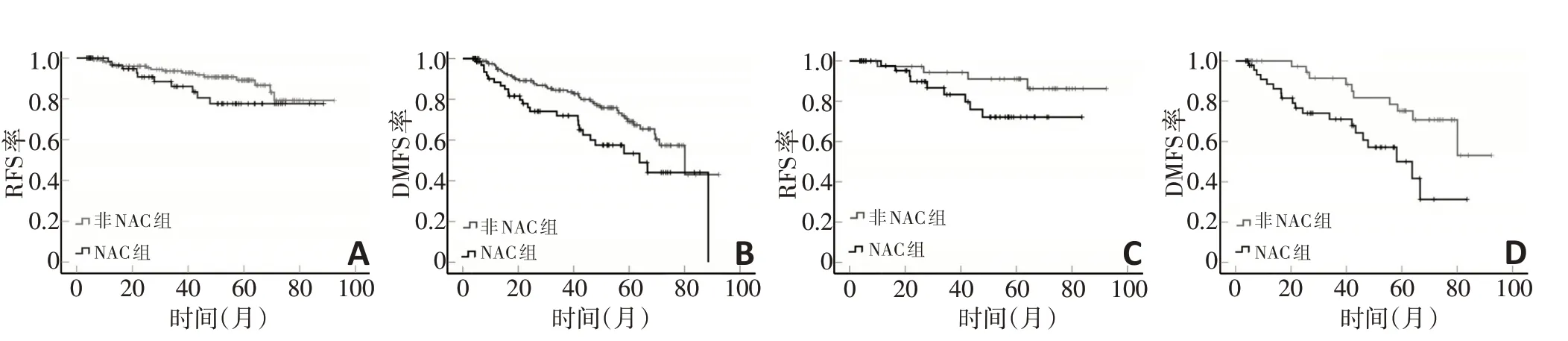
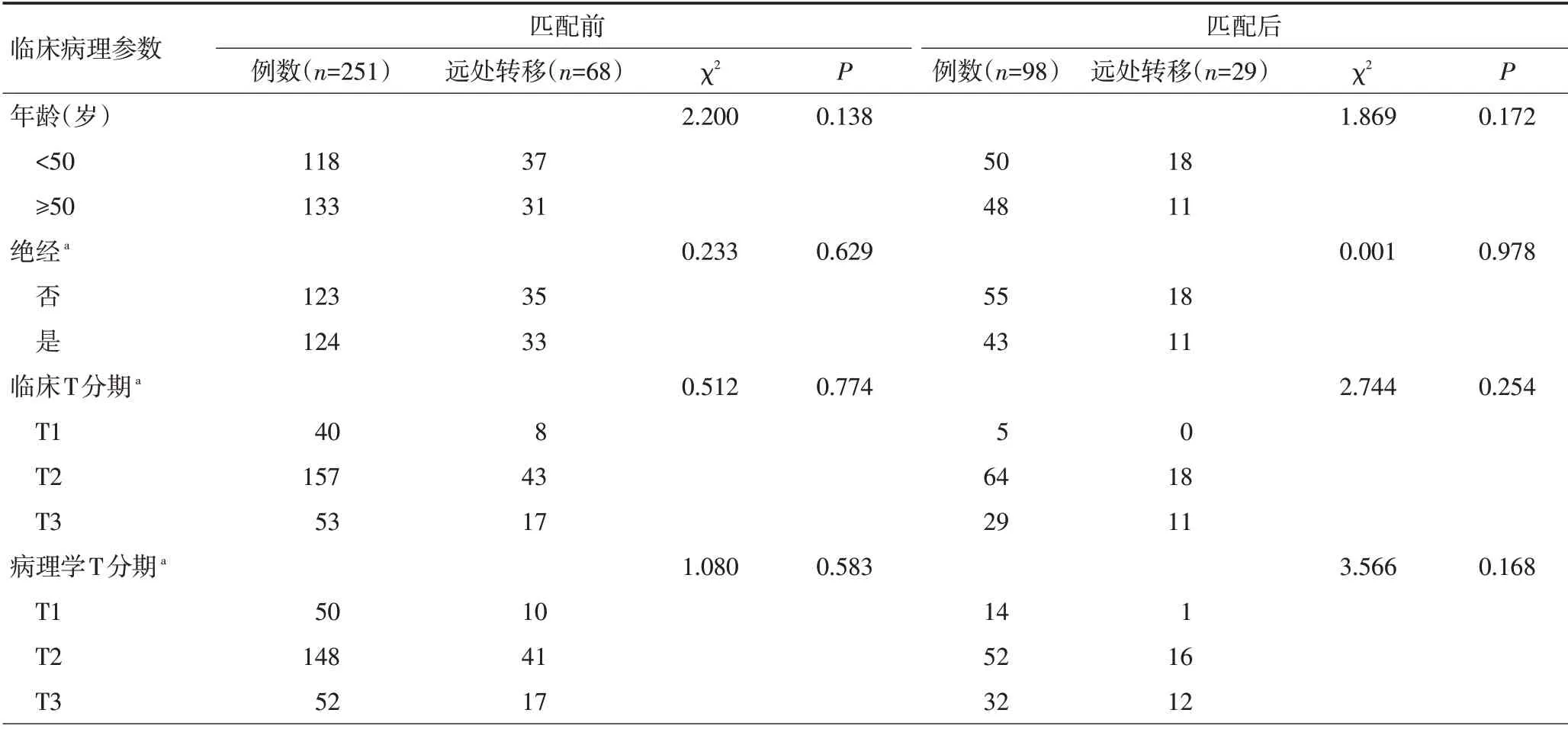
表3 匹配前、后影响IMPC患者DMFS的单因素生存分析

表3 匹配前、后影响IMPC患者DMFS的单因素生存分析(续表3)

表4 匹配前、后影响IMPC患者DMFS的多因素生存分析
3 讨论
NAC 已越来越多用于中晚期乳腺癌患者的治疗,并可缩小肿块提高手术成功率,提示肿瘤对化疗药物的敏感性。研究报道,因乳腺IMPC 的T 分期或N分期均较高[3,5],这类患者更倾向于行NAC,而70%以上的乳腺IMPC为Luminal型[6],该分子分型对化疗敏感性较差[7],因此探讨NAC 在IMPC 中的疗效及其预后的意义显得尤为重要。
本研究NAC 组67 例乳腺IMPC 患者(单纯型14例)的ER 阳性表达率为89.6%(60/67),均未达到pCR,仅20 例(29.9%)T 分期减小,NAC 组的IMPC 成分比例显著高于非NAC组,表明残留病灶中IMPC较多,提示NAC 虽可使少部分肿瘤体积缩小,但IMPC总体上对化疗并不敏感。Alvarado-Cabrero 等[8]研究也发现,29 例单纯型乳腺IMPC 患者均未达到pCR,且IMPC 与非特殊型浸润性癌的激素受体状态无显著性差异。以上结果表明乳腺IMPC 对化疗不敏感,或许不单与激素受体状态而且还与IMPC 的自身特性相关。
一项前瞻性研究[9]结果显示,行术前与术后化疗的乳腺癌患者总生存率无显著性差异,Yang 等[10]研究还表明Luminal B 型乳腺癌患者行NAC 后总生存率更低。pCR 亦是评估预后的重要指标,Luminal 型乳腺癌行NAC 后若不能达到pCR,将显著降低患者的复发后生存率[11]。本研究中NAC 组Luminal B 型乳腺IMPC患者达74.6%(50/67),且均未达到pCR,提示乳腺IMPC行NAC后预后不良。本研究还发现,行NAC 的乳腺IMPC 患者的DMFS 更差,并为行PSM 后的独立预后因素。因此,乳腺IMPC患者行NAC后的获益较小,并有增加远处转移的风险,这或许是因IMPC 高侵袭、转移的特性,而导致复发转移的高风险,而NAC 可能会延误手术施行及下一步的内分泌等靶向治疗。
此外,化疗药物本身也会对患者的预后产生影响。一方面,化疗或许通过使肿瘤产生耐药性,而降低机体的免疫力;另一方面,动物实验表明,化疗药物如环磷酰胺等还可通过招募巨噬细胞增加血管通透性,并通过上调与肌动蛋白运动相关的Mena 蛋白表达促进癌细胞渗出,从而诱导癌细胞重新定位并形成转移病灶[12-13]。
综上所述,IMPC是一类具有高淋巴管侵袭、高淋巴结转移特性的乳腺癌,对化疗不敏感。虽然NAC可使部分肿块减小,但因具有较高的局部复发及远处转移风险而使乳腺IMPC 患者获益较小,尽早手术切除或许是乳腺IMPC患者获益更大的治疗方案。
