糖尿病大鼠四肢痛阈及周围神经超微结构的变化
2019-08-06黄亚医
周 芳,刘 康,潘 侠,黄亚医,王 龙
(武汉大学人民医院麻醉科,武汉 430060;*通讯作者,E-mail:wanglongwhu@163.com)
糖尿病是一组代谢临床综合征,其发病机制复杂。目前糖尿病的实验动物模型主要分为遗传性动物模型、转基因动物模型和诱发性动物模型。前两者由于价格昂贵、饲养困难,发病程度难以把握及经验有限等缺点采纳较少,而诱发性动物模型研究得比较清楚,是大多数学者常采用的模型。诱发性动物模型最常采取的办法是使用手术或者化学方法破坏动物的胰腺组织,其中最常使用的化学药物有STZ和四氧嘧啶。STZ不仅能直接破坏胰岛β细胞,还能通过诱导一氧化氮(NO)和自由基的合成,激活自身免疫过程,从而导致β细胞的损坏。而四氧嘧啶主要是通过产生超氧自由基破坏β细胞,导致胰岛素合成减少,胰岛素缺乏。相比较而言,STZ单次腹腔注射制备糖尿病模型动物死亡率低,成模率高,模型稳定,操作方便,价格低廉,是目前国内外普遍使用的造模方法。然而此方法大鼠出现痛阈改变的时间报道不一,分析原因可能与动物品种、STZ配置方法、STZ用量、痛阈测定方法等相关。本文结合武汉大学人民医院用药经验及其他学者经验[1-3],采用60 mg/kg体质量STZ单次腹腔注射建立糖尿病大鼠模型,旨在观察大鼠四肢痛阈的改变以及背根神经节细胞和腓肠神经的病理改变。
1 材料和方法
1.1 实验动物
6周龄雄性SD大鼠50只,清洁级,体质量200-220 g,来源于中国湖南斯莱克景达实验动物有限公司[SCXK(湘)2016-0002],饲养于武汉大学人民医院实验动物中心(SPF级)[SYXK(鄂)2015-0027],每笼3-4只大鼠,自由摄食饮水,动物室内有良好的通风和空气过滤系统,室内温度在20-22 ℃,湿度50%-67%,光照与黑暗时间各为12 h,每天更换垫料,每周更换笼具3次。每只动物在饲养及实验过程中均按实验动物使用的3R原则给予人道的关怀[WDRM(福)第20150702]。
1.2 主要仪器与试剂
美国强生稳豪倍优血糖仪;Von Frey纤维丝(美国Stoelting公司);STZ(美国Sigma公司);枸橼酸缓冲液粉剂(北京华科盛公司)。
1.3 动物分组
10只大鼠做为正常对照组,模型组40只。所有大鼠均适应性饲养1周,测定基础血糖、体质量、痛阈。将模型组的40只大鼠用于制备DM模型,DM造模不成功的大鼠予以剔除。
1.4 STZ溶液的配置
2% STZ溶液的配置:①称取21.01 g的枸橼酸粉剂,用双蒸水溶解并将液体定容到1 000 ml,配置0.1 mol/L的枸橼酸缓冲液;②称取29.41 g的枸橼酸钠粉剂,双蒸水溶解并定容至1 000 ml,配置0.1 mol/L的枸橼酸钠缓冲液;③取0.1 mol/L的枸橼酸缓冲液22 ml,加入0.1 mol/L的枸橼酸钠缓冲液28 ml,混匀,配置pH4.5的枸橼酸/枸橼酸钠缓冲液,4 ℃保存备用;④快速称取STZ后置入干燥灭菌瓶内,外用锡箔纸避光,将pH4.5的枸橼酸/枸橼酸钠缓冲液及装STZ的容器置冰浴带入动物室,在冰上操作配置2%的STZ溶液,现配现用。
1.5 糖尿病模型的制备
糖尿病组采用高糖高脂饮食适应性饲养1周后,于造模前禁食12 h,按60 mg/kg体质量的剂量一次性腹腔注射2%的STZ溶液,腹腔注射72 h后经尾静脉取血测定空腹血糖,血糖≥16.7 mmol/L即为造模成功[1-3]。
1.6 机械痛阈的测定
采用up-and-down法,在糖尿病造模前、糖尿病造模成功后每周用Von Frey纤维丝(0.40,0.60,1.0,2.0,4.0,6.0,8.0,15.0 g)测定每组大鼠后脚趾对机械刺激50%缩爪阈值(mechanical withdrawal threshold,MWT)的改变。具体操作步骤如下:大鼠单独置于有网眼的支架铁丝板上,适应环境约30 min;待大鼠安静,用2.0 g力度的细丝由下向上垂直刺激两侧后趾外侧皮肤,直至成S形,每次刺激持续时间为6-8 s。注意避开肉垫,大鼠在刺激时间内或在移开von Frey纤维丝时立即出现快速的缩足反应记为阳性反应,除身体活动引起的缩足反应,两次刺激间隔时间最少为5 s;若无缩爪反应,则选择更强力度的4.0 g刺激后脚趾;若有缩爪反应,则选择较弱力度的1.0 g刺激后脚趾。依次类推,当出现一次与前一次不同的反应(如有缩爪反应变为无缩爪反应,或无缩爪反应变至有缩爪反应)时,继续依次刺激4次,包括先前的2次刺激,总共6次刺激,即可完成50%缩爪阈值的测定;若对有缩爪反应时所需要的刺激力度高于15.0 g或低于0.40 g的时,50%缩爪阈值则直接记为15.0 g或0.4 g[4-6]。
1.7 背根神经节和腓肠神经透射电镜形态学观察
造模成功后2,4,6周,每次随机选取8只大鼠采用1%的戊巴比妥钠(50 mg/kg,腹腔注射)麻醉,分离背根神经节和腓肠神经,置于2%的戊二醛液中4 ℃保存。磷酸缓冲液漂洗3次,环氧树脂包埋,常规超薄制片,醋酸双铅铀和枸橼酸铅染色,用透射电镜观察。
1.8 统计学分析
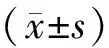
2 结果
2.1 成模率及死亡率
40只大鼠,有33只血糖高于16.7 mmol/L达到成模标准,造模成功率为82.5%;所有大鼠均存活,死亡率为0。
2.2 大鼠一般状态的变化
正常组大鼠饮食及尿量正常,精神饱满,反应敏捷,体质量随周龄的增加而逐渐增加;糖尿病组大鼠造模后饮食、尿量明显增多,随病程的增加精神逐渐萎靡,反应迟钝,体型明显消瘦(见图1)。
与正常组相比,*P<0.05图1 正常组与糖尿病组大鼠体质量变化趋势Figure 1 The variation trend of body weight in control group and diabetic group
2.3 血糖的变化
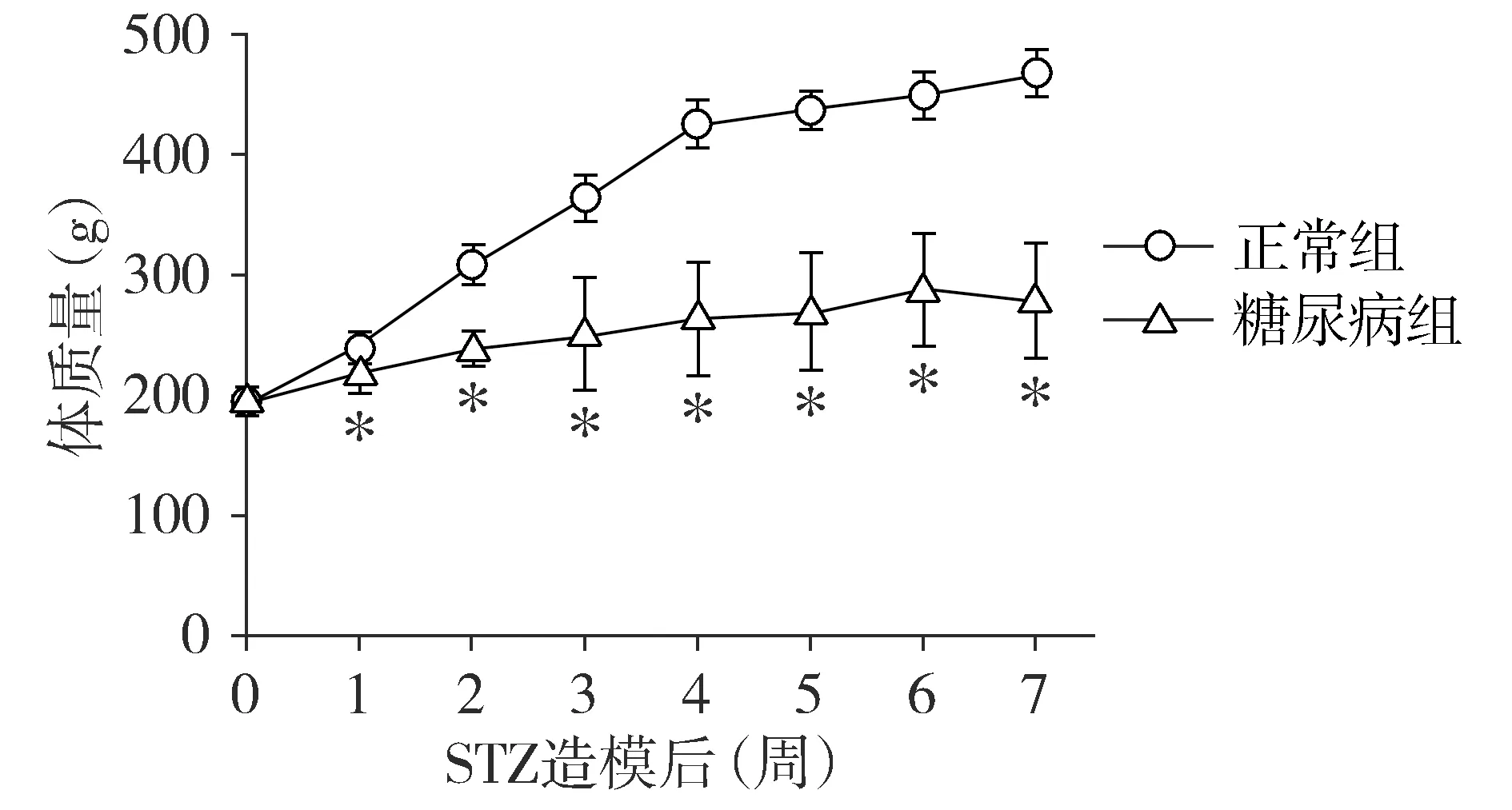
正常对照组血糖均在正常范围,随周龄无明显变化;糖尿病组血糖在造模后第1周即明显升高,此后随时间的延长逐渐增加,且高血糖状况持续整个实验过程(见图2),说明本实验糖尿病模型造模是成功的。
2.4 机械痛阈的改变
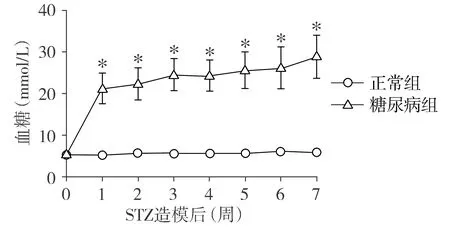
STZ造模成功后1周,糖尿病组大鼠的机械痛阈即低于正常组大鼠,且痛阈随时间的延长逐渐降低,与正常组大鼠间存在显著性差异(见图3),说明随糖尿病病程的进展,大鼠逐渐出现痛觉敏化。
与正常组相比,*P<0.05图2 正常组与糖尿病组大鼠血糖变化趋势Figure 2 Changes of blood glucose in control group and diabetic group
与正常组相比,*P<0.05图3 正常组与糖尿病组大鼠机械痛阈变化趋势Figure 3 The variation trend of mechanical withdrawal threshold in control group and diabetic group
2.5 背根神经节超微结构的改变
糖尿病制模成功后第2周末,核膜无明显皱褶,极少数内质网水肿,高尔基体清晰可见;第4周末可见核膜局部出现皱褶,内质网水肿较明显,小部分空泡化;第6周末核膜皱缩加重,绝大多数内质网空泡化(见图4),说明随糖尿病进程的进展,背根神经节细胞的损伤是逐渐加重的。
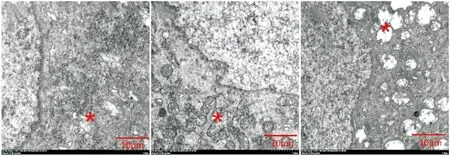
造模后2周末 造模后4周末 造模后6周末图4 造模成功后电镜下糖尿病组大鼠背根神经节的变化 (×4 000)Figure 4 Changes of dorsal root ganglion cells after successful modeling under electron microscopy (×4 000)
2.6 腓肠神经的超微结构变化
糖尿病制模成功后第2周末,腓肠神经结构基本正常,髓鞘局部出现断裂;第4周末髓鞘板层局部排列紊乱伴大量空泡形成;第6周末髓鞘正常形态消失,部分髓鞘已经溶解吸收,轴突内可见较多坏死物(见图5),说明长期的高血糖可导致有髓神经纤维出现脱髓鞘改变,且这一改变也是随糖尿病病程进展而逐渐加重的。

造模后2周末 造模后4周末 造模后6周末图5 造模成功后电镜下糖尿病组大鼠腓肠神经的变化 (×2 500)Figure 5 Changes of sural nerve after successful modeling under electron microscopy (×2 500)
3 讨论
神经病理性疼痛是常见的一种疼痛类型,据估计全世界有几百万人遭受神经病理性疼痛,约占总人数的7%[7]。糖尿病是引起神经病理性疼痛的主要原因之一,严重影响病人的生活质量,甚至造成功能障碍,还增加医疗费用,加重家庭负担。因此,该疼痛模型的建立对深入研究糖尿病的发病、治疗、预防及其并发症的转归有着重要意义。
糖尿病大鼠出现神经病变的机制目前尚不清楚,但普遍认为与高血糖是密切相关的[8]。已知SD大鼠的适应性和抗病性比较强,易于存活,故其常作为糖尿病动物模型的优先选择。STZ是目前最常使用的糖尿病诱发性动物模型方法[9],其溶液制剂不稳定,研究显示在配制STZ溶液时,要求枸橼酸缓冲液的pH值为4.0-4.5,且要现配现用,从配制好的溶液到给大鼠注射完毕最好不要超过1 h[10, 11]。目前国内外对STZ造模的剂量的研究较多,小剂量为25-40 mg/kg,大剂量为50-65 mg/kg,STZ用量不同,可能与不同品系的大鼠及STZ在不同缓冲液中的稳定性有关。本研究选择60 mg/kg体质量STZ单次腹腔注射,糖尿病造模成功率达82.5%,与文献报道的数值接近[12]。
目前在动物模型中多采用机械性触诱发痛和热诱发痛对大鼠的痛觉进行测定。由于糖尿病神经病理性疼痛初期,大鼠温度痛阈改变不明显,故辐射热刺激检测糖尿病痛觉过敏存在它的局限性,因此本研究对大鼠的机械痛阈进行了动态观察。本研究显示糖尿病造模成功后第1周末,即注射STZ后10 d,大鼠的机械痛阈已明显下降,且下降幅度随时间的延长而逐渐增加,与文献报道结果基本相符[13]。
背根神经节是初级传入神经元胞体所在部位,能够传导痛觉,已经成为神经病理性疼痛发病机制研究的重点。前人研究[14-16]显示,光镜下正常组大鼠神经元形态未见明显异常,呈多极状,尼氏体清晰可见,呈斑块状或细粒状散在均匀分布;而糖尿病组见部分神经元变性坏死,胞体肿胀,胞质着色浅,细胞由多极状变为圆形,尼氏体溶解消失。本研究显示电镜下糖尿病组的背根神经节细胞出现明显的病变,胞核、胞质内出现大量的空泡化,线粒体极度水肿,部分细胞坏死,这与前人的组织病理学改变是一致的。
糖尿病患者并发神经系统病变大多数是以周围神经受累为主,其对神经系统的损伤最早从有髓和无髓小神经纤维开始,在动物实验中多半选用腓肠神经标本作为病理观察。有研究[17-20]显示,光镜下正常组神经纤维排列紧密、分布均匀,单个纤维饱满,细胞结构完整,髓鞘着色均匀,可见半月形施旺细胞,而糖尿病组神经纤维排列松散、模糊,扭曲、形态不规则,髓鞘变薄,部分断裂,密度不均匀,本研究显示电镜下糖尿病大鼠有髓神经纤维普遍出现明显的脱髓鞘,髓鞘板层排列紊乱、肿胀,低倍电镜下可见部分髓鞘溶解消失,这与前人光镜下所见的髓鞘变化是相吻合的。长期的高血糖可以损害神经的血管屏障,髓鞘糖基化改变其抗原性,促进来自循环系统、组织及神经胶质细胞的单核巨噬细胞发挥其吞噬功能,然后激活免疫细胞分泌细胞因子如IL-1β和TNF-α,导致糖尿病神经病变的发生发展[21,22]。
本研究选用60 mg/kg体质量的STZ单次腹腔注射成功制备了大鼠Ⅰ型糖尿病模型,动态观察了大鼠的一般状态、血糖、痛阈及神经的病理改变,结果显示随糖尿病病程增加,大鼠的血糖呈进行性升高,痛阈逐渐降低,周围神经病变逐渐加重,为糖尿病神经病理性疼痛早期干预治疗的时间点选择提供了参考依据。
