藏红花素联合顺铂通过抑制ERK信号通路调控胃癌细胞的增殖和凋亡
2019-08-06许存庚骆玉霜
许存庚,骆玉霜
(1青海大学附属医院药剂科,青海 810000;2青海大学附属医院肿瘤内科)
胃癌发病率在我国居于第二,胃癌早期患者临床症状不明显,诊断率较低,大多数患者中晚期确诊,且经手术切除治疗后,仍有一部分患者死于复发、转移,病死率较高,严重威胁人类的健康[1]。顺铂是胃癌晚期患者化疗的基本药物,抗癌作用较强,但存在耐药性,单独使用有效率仅为20%[2]。藏红花为临床常用跌打损伤药物,研究显示其粗提取物藏红花素有较强的抗肿瘤活性,对血液肿瘤、软组织肿瘤以及其他恶性肿瘤均具有较强的抑制作用,且毒副作用较弱,与化疗药物联合后可提高疗效[3,4]。本研究通过体外培养胃癌细胞BGC-823并给予藏红花素联合顺铂处理,以探究藏红花素联合顺铂对胃癌细胞增殖、凋亡的影响以及可能的作用机制,为胃癌的治疗提供一定的依据。
1 材料与方法
1.1 实验细胞
胃癌细胞BGC-823购于中国科学院细胞生物研究所,冻存于本院-80 ℃冰箱中。
1.2 试剂与仪器
藏红花素(批号:20170513)、顺铂(批号:20170427)均购于美国Sigma公司;胰蛋白酶、胎牛血清、RPMI-1640培养基均购于美国Gibco BRL公司;青霉素、链霉素购于杭州碧云天公司;Annexin Ⅴ、碘化丙啶(propidium iodide,PI)、四甲基偶氮畔蓝(MTT)均购于BD Pharmingen公司;超敏ECL发光蛋白购自于美国Thermo Fisher公司;BCA检测试剂盒、PVDF膜购于美国Millipore公司;Anti-p-细胞外调节蛋白激酶(extracellular regulated protein kinase 1/2,ERK1/2)、Anti-Bcl-2、Anti-Bax、Anti-Bcl-2、Anti-cleaved-caspase3、Anti-β-Actin购自美国Cell Signaling公司;HRP标记IgG购自于Santa Cruz公司;RNA提取试剂盒购于Invitrogene公司;RNA反转录试剂盒购于日本Takara公司;ERK抑制剂PD098059购于MedChemExpress公司;酶标仪购于美国Thermo公司;流式细胞仪购于美国BD公司;凝胶图像分析仪英国Alpha公司;垂直电泳仪美国Bio-RAD公司。
1.3 实验方法
1.3.1 细胞培养 从-80 ℃中取出冰冻BGC-823细胞,37 ℃解冻后加入胰蛋白酶液消化,制备单细胞悬浮液,细胞数目调整为1×106/ml接种于含10%FBS、双抗的RPMI-1640培养液,置于37 ℃、5% CO2的潮湿培养箱中培养,待细胞铺满瓶底80%时,添加2%胰酶消化,行传代培养。
1.3.2 细胞处理及分组 实验一:取对数期生长细胞,分为空白组、藏红花素组、顺铂组、藏红花素+顺铂组。空白组细胞不进行任何处理,藏红花素组细胞中添加含8 mg/ml藏红花素培养液处理,顺铂组细胞中添加0.8 μg/ml顺铂处理;藏红花素+顺铂组细胞中同时添加0.8 μg/ml顺铂与8 mg/ml藏红花素培养液,以上四组细胞处理后均培养48 h。
实验二:取对数期生长细胞,分为空白组、藏红花素+顺铂组、ERK抑制剂组,藏红花素+顺铂+抑制剂组(联合组)。空白组细胞不进行任何处理,藏红花素+顺铂组细胞培养液中添加0.8 μg/ml顺铂与8 mg/ml藏红花素,抑制剂组添加20 μmol/L PD098059;联合组细胞培养液中依次添加20 μmol/L PD098059、0.8 μg/ml顺铂、8 mg/ml藏红花素;四组细胞处理后均继续培养48 h。
1.3.3 MTT检测细胞增殖情况 收集1.3.2中实验一及实验二细胞,消化后制备细胞悬液,浓度调整为1×104个/ml接种96孔板,设定6个平行孔,重复3次,各组细胞分别培养24,36,48,72 h,在避光条件下加入10 μl MTT溶液,置于37 ℃,5%CO2饱和湿度的培养箱中培养4 h,取出细胞培养板,弃去每孔培养液,每孔加入150 μl二甲基亚砜溶液,振荡10 min,使紫色结晶物完全溶解。使用酶标仪于570 nm波长下测定每孔吸光值。细胞增殖抑制率(%)=(空白组吸光度-实验组吸光度)/空白组吸光度×100%。每个浓度设置6个重复组,实验重复3次。
1.3.4 免疫印迹法(Western blot,WB)检测BGC-823细胞中ERK1/2、p-ERK1/2表达及凋亡蛋白表达情况 收集1.3.2中实验二细胞,添加细胞裂解液裂解BGC-823细胞,参照蛋白提取试剂盒提取细胞总蛋白,BCA法测定蛋白浓度,统一上样20 μg总蛋白,加热煮沸、离心后行SDS-PAGE电泳,结束后将蛋白凝胶转移至PVDF膜上,于半干转膜仪冰上行转膜反应,滴加Anti-ERK1/2(1 ∶1 000)、Anti-p-ERK1/2抗体(1 ∶1 000),4 ℃孵育过夜,添加二抗(1 ∶2 000)37 ℃孵育1 h。加入ECL发光剂显影后,置于凝胶成像仪中保存图像。采用Gel-Pro analyzer4软件对图片蛋白条带进行扫描,分析p-ERK1/2、ERK1/2的表达水平,并检测细胞中Bax、cleaved-caspase3、Bcl-2(抗体均为1 ∶5 000)蛋白表达情况。
1.3.5 Hoechst33258染色观察细胞形态变化 收集1.3.2中实验二细胞,接种4×104个细胞至盖玻片的6孔板内,将细胞培养在培养皿或平板上,待80%细胞融合后,舍弃培养液,将盖玻片4%多聚甲醛过夜固定预冷PBS溶液清洗3次后,添加5 μg/ml的Hoechst 33258染液,室温下避光孵育15 min,PBS清洗3次后,置于高内涵活细胞成像仪中观察BGC-823细胞形态变化。
1.3.6 流式细胞术检测细胞凋亡 收集1.3.2中实验二细胞,添加PBS溶液清洗2次,加入0.2%胰酶溶液消化PBS溶液洗涤2次后,3 000 r/min离心5 min后,收集细胞,添加上样缓冲液,细胞密度调整为5×105/ml。先后添加5 μl Annexin-Ⅴ-FITC染液及PI染液,室温下避光孵育20 min,流式细胞仪中分析细胞凋亡情况。
1.4 统计学方法

2 结果
2.1 藏红花素联合顺铂对细胞增殖抑制率的影响
与空白组相比,藏红花素组、顺铂组、藏红花素组+顺铂组24,36,48,72 h细胞增殖抑制率均显著升高(P<0.05),与藏红花素组、顺铂组相比,藏红花素+顺铂组于24,36,48,72 h细胞增殖抑制率均显著升高(P<0.05,见表1)。
2.2 藏红花素联合顺铂对胃癌细胞增殖抑制率的影响
与空白组相比,藏红花素+顺铂组、抑制剂组24,36,48,72 h细胞增殖抑制率均显著升高(P<0.05),与藏红花素组+顺铂组相比,联合组增殖抑制率显著升高(P<0.05,见表2)。

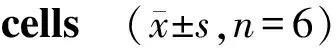

组别抑制率(%) 24 h36 h48 h72 h空白组0.08±0.020.05±0.01△0.06±0.020.07±0.02藏红花素组6.85±0.53∗7.38±0.19∗△8.16±0.34∗△★9.35±0.17∗△★▲顺铂组7.24±0.75∗7.42±0.25∗8.59±0.16∗△★9.67±0.21∗△★▲藏红花素+顺铂组13.39±1.58#15.66±2.15#17.42±2.23#△19.48±1.76#△★
与空白组比较,*P<0.05;与藏红花素+顺铂组比较,#P<0.05;与24 h比较,△P<0.05;与36 h比较,★P<0.05;与48 h比较,▲P<0.05
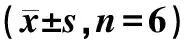


组别抑制率(%) 24 h36 h48 h72 h空白组0.07±0.010.04±0.010.05±0.010.06±0.02藏红花素+顺铂组10.34±0.49∗13.14±0.72∗15.43±1.24∗17.26±1.18∗抑制剂组9.47±0.83∗12.63±0.93∗14.32±1.82∗16.78±1.23∗联合组17.42±2.19#20.36±2.43#23.29±2.16#25.48±1.64#
与空白组比较,*P<0.05;与藏红花素+顺铂组、抑制剂组比较,#P<0.05;抑制剂组为ERK抑制剂(20 μmol/L PD098059),联合组为藏红花素+顺铂+抑制剂
2.3 各组ERK蛋白表达情况
与空白组相比,藏红花素+顺铂组、抑制剂组p-ERK1/2蛋白相对表达均显著降低(P<0.05),与藏红花素组+顺铂组相比,联合组p-ERK1/2蛋白相对表达显著降低(P<0.05)。各组ERK1/2蛋白表达无显著变化(P>0.05,见图1,表3)。

1.空白组;2.藏红花素+顺铂组;3.抑制剂组;4.联合组图1 藏红花素+顺铂对ERK蛋白表达的影响Figure 1 Effect of crocin combined with cisplatin on expression of ERK protein in gastric cancer cells



组别ERK1/2p-ERK1/2 空白组0.85±0.091.09±0.13 藏红花素+顺铂组0.84±0.080.67±0.08∗ 抑制剂组0.86±0.090.41±0.06∗ 联合组0.85±0.060.25±0.04∗#
与空白组比较,*P<0.05;与藏红花素+顺铂组、抑制剂组比较,#P<0.05
2.4 各组细胞形态变化情况
空白组细胞形态无明显变化,藏红花素+顺铂组、抑制剂组细胞浆、细胞核浓缩,且细胞核破碎,联合组破碎程度最明显,较正常细胞荧光强度高,死亡细胞数量增多(见图2)。
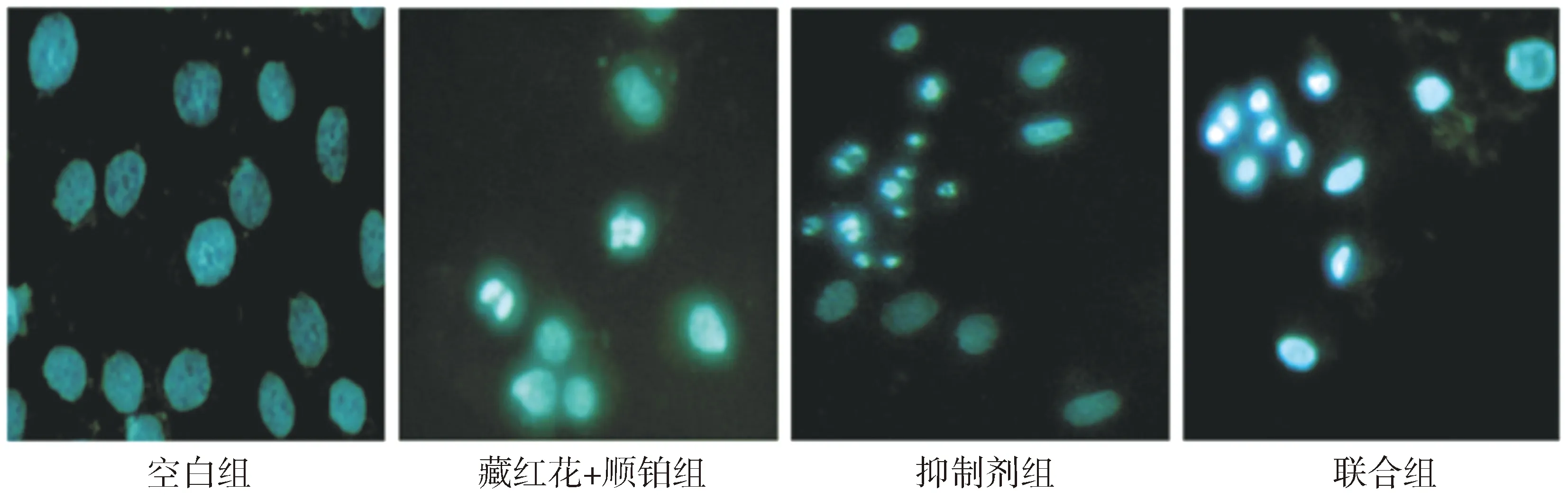
图2 Hoechst33258染色观察藏红花素+顺铂组、抑制剂组和联合组细胞形态变化 (×200)Figure 2 Morphological changes in crocin+cisplatin group, inhibitor group and combination group by Hoechst 33258 staining (×200)
2.5 藏红花素联合顺铂对胃癌细胞凋亡率的影响
与空白组相比,藏红花素+顺铂组、抑制剂组细胞凋亡率显著升高(P<0.05),与藏红花素+顺铂组、抑制剂组相比,联合组细胞凋亡率显著升高(P<0.05,见图3,表4)。

图3 流式细胞仪检测空白组、藏红花素+顺铂组、抑制剂组和联合组细胞凋亡情况Figure 3 Apoptosis in blank group, crocin+cisplatin group, inhibitor group and combination group by flow cytometry


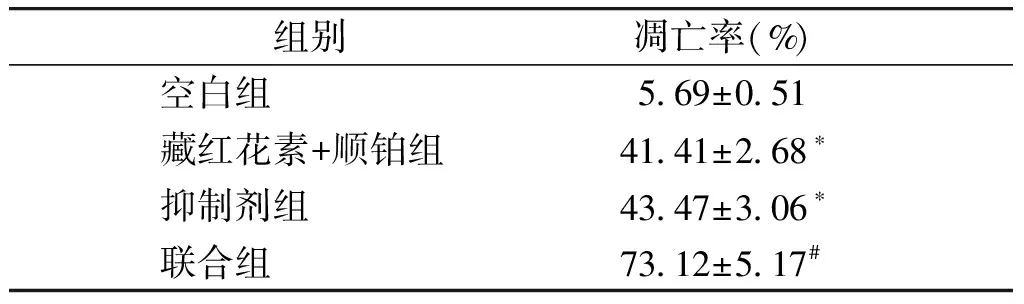
组别凋亡率(%)空白组5.69±0.51藏红花素+顺铂组41.41±2.68∗抑制剂组43.47±3.06∗联合组73.12±5.17#
与空白组比较,*P<0.05;与藏红花素+顺铂组、抑制剂组比较,#P<0.05
2.6 各组凋亡蛋白表达情况
与空白组相比,藏红花素+顺铂组、抑制剂组Bax、cleaved-caspase3蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05),与藏红花素组+顺铂组相比,联合组Bax、cleaved-caspase3蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05,见图4,表5)。
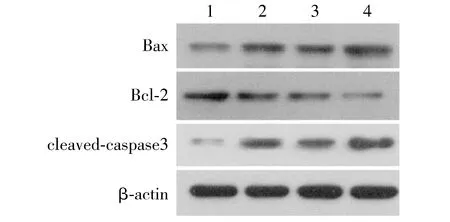
1.空白组;2.藏红花素+顺铂组;3.抑制剂组;4.联合组图4 Western blot检测Bax、cleaved-caspase3、Bcl-2蛋白表达Figure 4 Expression of Bax, cleaved-caspase 3, Bcl-2 protein expression by Western blot



组别BaxBcl-2cleaved-caspase3空白组0.32±0.040.88±0.050.17±0.04藏红花素+顺铂组0.64±0.07∗0.71±0.06∗0.45±0.03∗抑制剂组0.66±0.15∗0.68±0.04∗0.49±0.06∗联合组1.13±0.12#0.25±0.03#0.85±0.07#
与空白组比较,*P<0.05;与藏红花素+顺铂组、抑制剂组比较,#P<0.05
3 讨论
胃癌是临床常见恶性肿瘤,临床主要采用手术结合放化疗治疗,顺铂为常用化疗药物,但耐药性较高,因此临床疗效有限,需结合其他药物以提高治疗效果[5]。以往临床采用药物逆转肿瘤耐药性,如免疫抑制剂、钙通道阻断剂、类固醇等,但由于以上药物并非特异性药物,用药剂量较大,毒副作用较大,因此临床应用受限[6,7]。藏红花素为藏红花主要活性单体成分,具有较强抗肿瘤活性,对结肠癌、胃癌、卵巢癌等具有一定的抑制作用[8],然而藏红花素联合顺铂后是否可增强胃癌细胞的抑制作用,目前研究不多,因此探究两者联合应用对胃癌的影响,对于胃癌的药物治疗十分重要。
大量研究[9]显示藏红花素能够抑制肿瘤细胞增殖,动物研究显示前列腺癌小鼠给予藏红花素治疗后,体内肿瘤生长速度明显降低,生存期得到延长。胰腺癌中研究[10]发现藏红花素对人HPAC细胞具有一定的抑制作用,且可诱导细胞凋亡。本研究结果显示与空白组相比,藏红花素处理组胃癌细胞BGC-823增殖抑制率明显升高,流式细胞术检测显示细胞凋亡率升高,提示藏红花素处理可抑胃癌细胞增殖诱导其凋亡。
藏红花素联合其他抗癌药物治疗后能够改善临床疗效[11]。张珞等[12]研究显示藏红花素可提高肺腺癌细胞对顺铂、培美曲塞化疗敏感性。此外还有研究显示藏红花素联合顺铂后能够提高对胃癌细胞的抑制作用,增强对胃癌细胞的诱导作用[13]。本研究结果显示与藏红花素组、顺铂组相比,藏红花素+顺铂组细胞抑制率明显升高,且凋亡率也明显升高,推测与单独采用藏红花素组、顺铂组相比,藏红花素+顺铂组可增强胃癌细胞的抑制、促凋亡作用。
目前对于藏红花素抗肿瘤机制研究较多,如通过抑制肿瘤细胞增殖、促进其凋亡以及其他信号转导途径等发挥抗增殖、促凋亡作用[14],但目前其具体作用机制尚未得到证实。MAPK信号通路是将细胞外刺激传递至细胞内反应的重要信号转导途径,主要参与肿瘤细胞的增殖、分化、凋亡,尤其在恶性肿瘤细胞的增殖、凋亡中发挥重要的作用。MAPK信号通路主要包括ERK、JNK/SAPK、P38、BMK1/ERK5四条通路,其中ERK目前研究最多,与癌症发生、发展密切相关,较多研究显示ERK信号通路参与胃癌细胞的凋亡、侵袭过程[15]。p-ERK为ERK的活化形式,ERK磷酸化活性增强后转化为p-ERK,可促进癌症相关基因以及细胞周期调节基因的转录和表达,从而参与细胞的生长发育、增殖凋亡及分化和恶性转化,持续激活ERK信号通路可促进正常细胞向肿瘤型转化,而抑制ERK信号传导通路则能促使肿瘤细胞慢慢恢复到非转化型。金子等[16]研究显示,姜黄素通过抑制ERK信号通路的活化,进而抑制肿瘤细胞的增殖,诱导其凋亡。漆黄素通过调控ERK信号通路诱导人宫颈癌细胞凋亡[17]。以上研究均提示ERK信号通路与癌细胞的增殖、凋亡相关。
本研究显示与藏红花素+顺铂组、ERK抑制剂组相比,联合组细胞抑制率、凋亡率进一步降低,表明联合处理后可进一步降低细胞增殖、诱导其凋亡,这可能与阻断MAPK/ERK信号通路活性有关,结合过往研究推测藏红花素+顺铂可能通过抑制ERK信号通路发挥肿瘤抑制、凋亡作用。
Bcl-2表达上调可抑制Bax的作用,从而促使Bax/Bax同源二聚体解离,形成稳定的Bcl-2/Bax异二聚体,达到抗凋亡的作用。当Bax表达上调后,Bax/Bax同源二聚体将会增多,而线粒体通透性将会增加,进而促使细胞色素C释放,激活caspase家族,促进凋亡[18]。本研究显示与藏红花素组+顺铂组、抑制剂组相比,联合组Bax、cleaved-caspase3蛋白表达显著升高,Bcl-2蛋白表达显著降低,推测藏红花素+顺铂组可上调Bax表达促进Caspase3活化,进而诱导细胞凋亡。
综上所述,藏红花素联合顺铂可抑制胃癌细胞的增殖、促进其凋亡;其作用机制可能与抑制ERK信号通路,上调凋亡蛋白表达有关,然而胃癌细胞增殖、凋亡机制较复杂,是否还通过其他通路发挥作用,这还有待后续深入研究。
